抗真菌物质HSAF发酵全合成培养基的筛选
2022-07-09王金子赵延存刘凤权
汤 宝,王金子,赵延存,刘凤权
(1.江苏省农业科学院植物保护研究所/江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,南京 210014;2.南京农业大学植物保护学院,南京 210095;3.江苏大学生命科学学院,镇江 212013;4.海南大学植物保护学院,海口 570228)
热稳定抗真菌因子(Heat stable antifungal factor,简称HSAF)是产酶溶杆菌产生的一种活性抗菌物质,分子量为512 Da,其结构由一个独特的大环内酰胺体系、一个四胺酸结构单元和5,5,6-三环组成,这一新颖结构不同于目前市场上任何一种杀真菌剂[1,2]。HSAF对病原真菌的作用方式也与目前已报道的商用杀真菌剂截然不同,它通过抑制病原菌神经酰胺合成酶活性,改变鞘脂类化合物的形成,从而影响菌丝的极性生长[3]。HSAF生物合成主要由一个杂合的聚酮合酶(PKS)/非核糖体肽合成酶(NRPS)来完成,PKS负责合成HSAF结构中的两条聚酮链,然后通过NRPS与鸟氨酸结合形成HSAF的骨架结构(大环内酰胺)[4,5]。综上所述,HSAF可以代表一类化学结构和作用方式新颖、生物合成机制独特、对环境友好的生物杀菌剂。
一直以来,国内外学者对HSAF的合成机制和发酵调控进行了大量研究,使HSAF产量得到了不断提高,当前报道最高产量为440.26 mg/L[6],但进一步提高存在限制,主要原因是HSAF合成代谢规律尚不清楚,无法确定影响产量的确切因素。目前关于HSAF研究所采用的培养基为天然培养基(10% TSB)[7]或者半合成培养基(其中含有大豆粉)[8],它们均含有不明确的成分,难以用于胞内代谢途径研究。而合成培养基营养成分明确,能有效弥补这一缺点。
本研究在前期基础上,首先设计一种基本的合成培养基,接着通过单因素缺失试验对影响HSAF发酵的具体碳源、氮源等进行考察,筛选出最为合适的培养基成分,最后应用正交方法对各组分进行优化,获得一种有利于HSAF发酵的全合成培养基。该研究为后续提高HSAF产量打下坚实的基础。
1 材料与方法
1.1 菌种
HSAF发酵菌株产酶溶杆菌OH11为本实验室从辣椒根际土壤中分离获得[9],甘油管保藏于-80 ℃超低温冰箱中。
1.2 化学试剂
酵母抽提物、胰蛋白胨,Oxoid公司;其他各类化学试剂,国药集团化学试剂有限公司。
1.3 培养基
LB固体培养基:酵母抽提物5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L、琼脂粉20 g/L,pH自然。LB液体培养基为不加琼脂的LB固体培养基。发酵培养基(g/L):具体成分参照如下试验,并利用0.1 mol/L HCl或NaOH调至pH 7.0。
金属离子混合母液(g/L):NaCl 5、CaCl21.25、ZnSO4·7H2O 1.25、MgSO4·7H2O 1.25、FeSO4·7H2O 1.0、MnCl2·4H2O 0.5、CuSO4·5H2O 0.5。
1.4 培养方法
平板培养:取出-80 ℃超低温冰箱中的OH11菌株甘油管,冰上融化后倒入含50 mL LB培养液的三角瓶中,28 ℃、180 r/min过夜培养,用接种环蘸取菌液在固体平板上划线,于28 ℃恒温箱中静置培养48 h。
种子液培养:划取平板上的单菌落于50 mL LB培养液中,28 ℃、180 r/min振荡培养至OD600≈1.5,即为种子液。
摇瓶发酵培养:按照2.5%的接种量将种子液转接至装有50 mL发酵培养基的250 mL三角瓶中,28 ℃、180 r/min振荡培养48 h,每组实验设置3个平行。
1.5 单因素缺失试验
在基本培养基其他组分不变的基础上,通过单因素缺失试验考察不同碳源、氮源、金属离子、磷酸缓冲盐对细胞生长及HSAF产量的影响。首先是将基本培养基中葡萄糖和蔗糖替换成单一碳源(葡萄糖、果糖、木糖、蔗糖、麦芽糖、可溶性淀粉),质量浓度均为8 g/L;确定适宜单一碳源后,对其浓度进行优化,设置浓度梯度为2、4、8、12、16、20 g/L。然后,按照上述方案对氮源、金属离子、磷酸缓冲盐种类及添加浓度进行研究。氮源种类:NH4Cl、(NH4)2SO4、NaNO3、尿素,质量浓度均为2 g/L;确定适宜氮源后,设置质量浓度梯度0.5、1、2、4、8 g/L。金属离子种类及质量浓度为:FeSO4·7H2O(10 mg/L)、FeCl3(10 mg/L)、MgSO4·7H2O(20 mg/L)、CaCl2(20 mg/L)、MnCl2·4H2O(10 mg/L)、CuSO4·5H2O(10 mg/L)、ZnSO4·7H2O(20 mg/L);确定FeCl3为适宜金属离子后,设置质量浓度梯度为2、4、8、16、32、48 和 64 mg/L。磷酸缓冲盐组合为 K2HPO4和 KH2PO4、Na2HPO4和 NaH2PO4、K2HPO4和 NaH2PO4、Na2HPO4和KH2PO4,质量浓度分别为1.0、0.5 g/L;确定适宜磷酸盐后,设置质量浓度梯度如表1所示。

表1 不同磷酸钾缓冲盐浓度Table 1 Different concentrations of potassium phosphate buffer
1.6 正交试验设计
在单因素试验的基础上,以葡萄糖(A)、(NH4)2SO4(B)、FeCl3(C)、K2HPO4和 KH2PO4(D)为研究因素,以发酵液中HSAF产量为指标,采用L9(34)正交表设计四因素三水平正交试验,如表2所示,设计软件为正交试验助手,并对试验结果进行分析。
1.7 生物量测定
菌体生物量采用干细胞重量(Dry cell weight,DCW)来表示,具体如下:取发酵液200 μL,通过超微量核酸蛋白测定仪(Eppendorf BioPhotometer plus)在波长600 nm出测定菌液吸光值(Optical density,OD),按照干细胞重量与吸光值间的标准曲线(Y=0.4841X-0.0718,R2=0.9985,其中X指 OD600,Y指DCW),将OD600换算成DCW。
1.8 HSAF提取检测
取3 mL发酵液加入浓 HCl调节pH至2.5,按照与发酵液等比例加入3 mL乙酸乙酯,旋涡振荡1 min,10000 r/min离心3 min,吸取1 mL上清液与通风橱中吹干,最后加入500 μL甲醇溶解后用于HPLC分析,进样量为20 μL,检测条件为,紫外吸收值:318 nm,反相柱:InterSustainSwift C18 5 μm,250×4.6 mm,流动相:溶液A(0.025% TFA水溶液)和溶液B(0.025% TFA乙腈溶液),流速:1 mL/min;进样程序:0~10 min,将溶液B 5%~25%;25 min,增长到80% B;26 min,增长到100%;30 min返回到5%,溶液A和B总比例为100%。记录HSAF特征峰面积,通过HSAF浓度与峰面积间的线性方程(Y=0.00004X+32.385,R2=0.9998)计算发酵液中HSAF的具体产量。
1.9 数据统计与分析
试验数据采用Excel 2013和OriginPro 8.6软件进行统计分析和差异显著性检验,利用OriginPro 8.6作图。
2 结果与分析
2.1 基本培养基的设计
本研究在前期半合成培养基的基础上[8],设计基本培养基成分如下:葡萄糖6 g/L,蔗糖2 g/L;NH4Cl 1 g/L,NaNO31 g/L;金属离子混合母液1 mL;K2HPO41 g/L,KH2PO40.5 g/L,研究菌株生长及HSAF合成情况。发酵试验结果表明,OH11在所设计的基本培养基上生长比较旺盛,DCW达到(1.83±0.08)g/L。而且HSAF也有较高水平的积累,为(112.08±4.63)mg/L,这是10%TSB培养基(29.34 mg/L)下HSAF产量的3.82倍。因此,可将此基本培养基用于下一步单因素试验。
2.2 不同碳源对HSAF发酵的影响
将基本培养基中葡萄糖和蔗糖替换成单一碳源,研究菌株生长和HSAF产生情况。结果如图1A所示,HSAF合成最适碳源为麦芽糖,产量达到(162.08±8.38)mg/L,其次是葡萄糖,而在木糖、阿拉伯糖下完全不能合成。以葡萄糖作为唯一碳源时HSAF产量虽略低于麦芽糖,但无显著性差异。当葡萄糖浓度为2~8 g/L时,DCW和HSAF产量均随着浓度的增加而呈现上升趋势;当葡萄糖浓度为8~20 g/L时,随着浓度增加反而出现下降,这很可能是由于高浓度葡萄糖产生底物抑制造成的[10]。因此,葡萄糖最适浓度为8 g/L,此时DCW及HSAF产量均达到最大,分别为(2.12±0.06)g/L和(152.08±8.48)mg/L。
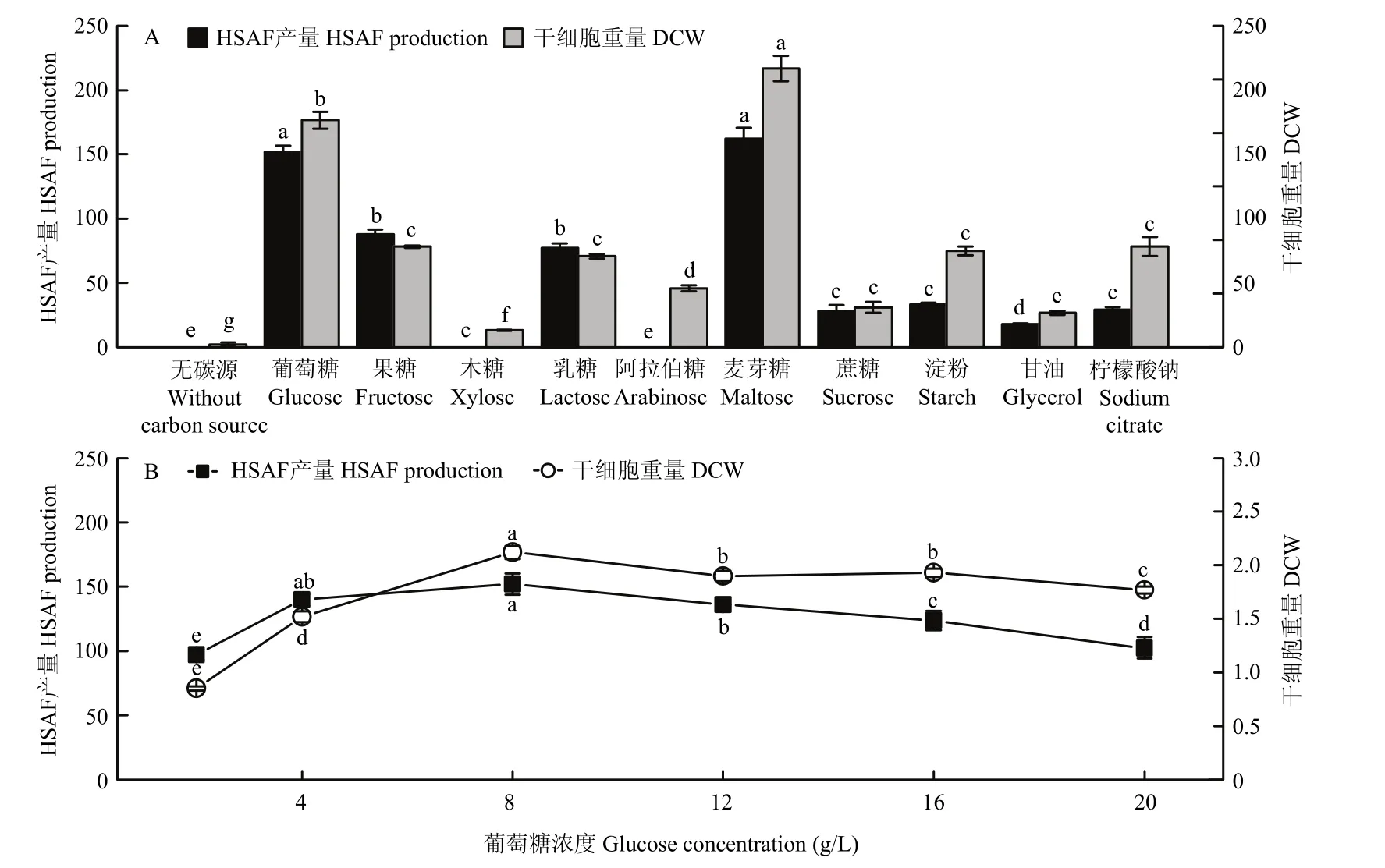
图1 碳源种类和浓度对HSAF产量及生物量的影响Fig.1 Effects of carbon source types and concentrations on HSAF production and biomass
2.3 不同氮源对HSAF发酵的影响
研究了无机氮源种类和浓度对HSAF发酵的影响。由图2A所示,OH11菌株对NH4Cl、(NH4)2SO4的利用要明显优于NaNO3、尿素,特别是(NH4)2SO4作为唯一氮源条件下,HSAF产量最高达到(140.30±6.51)mg/L。故选择(NH4)2SO4作为HSAF发酵全合成培养基中的最适氮源。进一步,对其添加浓度进行了考察,如图2B所示。低浓度的(NH4)2SO4对细胞生长及HSAF产量均具有促进作用,而随着的浓度的升高,细胞生长受到抑制,导致DCW和HSAF产量出现下降。因此,确定最适(NH4)2SO4浓度为1 g/L。
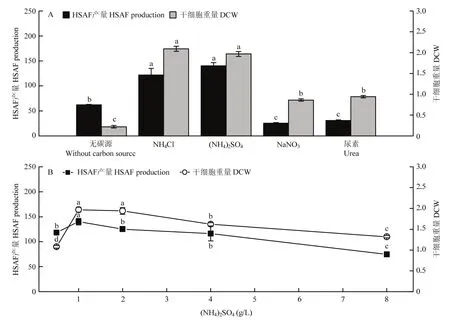
图2 氮源种类和浓度对HSAF产量及生物量的影响Fig.2 Effects of nitrogen source types and concentrations on HSAF production and biomass
2.4 不同金属离子对HSAF发酵的影响
由图3A可知,不同种类金属离子对OH11细胞生长影响较小,而对HSAF产量影响显著。Mn2+、Cu2+、Zn2+对HSAF产量均有一定程度的抑制作用,Fe2+、Fe3+能显著促进HSAF合成。由于Fe2+性质不稳定,在酸性溶液中容易被氧化[11],故选用Fe3+作为最佳金属离子。通过对Fe3+添加浓度进行考察,发现DCW和HSAF产量在16 mg/L时均达到最大(图3B),为(2.59±0.05)g/L和(196.73±6.52)mg/L。因此,选取此添加量用于后续研究。
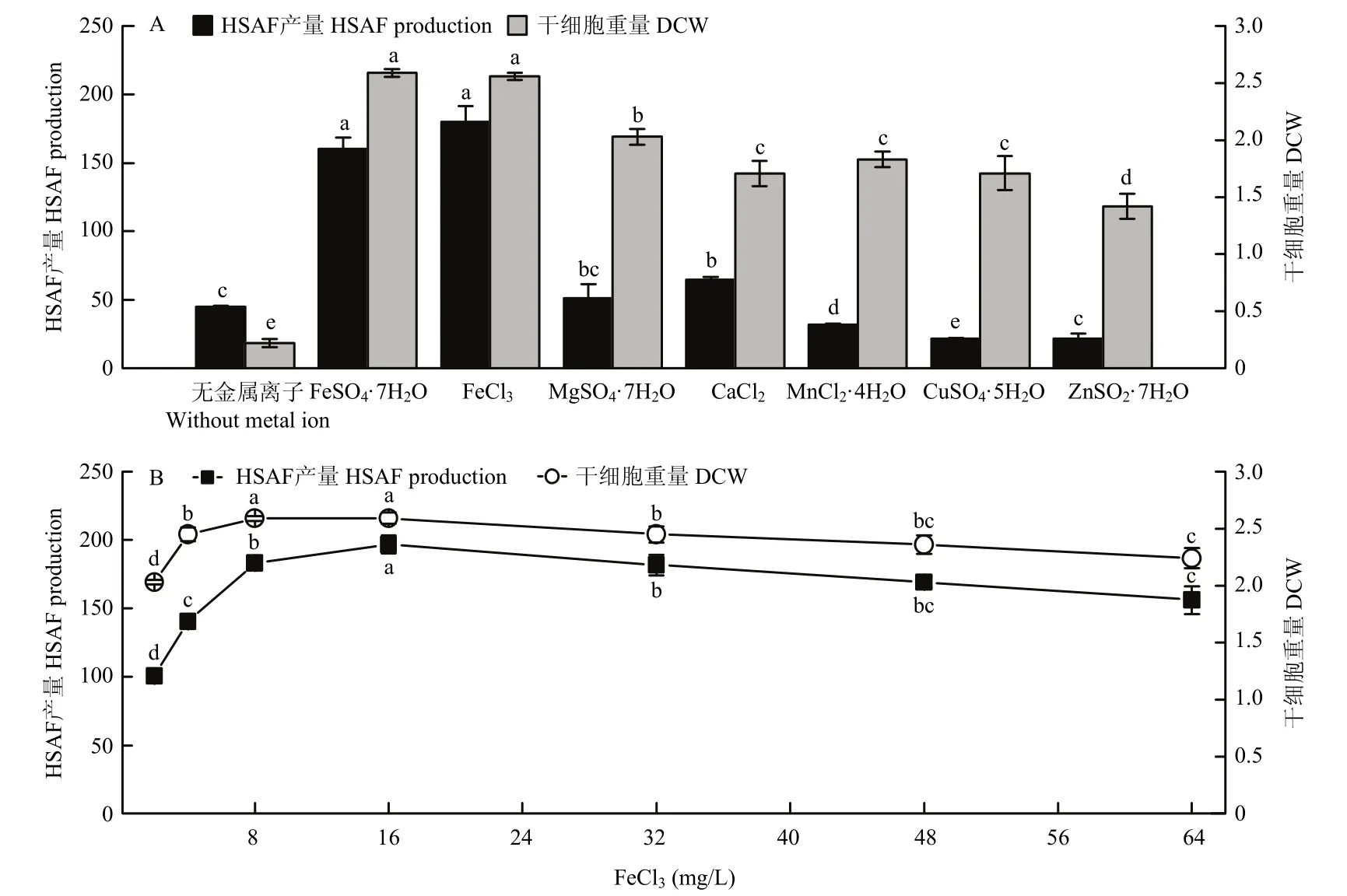
图3 金属离子种类及浓度对HSAF产量及生物量的影响Fig.3 Effects of metal ion types and concentrations on HSAF production and biomass
2.5 不同磷酸缓冲盐对HSAF发酵的影响
在4种不同磷酸缓冲盐组合中,DCW、和HSAF产量均在K2HPO4和KH2PO4下取得最大,因此选用K2HPO4、KH2PO4作为合成培养基中的缓冲盐(图 4A)。进一步研究不同浓度的磷酸钾缓冲盐对 HSAF发酵的影响如图4B所示,随着浓度的升高,DCW 和HSAF产量逐渐提高,在P5时达到最大,随后,出现下降。因此,确定最适的磷酸钾缓冲盐体系为P5,即K2HPO41.0 g/L和KH2PO40.5 g/L。
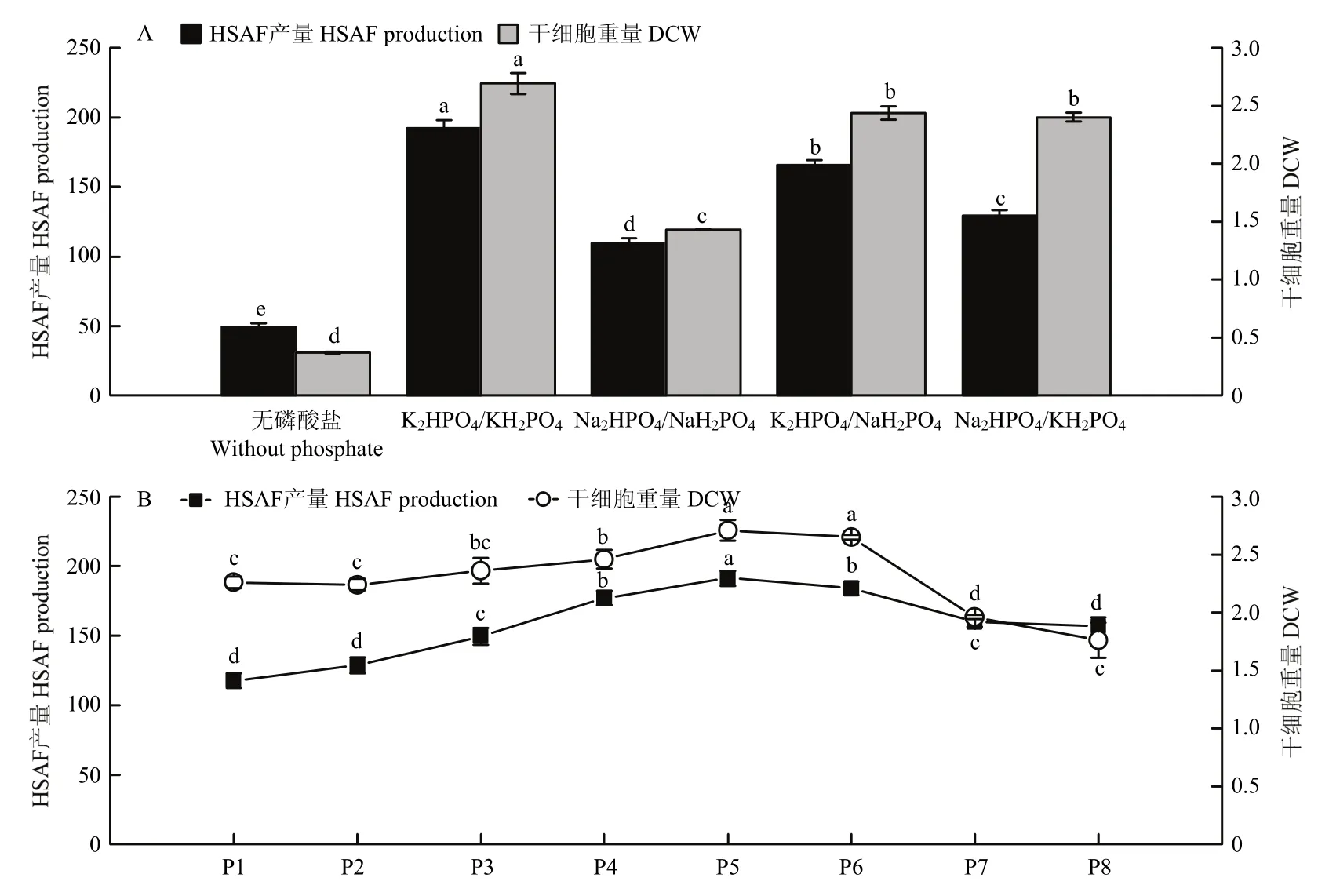
图4 磷酸缓冲盐种类及浓度对HSAF产量及生物量的影响Fig.4 Effects of phosphate buffer types and concentrations on HSAF production and biomass
2.6 正交试验优化及验证
在单因素试验的基础上,为了获得 HSAF发酵最佳全合成培养基配方,利用正交试验,对葡萄糖、(NH4)2SO4、FeCl3、磷酸钾缓冲盐4个因素进行优化,试验及分析结果如表2所示。根据极差R分析,四种因素对HSAF产量的影响大小排序为A>B>C>D;同时还可以看出,A、B、C、D四种因素各个水平中,A2、B2、C1及D2均数K最大,其最优组合为A2B2C1D2,即全合成培养基配方为:葡萄糖8 g/L、(NH4)2SO41 g/L、FeCl38 mg/L、K2HPO41.0 g/L、KH2PO40.5 g/L。将上述培养基经摇瓶发酵验证后,DCW 为(3.27±0.14)g/L,HSAF产量达到(215.46 ±6.85)mg/L,略高于正交试验组合方案,能够证实本研究中正交试验结果具有高度的可靠性。
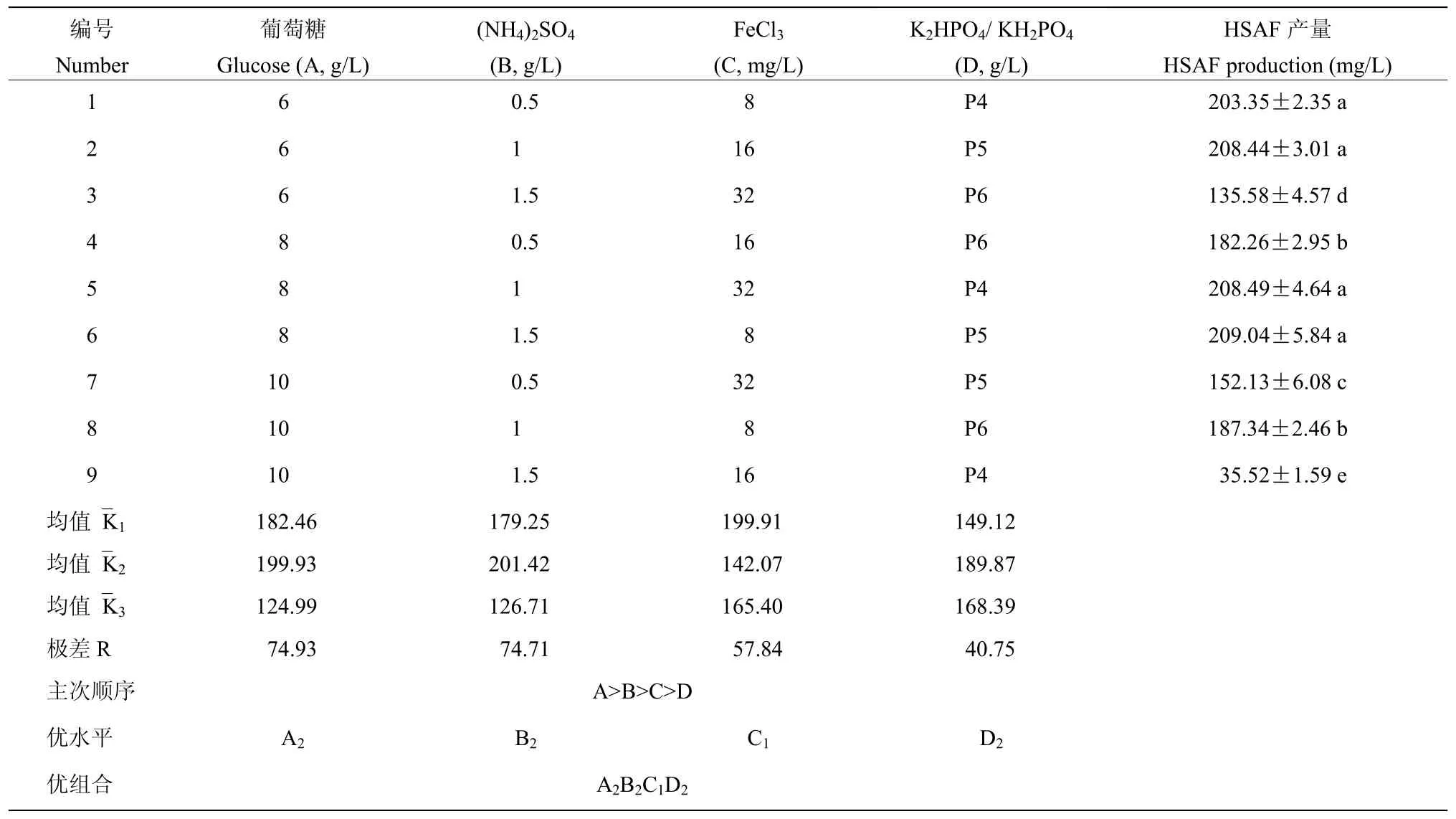
表2 L9(34) 正交试验设计及结果分析Table 2 L9 (34) orthogonal experimental design and result analysis
2.7 优化培养基与原始培养基比较
采用优化后的合成培养基培养OH11菌株48 h,发酵液中DCW 为(3.27±0.14)g/L、HSAF产量达到(215.46±6.85)mg/L,相比优化前基本培养基分别提高了78.69%、92.24%,说明优化后的合成培养基更有利于菌株OH11生长并产生代谢物质。
3 讨论
培养基营养成分对于微生物的生长代谢至关重要。营养过多会使细菌生长快速,抑制目标产物合成;而营养缺乏细菌生长太慢,产物合成减少[12]。通过对合成培养基组分的研究,能够明确发酵底物的代谢流向,更加深入的理解代谢合成规律,确定影响产量的主要因子,有利于优化发酵培养基,推动实际生产,也利于代谢产物合成机制的研究。如陈腾飞[13]开发了一种适宜绛红小单孢菌产庆大霉素Cla的全合成培养基,使Cla产量提高了35.3%,并通过13C标记分析了木糖对菌体代谢的影响机理,为工业生产菌株的基因改造及生产工艺优化提供了依据。廖建国等[14]运用高通量筛选技术优化了红霉素A发酵的合成培养基,是优化前培养基下红霉素A产量的13.6倍。王龙等[15]首次筛选到以硝酸钾为主要氮源的合成培养基,将土霉素合成能力从75.2 mg/L提高到145.6 mg/L,并应用到13C葡萄糖标记试验,证实了龟裂链霉素中不存在 2-酮-3-脱氧-6-磷酸葡糖酸裂解途径。田云龙等[16]对中生菌素产生菌发酵合成培养基进行了设计和优化,使中生菌素可达2000 mg/L,为营养生长、代谢、遗传育种和产素机制等研究提供了基础。
本研究首先通过单因素试验明确了不同营养物质对HSAF产量的影响,对于其定向发酵调控具有重要的指导意义。从结果来看,碳源是菌株OH11生长和HSAF合成唯一必需的营养成分,研究表明碳源是一种为微生物细胞生长代谢提供骨架和能量的基本前体物质[17];另外OH11对各类碳源的偏好和利用程度不尽相同,这主要与微生物细胞内的酶系有关。鉴于葡萄糖作为一种工业发酵中最常用的碳源,来源广泛,价格低廉(单价约为麦芽糖的1/5)[18],故选择葡萄糖作为合成培养基中的最适碳源。对于筛选最佳氮源,发现铵态氮(NH4+)比硝态氮(NO3-)更有利于菌体生长和HSAF的合成,但随着NH4+的浓度的升高,细胞生长和HSAF产量明显受到抑制,其主要原因是NH4+能通过影响细胞内某些氨基酸脱氢酶和酰基转移酶的活性,以此改变相关氨基酸的代谢和前体合成水平,最终影响抗生素的生物合成[19,20]。除了必需的能源和营养物质外,OH11的生长代谢还需要金属离子,特别是Fe2+、Fe3+均能显著促进菌株生长和HSAF合成。铁元素是微生物生长必不可少的微量元素,参与诸多代谢过程,如氧的运输、细胞呼吸,许多酶的重要辅因子[21,22]。与对照相比(不添加磷酸盐),磷酸盐添加对细胞生长和HSAF产量都具有明显的促进作用。一方面,磷酸盐能维持发酵过程中培养基pH的相对稳定[23];另外,磷还是磷壁酸、高能磷酸化合物的重要组成部分,能为细胞代谢传递能量[24]。在不同磷酸缓冲盐对HSAF发酵的影响中,发现磷酸钾缓冲盐比磷酸钠缓冲盐要更适合HSAF发酵过程。
本研究利用正交试验对培养基成分进行了优化,试验过程简单高效、结果可靠等[25],不仅获得了最适配方:葡萄糖8 g/L、(NH4)2SO41 g/L、FeCl38 mg/L、K2HPO41.0 g/L、KH2PO40.5 g/L,还明确了各成分对HSAF产量的影响主次。在此配方下,HSAF产量为(215.46±6.85)mg/L,这是10% TSB培养基(29.34 mg/L)下的 7.34倍。虽然低于大豆粉培养基(356.34±13.86)mg/L,但该培养基优势在于成分已知、含量稳定,不仅能避免工业生产中因大豆粉生产批次不同而导致HSAF产量不稳定现象,而且可以对OH11的胞内代谢特征和HSAF合成的关键因素进行深入研究,进而提高产量并降低生产成本。
