简青霉CEF-818固体发酵工艺优化
2022-07-09蒲丹丹赵丽红张亚林冯鸿杰朱荷琴顾爱星冯自力
蒲丹丹,李 艳,赵丽红,张亚林,魏 锋,冯鸿杰,朱荷琴,顾爱星,彭 军,*,冯自力*
(1.新疆农业大学农学院/棉花教育部工程研究中心,乌鲁木齐 830052;2.中国农业科学院棉花研究所/棉花生物学国家重点实验室,安阳 455000)
棉花是重要的纤维作物之一,作为我国重要的战略物资,具有很高的经济价值和国防地位。由大丽轮枝菌Verticilliumdahliae引起的棉花黄萎病(Cotton Verticillium wilt)是世界范围内重要的土传病害。该病于1914年在美国弗吉利亚州首次被发现[1,2],随后,在1935年由美国传入我国,并逐年蔓延扩散,尤其是1993年,该病在我国各棉区大面积爆发,达到267万hm2[3,4],严重影响我国棉花产量和纤维品质,成为我国棉花优质高产的主要影响因素[5-7]。目前,轮作倒茬、抗病品种选育以及化学防治等是防治棉花黄萎病的主要措施。但由于黄萎病微菌核在土壤中存活时间久,寄主范围广,黄萎病致病力变异快,抗病品种不易获得[8-12];化学防治虽然对棉花黄萎病的防治效果强、稳定性高,但对人畜的安全造成了很大的隐患,对环境的可持续发展造成了很大的影响[13]。近年来,生物防治以绿色环保,不易产生抗性等优势被人们关注并且应用于实践中[14]。防治棉花黄萎病的生防微生物有很多种,主要包括拮抗细菌、真菌、放线菌等[13]。
目前,植物病害有效的生物防治措施是将生防菌制成生防菌剂,施入土壤中进行植物病害的防治[15]。通常,生防菌剂的制备主要有液体发酵和固体发酵两种方法,但液体发酵生产成本高、产品分生孢子的产量低、产品保质时间短、不方便运输[16]。与液体发酵相比,固体发酵具有设备简单、物料成本低、产物加工简单且环保、易储存、方便运输、分生孢子量高等优点。近年来,有关生防菌的固体发酵优化报道较多,汪军等[17]利用玉米粉、甘蔗渣、麸皮和壳聚糖为主要成分进行固体发酵淡紫拟青霉Paecilomyces lilacinus,产孢量最大可达8.22×1010CFU/g。Brand等[18]利用甘蔗渣分别与脱脂大豆饼和咖啡壳组合培养淡紫拟青霉产孢量最大达1.53×1010CFU/g。谷军等[19]通过研究固体发酵过程,得出玉米粉作用显著,能显著提高淡紫拟青霉的分生孢子数,可达到1.31×1010CFU/g。卢智琴等[15]通过对发酵底物、发酵条件进行优化,得到AT9最佳发酵基质为麦麸、玉米粉、玉米秸秆粉按2:1:3质量比;最佳碳源、氮源与无机盐比例为4%葡萄糖、6%硝酸钾、2%碳酸钙;固料:水为1:1.2;20%的接种量,32 ℃黑暗条件培养8 d为最佳发酵条件。
简青霉PenicilliumsimplicissimumCEF-818是由中国农业科学院棉花研究所棉花病害防控团队从健康的棉花植株中分离获得,属于青霉属的叉状亚属,可在 PDA培养基上生长,其菌落表面呈淡灰绿色,分生孢子呈圆形或椭圆形。该菌株可置于30%的甘油中,-80 ℃温度下长期保存。简青霉CEF-818非挥发性代谢产物对大丽轮枝菌的抑制率为100%[20];王玲飞[21]通过温室和病圃试验发现,CEF-818对棉花黄萎病的有显著的防治效果。Yuan等[22]发现CEF-818可诱导棉花中防御相关基因PAL、PPO和POD的上调表达。和生产上应用较多的枯草芽孢杆菌相比,防治效果提高25.1%左右[20]。因此,简青霉CEF-818在棉花黄萎病的生物防治上具有巨大的潜力。
目前,对简青霉 CEF-818固体发酵优化的研究还未见有报道。因此,本研究旨在对简青霉 CEF-818固体发酵培养基以及发酵条件进行筛选,以期得到该生防菌最佳的固体发酵工艺,为简青霉CEF-818生防菌剂的规模化生产奠定基础。
1 材料与方法
1.1 供试材料
供试菌株:内生真菌简青霉Penicilliumsimplicissimum(CGMCC No.8320)CEF-818,由本实验室保藏(分离自健康的棉花植株)。
试剂:葡萄糖、蔗糖、氯化铵、氯化钠等试剂均为国产分析纯(AR),淀粉、麦芽糖、乳糖、牛肉膏等均为生化试剂(BR)。
培养基:马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g/L、葡萄糖20 g/L、琼脂1.5 g/L,pH自然。
马铃薯葡萄糖培养基(potato dextrose,PDB):同PDA培养基,但不加琼脂,pH自然。
1.2 菌株的活化和固体发酵种子液的制备
利用PDA培养基对CEF-818进行活化,挑取活化好的CEF-818菌饼,置入PDB液体培养基中,在25 ℃、180 r/min摇床中培养7 d,得到种子液,备用。
1.3 发酵培养物筛选
分别选取玉米芯、玉米糁、米糠、小米糠、小麦粒、油菜茎秆、玉米茎秆、大豆粉、黄豆粉、麦麸10种物料,称取30 g,按料水比1:1加入无菌水,混合均匀后装入200 mL培养瓶中,121 ℃下灭菌30 min,待冷却后,按照10%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于25 ℃恒温培养箱中,暗培养7 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.4 不同液体接种量对产孢量的影响
选择麦麸作为基础培养物,将无菌水按料水比1:1添加至培养物中并混合均匀,按照1.3中的方法,进行润料、灭菌,然后按3%、5%、10%、15%、20%、25%和30%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于25 ℃恒温培养箱中,暗培养7 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.5 不同物料厚度对产孢量的影响
选择麦麸作为基础培养物,将无菌水按料水比1:1添加至培养物中并混合均匀,将物料设置1、2、3、4和5 cm不同的厚度,装入200 mL的培养瓶中,然后参照1.3中的方法进行灭菌后,按5%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于25 ℃恒温培养箱中,暗培养7 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.6 不同发酵时间对产孢量的影响
选择麦麸作为基础培养物,将无菌水按料水比1:1添加至培养物中并混合均匀,按照1.3中的方法,进行润料、灭菌,按5%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于25 ℃恒温培养箱中分别培养3、4、5、6、7、8和9 d天后采用血球计数板计数分生孢子数,每组试验3次重复。
1.7 不同培养温度对产孢量的影响
选择麦麸作为基础培养物,将无菌水按料水比1:1添加至培养物中并混合均匀,按照1.3中的方法,进行润料、灭菌,按5%(V/M)的接种量接入种子液,并搅拌至与物料混匀后分别放置在25 ℃、28 ℃、32 ℃、36 ℃恒温培养箱中培养暗培养7 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.8 培养基起始pH对产孢量的影响
选择麦麸作为基础培养物,将无菌水的pH依次调至为3、5、7、9和11,将无菌水按料水比1:1添加至培养物中并混合均匀,按1.3中的方法,进行润料、灭菌后,按5%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于28 ℃恒温培养箱中,暗培养7 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.9 固体发酵培养基组成单因素试验
1.9.1 料水比对产孢量的影响 选择麦麸为基础培养物,设置料水比为1:0.4、1:0.6、1:0.8、1:1、1:1.2和1:1.4,将物料装入200 mL的培养瓶中,使物料厚度为2 cm,121 ℃下灭菌30 min,待冷却后,按照5%(V/M)的接种量接入种子液,并搅拌至与物料混匀后置于28 ℃恒温培养箱中暗培养5 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.9.2 不同种类速效碳源及添加量对产孢量的影响 选择麦麸作为基础培养物,按料水比 1:0.6加入无菌水,分别以蔗糖、葡萄糖、乳糖、可溶性淀粉、麦芽糖和D-甘露醇为碳源,按占培养物湿料重4%(M/M)的添加量分别添加至基础培养物中并混合均匀,设无添加碳源的培养基为对照,按照 1.9.1中的方法,进行润料、灭菌、接种,培养5 d后采用血球计数板计数分生孢子数,每组试验3次重复。
速效碳源添加量对产孢量的影响:选择麦麸为基础培养物,按料水比 1:0.6加入无菌水,分别添加浓度为0、1%、2%、3%、4%、5%和6%(M/M)的葡萄糖至基础培养物中并混合均匀,按照1.9.1中的方法,进行润料、灭菌、接种,培养5 d天后采用血球计数板计数分生孢子数,每组试验3次重复。
1.9.3 不同种类氮源及添加量对产孢量的影响 选择麦麸为基础培养物,按料水比 1:0.6加入无菌水,分别以尿素、硝酸钾、氯化铵、蛋白胨、牛肉膏和硝酸铵为氮源,按占培养基湿重0.5%(M/M)的添加量分别添加至基础培养物中并混合均匀,设无添加氮源的培养基为对照,按照 1.9.1中的方法,进行润料、灭菌、接种,培养5 d后采用血球计数板计数分生孢子数,每组试验3个重复。
氮源添加量对产孢量的影响:选择麦麸为基础培养物,按照料水比1:0.6加入无菌水,分别添加浓度为0、0.2%、0.4%、0.6%、0.8%、1%、1.2%和1.4%(M/M)的尿素至基础培养物中并混合均匀后,按照1.9.1中的方法,进行润料、灭菌、接种,培养5 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.9.4 不同种类无机盐及添加量对产孢量的影响 选择麦麸作为基础培养物,按料水比1:0.6加入无菌水,分别以MnSO4、NaCl、ZnSO4、KCl、CuSO4、Ca(H2PO4)2和KH2PO4为无机盐,按占培养物湿重1%(M/M)的添加量分别添加至基础培养物中并混合均匀,设无添加无机盐的培养基为对照,按照 1.9.1中的方法,进行润料、灭菌、接种,培养5 d后采用血球计数板计数分生孢子数,每组试验3次重复。
无机盐添加量对产孢量的影响:选择麦麸为基础培养物,按 1:0.6料水比加入无菌水,分别添加浓度为0、0.05%、0.35%、0.65%、0.95%、1.25%和1.55%(M/M)的KCl至基础培养物中并混合均匀后,按照1.9.1中的方法,进行润料、灭菌、接种,培养5 d后采用血球计数板计数分生孢子数,每组试验3次重复。
1.10 固体发酵培养基正交试验优化
根据对碳源添加量、氮源添加量、无机盐添加量、料水比单因素优化试验结果,设计4因素3水平的正交试验,7 d后采用血球计数板计数分生孢子数,以产孢量为指标,共有9组试验,每组试验3个重复。正交表见表1。
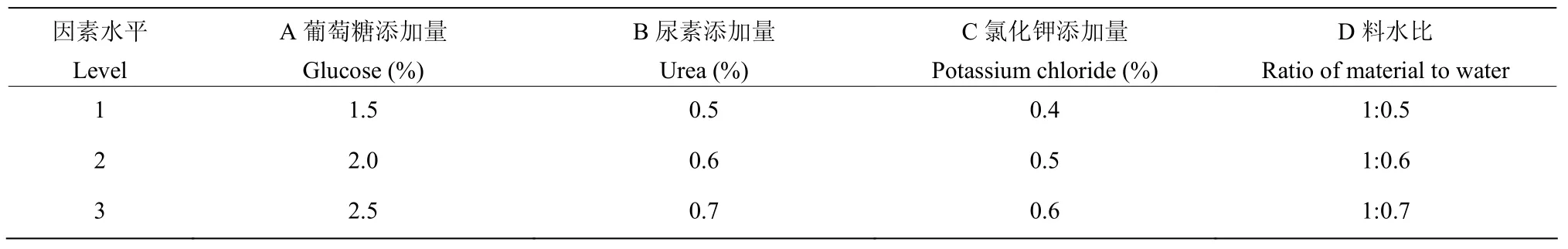
表1 培养基组成正交因子水平表Table 1 Levels orthogonal experiment factors table
1.11 数据统计与分析
采用Excel、SPSS 26软件对数据进行统计分析,采用Origin进行绘图。
2 结果与分析
2.1 固体发酵培养物筛选
固体发酵培养物初筛结果表明,培养物为麦麸时,分生孢子产量为17.8×108CFU/g,显著高于其他原料;其次为小米糠和黄豆粉,分生孢子产量分别为10.6×108和6.83×108CFU/g。因此,选择麦麸为简青霉CEF-818为固体发酵培养物(图1)。
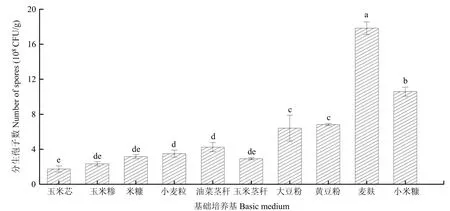
图1 不同发酵培养物基对简青霉CEF-818产孢量的影响Fig.1 The effects of different basic medium on spores production of P.simplicissimum CEF-818
2.2 不同液体接种量对产孢量的影响
在一定范围内,简青霉CEF-818的分生孢子量随着种子液接种量的增加而增加,当接种量达到5%(V/M)时,其分生孢子产量显著高于其他接种量,为1.87×109CFU/g。然而,随着接种量的继续增加,其分生孢子产量逐渐减少。因此,简青霉CEF-818发酵最适液体接种量为5%(V/M)(图2)。
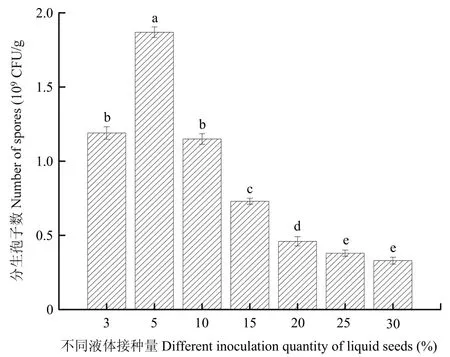
图2 不同液体接种量对简青霉CEF-818产孢量的影响Fig.2 The effects of different liquid inoculation quantity on spores production of P.simplicissimum CEF-818
2.3 不同物料厚度对产孢量的影响
物料厚度对简青霉CEF-818分生孢子产量有很大的影响,在试验过程中发现,当物料厚度为2 cm时,简青霉CEF-818的分生孢子产量达到最高值,为2.68×109CFU/g,且与其他处理组差异显著(P<0.05)。但随着物料厚度的继续增加,其分生孢子产量逐渐减少。因此,简青霉CEF-818发酵最适宜的物料厚度为2 cm(图3)。
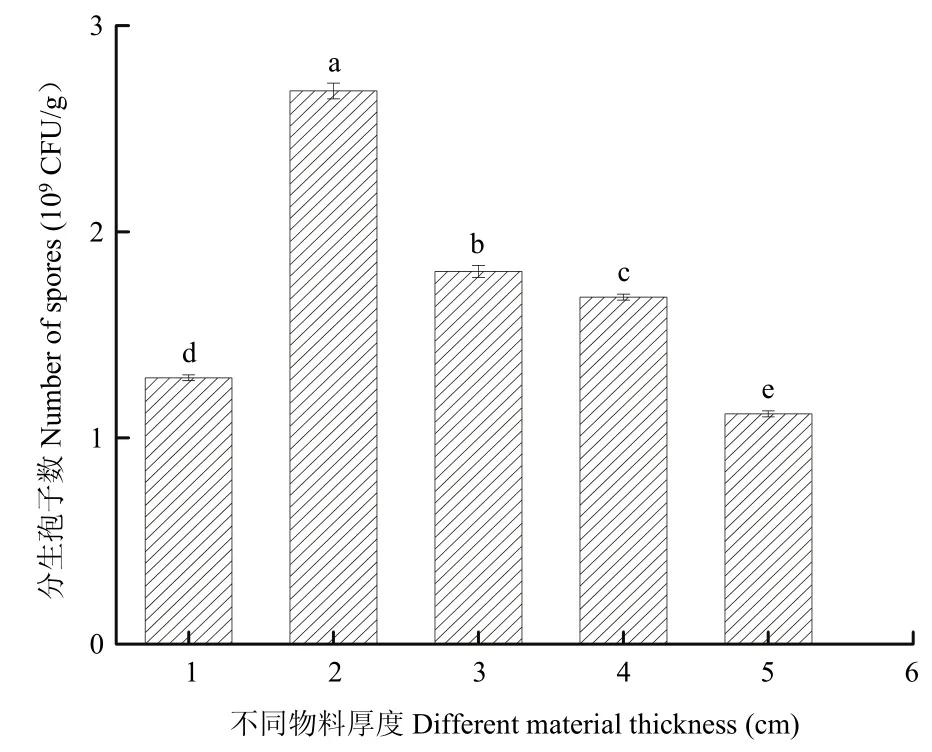
图3 不同物料厚度对简青霉CEF-818产孢量的影响Fig.3 The effects of different materal thickness on spores production of P.simplicissimum CEF-818
2.4 不同发酵时间对产孢量的影响
在简青霉CEF-818发酵前期,主要以生长白色菌丝为主,从第4 d开始,分生孢子数显著增加;发酵培养7 d,分生孢子数达到最大值,7~9 d分生孢子数无显著差异(P>0.05)。因此,选择7 d为简青霉CEF-818的发酵周期(图4)。
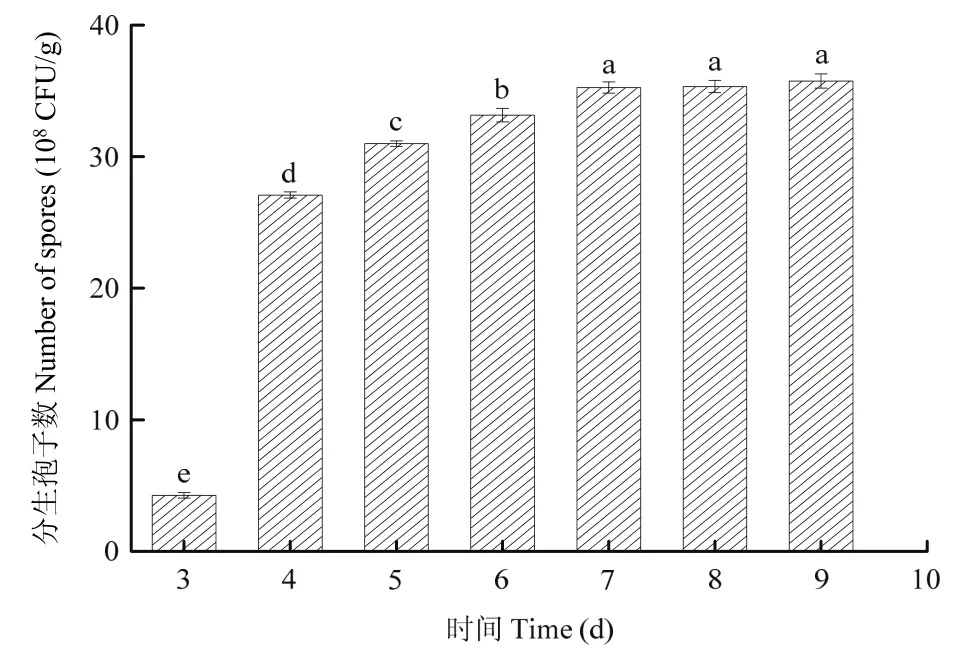
图4 不同发酵时间对简青霉CEF-818产孢量的影响Fig.4 The effects of different culture time on spores production of P.simplicissimum CEF-818
2.5 不同培养温度对产孢量的影响
温度对简青霉CEF-818产孢量的影响较大,在一定温度范围内,分生孢子的量随着温度的升高而增加,当温度达到28 ℃时,简青霉CEF-818分生孢子产量最高,为35.41×108CFU/g,与其他温度差异显著(P<0.05)。但随着温度的继续升高,其分生孢子产量逐渐减少(图5)。因此,28 ℃为简青霉CEF-818的最适发酵温度。
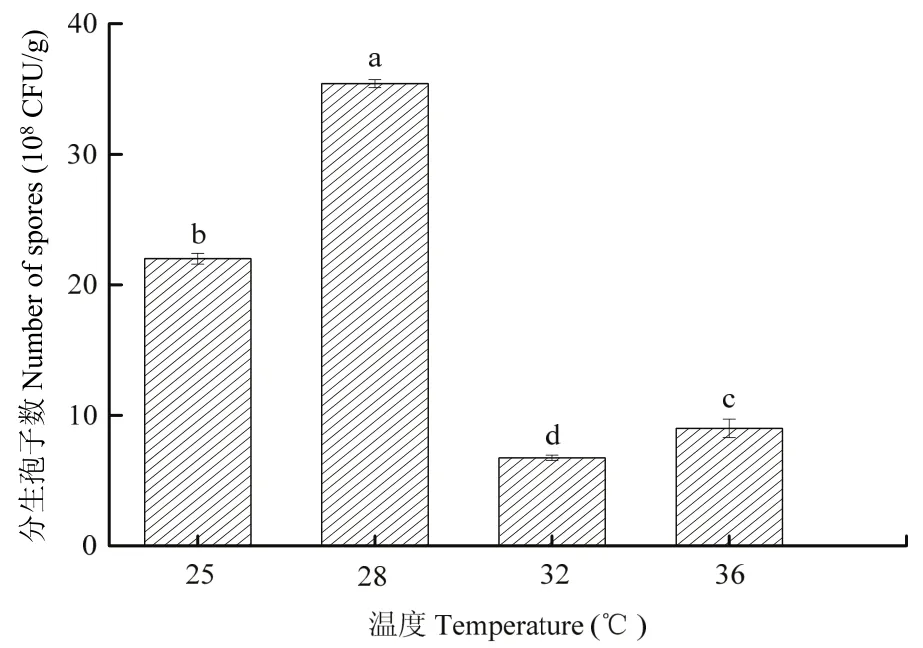
图5 不同培养温度对简青霉CEF-818产孢量的影响Fig.5 The effects of different culture temperature on spores production of P.simplicissimum CEF-818
2.6 不同起始pH水平对产孢量的影响
pH是影响菌体正常生长、繁殖和代谢的重要因子之一。在试验过程中发现,在初始pH为3和13时,简青霉CEF-818的产孢量最低,当初始pH为7时,其产孢量为6.25×109CFU/g,显著高于其他处理(P<0.05)(图6)。
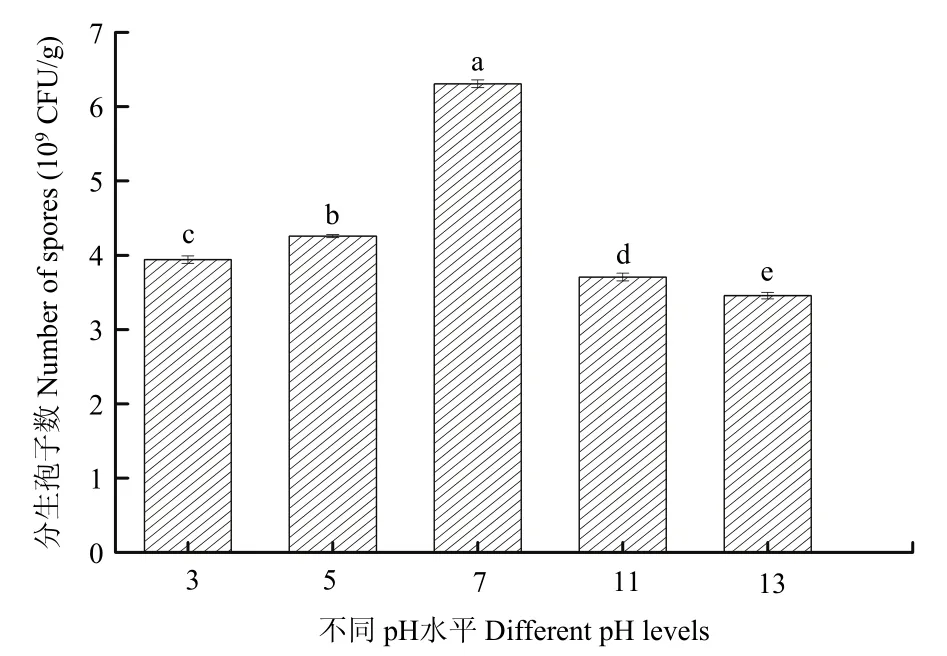
图6 不同pH水平对简青霉CEF-818产孢量的影响Fig.6 The effects of different pH levels on spores production of P.simplicissimum CEF-818
2.7 固体发酵培养基组成的优化
2.7.1 料水比对产孢量的影响 培养基中水分的含量对简青霉CEF-818的产孢量有很大的影响。在试验过程中发现,当料水比为1:0.6时,产孢量达到最高,为28.67×108CFU/g,与其他处理组差异显著(P<0.05)。然后,CEF-818的产孢量随着料水比比值降低而减少。因此,料水比为 1:0.6时物料的通气性达到最佳,最有利于分生孢子的产生(图7)。
2.7.2 不同种类的速效碳源及添加量对产孢量的影响 在基础培养物麦麸中添加不同种类的碳源能够提高简青霉CEF-818的产孢量。当添加速效碳源为葡萄糖糖时,分生孢子数为2.17×109CFU/g,显著高于其他碳源和对照组(P<0.05)。试验结果表明,适宜的葡萄糖添加量能够有效的促进简青霉CEF-818的产孢,当葡萄糖的添加量为2%(M/M)时,分生孢子数为1.66×109CFU/g,显著高于其他添加量(P<0.05)。因此最适宜简青霉CEF-818产孢的碳源为葡萄糖,其添加量为2%(表2)。
2.7.3 不同种类的氮源及添加量对产孢量的影响 在基础培养物麦麸中添加不同种类的氮源能够提高简青霉CEF-818的产孢量。当添加氮源为尿素时,分生孢子产量为9.0×108CFU/g,显著高于其他氮源和对照组(P<0.05)。在试验过程中发现,适量的添加尿素,能够有效的提高简青霉CEF-818菌丝的生长和产孢量,当尿素的添加量为0.6%(M/M)时,分生孢子数为3.02×109CFU/g,显著高于其他添加量(P<0.05)。因此最适宜简青霉CEF-818产孢的氮源为尿素,其添加量为0.6%(M/M)(表3)。
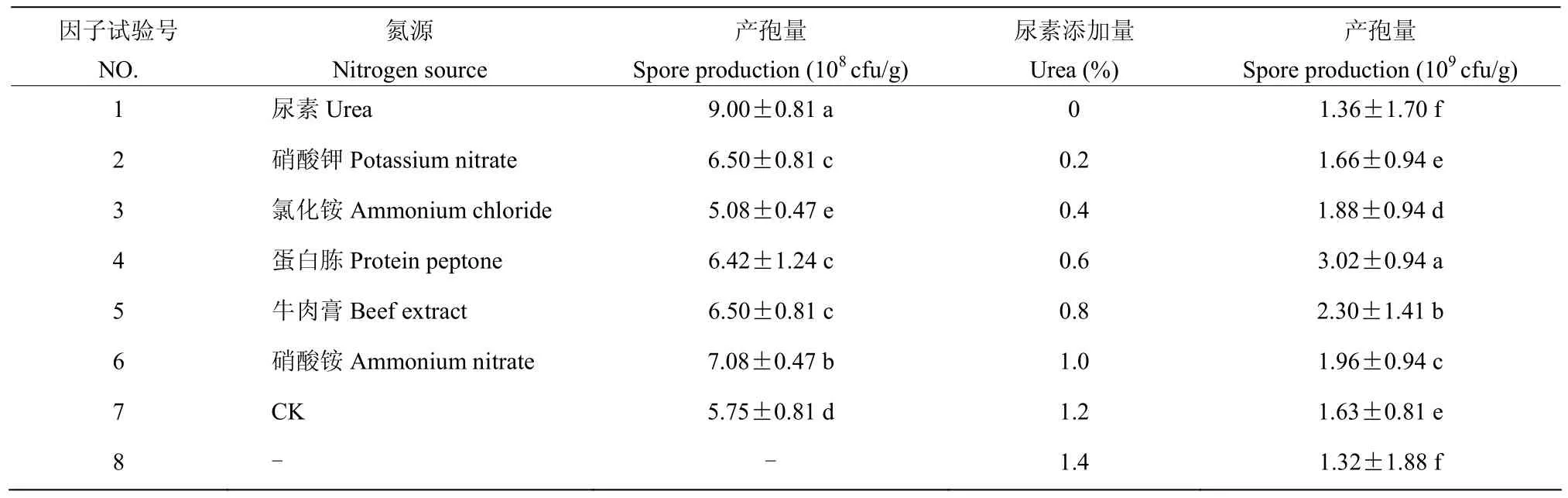
表3 不同速效氮源及添加量对简青霉CEF-818产孢量的影响Table 3 Effect of different quick-acting nitrogen sources and additions on the production of spores in P.simplicissimum CEF-818
2.7.4 不同种类的无机盐及添加量对产孢量的影响 在基础培养物麦麸中添加不同种类的无机盐对简青霉 CEF-818菌丝的生长和分生孢子的产生有不同的影响。当添加无机盐为氯化钾时,分生孢子数为 28.1×108CFU/g,显著高于其他无机盐和对照组(P<0.05)。当KCI的添加量为0.65%(M/M)时,分生孢子数为2.66×109CFU/g,显著高于其他添加量(P<0.05)。因此最适宜简青霉CEF-818产孢的无机盐为KCl,其添加量为0.65%(M/M)(表4)。
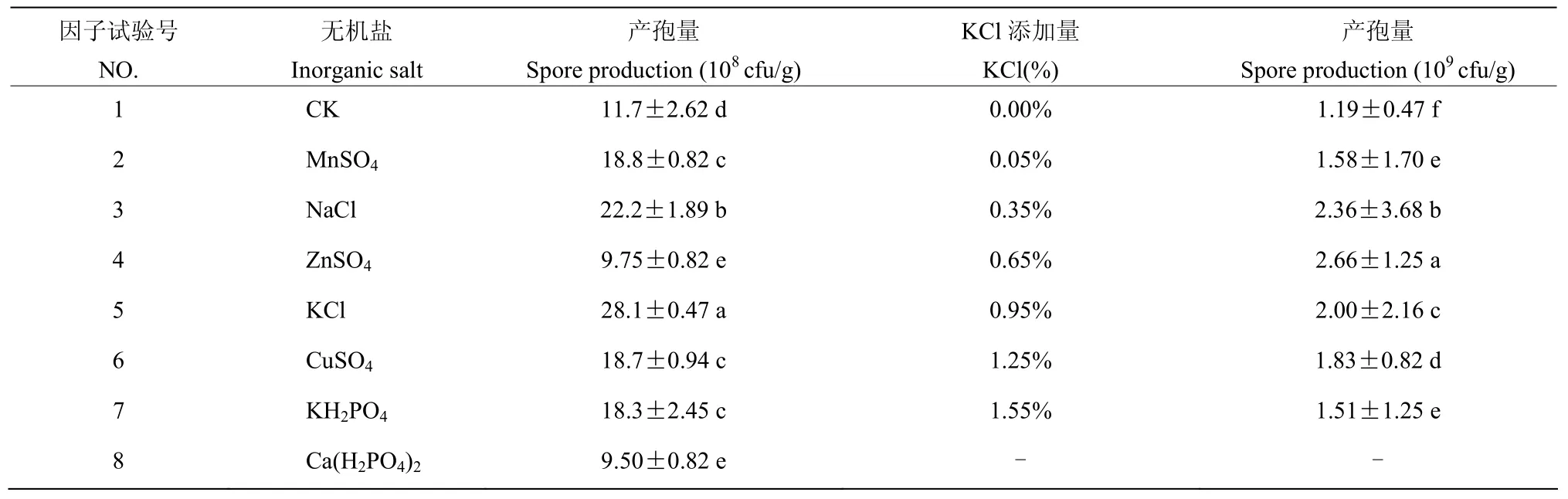
表4 不同速效无机盐及添加量对简青霉CEF-818产孢量的影响Table 4 Effect of different quick-acting inorganic salts and additions on the production of spores of simple P.simplicissimum CEF-818
2.7.5 发酵培养基组成正交试验 由正交试验可得,CEF-818固体发酵培养基的最佳组合为处理 1(A3B2C3D1),即葡萄糖添加量为2.5%(M/M),尿素的添加量为0.6%(M/M),氯化钾的添加量为0.6%(M/M),料水比为1:0.5,所产分生孢子数最高,为8.28×109CFU/g。根据极差分析得到影响CEF-818产孢量的主次因子为:KCl添加量>料水比>尿素添加量>葡萄糖添加量,其中KCl添加量、料水比、尿素添加量对产孢量的影响较大(表5)。因此,在生产过程中,要严格把控这三者的量。

表5 发酵培养基正交试验结果Table 5 Orthogonal experimental results of fermentation medium
3 讨论
固体发酵培养条件的优化是微生物发酵成产品实现工业化的重要影响因素之一,微生物的生长和代谢产物的积累受多种因素的影响,如培养基组成、生长因子等[23]。目前,微生物发酵培养物的选择大多为农副产品,在这些原材料供应稳定且价格低廉,同时能为微生物的发酵提供营养物质。本研究在筛选发酵培养物时发现,麦麸较适宜简青霉 CEF-818的生长及产孢。易征璇等[24]在对康氏木霉Koningiitrichoderma进行固体发酵工艺优化中,也发现其最佳的培养物为麦麸;刘世祥等[25]对生防菌深色木霉Trichoderma atrovirideAT-9的固体发酵工艺进行优化,优化后该生防菌株发酵培养物组成为麦麸30%、谷壳20%;由此可见,麦麸可为部分微生物的生长提供营养。目前,在实验室和生产中葡萄糖、蔗糖、果糖、淀粉、麦麸、米糠等是常用的碳源,添加速效碳源葡萄糖有利于简青霉CEF-818菌丝的生长,提高产孢量。杨英歌等[26]在进行豆粕固体发酵生产纳豆激酶条件的优化中,发现添加 1.5%的葡萄糖有利于菌体生长。本研究还发现,适量的尿素显著促进了CEF-818菌丝的生长和产孢量提高,而过多的尿素添加量对产孢量起到抑制作用。周莲等[16]也发现添加适量的尿素能够显著促进淡紫拟青霉M-1菌丝的生长和产孢。速效无机盐也是菌丝的生长和产孢量的影响因素之一,本研究发现,0.6%(M/M)的KCl,能够显著促进CEF-818菌丝的生长和产孢量。陈鑫[27]在发酵优化枯草芽胞杆菌BacillussubtilisHAINUP4,筛选到最佳无机盐为KCl,添加量为0.1%。物料中的含水量对菌丝的生长和产孢量有很大的影响,料水比过低,物料中含水量过大,容易造成在发酵过程中物料结块,通气性不足,从而影响简青霉CEF-818的生长和产孢量。而料水比过高,物料中含水量小,则抑制了简青霉CEF-818的生长和产孢量。
菌株发酵不仅受培养基质的影响,发酵条件也是影响发酵很重要的因素[28],温度是影响微生物生长繁殖最重要的因素之一。因为温度过高,会破坏微生物细胞内酶的活性,严重抑制微生物的正常的生长,且微生物细胞内的蛋白质在过高的温度下容易发生凝固或者变性,最终,会造成微生物细胞的死亡;而过低的温度,会严重抑制微生物的生长[29]。因此,在微生物的发酵生产中,需要保证适宜的发酵温度,本研究结果表明,简青霉CEF-818的最佳发酵温度为28 ℃;发酵时间对微生物的生长也有很大的影响,固体发酵周期普遍为3~10 d,周莲等[19]的研究结果表明,淡紫拟青霉最佳发酵温度为28 ℃、发酵周期为7 d;易征璇等[24]的研究结果表明,康氏木霉的最佳酵温度为28 ℃、发酵周期为7 d,与本研究结果一致。在本研究中发现,当液体接种量达到最适接种量后,继续增大接种量后简青霉CEF-818的产孢量显著减少,原因可能为当液体菌种量接种过多时,液体菌种积累了次代谢产物,过多的代谢产物可能会影响产孢,这与王亚娇等的研究结果一致[28]。
本研究对该生防菌的工业化实际生产具有一定的参考意义,但在进行发酵优化过程中,并未对不同因子间相互作用对简青霉CEF-818产孢量的影响作进一步的深入研究,且研究还处于实验室阶段,未作进一步大规模生产分析,这些问题还有待进一步研究探讨。
