大叶山蚂蝗叶片响应缺磷胁迫的脂质代谢组分析
2022-07-08郑韶爵朱厚荣罗佳佳刘攀道罗丽娟刘国道董荣书
郑韶爵, 朱厚荣, 罗佳佳, 刘攀道, 罗丽娟, 刘国道*, 董荣书*
(1. 海南大学热带作物学院, 海南 海口 570228; 2. 中国热带农业科学院热带作物品种资源研究所, 海南 海口 571101)
磷(Phosphorus,P)是植物生长发育所必需的大量营养元素之一,参与了生物膜和核酸的合成、新陈代谢、酶的活性调节等重要生物过程[1]。我国南方土壤呈酸性,在酸性土壤中可被植物根系直接吸收的无机可溶磷(Inorganic phosphate,Pi)容易被金属离子及有机物所固定,形成难溶性无机磷和有机磷,导致磷有效性较低,严重限制植物的生长[2]。在农业上,主要通过施用磷肥来缓解土壤缺磷问题,但过量的施用磷肥不仅造成资源浪费,且会导致水体富营养化等环境污染问题[3]。因此,提高作物对土壤磷匮乏的适应能力及磷效率,对发展绿色生态农业具有重要作用。
提高磷效率是植物适应低磷胁迫的重要机制,磷效率主要包括磷吸收效率(P acquisition efficiency,PAE)和磷利用效率(P utilization efficiency,PUE)。在低磷环境下,植物主要通过调整根系形态和构型、分泌磷酸酶和有机酸、增强磷转运子活性、加强土壤有益微生物互作等,提高根系从土壤中获取磷素的能力,以提高磷吸收效率[4]。近十年来,大量科研工作者在植物磷吸收效率机理方面取得了诸多成果,其中部分成果已用于育种实践,指导培育出一批高磷吸收效率作物新品种,包括水稻(Oryzasativa)、大豆(Glycinemax)、玉米(Zeamays)等[5-6]。植物提高磷利用效率的机制之一是增加对体内含磷代谢物(磷脂、核酸、磷酸化蛋白等有机磷组分)的磷素循环再利用[7]。植物叶片贮存有大量有机磷,其中磷脂占叶片细胞全磷的15%~20%,是潜在的巨大磷源,故加强磷脂中磷素的循环再利用,能有效缓解低磷胁迫[8]。在缺磷环境中,含磷脂质(磷脂)可被磷脂酶和酸性磷酸酶等水解,产生无机磷酸根(Pi)和二酰甘油(Diacylglycerol,DAG),其中Pi被分配到生长活跃器官得到再利用,DAG被用于合成半乳糖脂和硫脂等不含磷脂质替代磷脂进行膜脂重塑,维持细胞膜[1]。研究发现,澳大利亚磷贫瘠土壤上的山龙眼科植物新叶磷脂含量较高,而老叶磷脂含量显著降低,老叶中磷脂被半乳糖脂和硫脂取代,增加了磷利用率,以适应低磷环境[9]。脂质组学作为代谢组学的分支,是研究植物磷脂代谢的有效技术手段[10]。
大叶山蚂蝗(Desmodiumgangeticum)是豆科蝶形花亚科山蚂蝗属多年生亚灌木植物,具有根系发达、抗逆性强、生物量大、蛋白质含量高等优点,属于南方热带地区优良牧草和饲料作物之一[11-12]。我国南方土壤普遍面临低磷胁迫的问题,大叶山蚂蝗却生长良好,而其对低磷胁迫的适应机制仍不清楚。因此,本研究将通过脂质组学,初步分析大叶山蚂蝗叶片对缺磷胁迫的响应。
1 材料与方法
1.1 植物材料和培养条件
本研究所用的大叶山蚂蝗种子材料是由中国热带农业科学院热带作物品种资源研究提供。试验在海南大学热带作物学院科研基地大棚中开展,大叶山蚂蝗采用Magnavaca营养液(表1)进行水培。试验流程如下:筛选大小一致、饱满均一的种子,在80℃水浴锅中热激3 min,放于垫有润湿滤纸的培养皿避光萌发2~3 d,待幼根伸长1~1.5 cm,再转移至含300 μmol·L-1KH2PO4营养液中预培养10 d。挑选长势良好、均一的幼苗,分别进行正常供磷(+P,300 μmol·L-1KH2PO4)和缺磷胁迫处理(-P,0 μmol·L-1KH2PO4)。营养液pH为5.8~6.0,每隔3 d换一次每个处理设置3个生物学重复。分别在处理0 d,5 d,10 d,15 d收取地上部和根系样品,用于生物量和全磷含量的测定。处理15 d时收取所有叶片,用液氮速冻后,于-80℃保存用于脂质代谢组学分析。

表1 改良的Magnavaca营养液配方Table 1 Modified Magnavaca nutrient solution formulation
1.2 试验方法
1.2.1生物量与全磷含量测定 生物量测定:样品收获后放入烘箱中105℃杀青20 min,70℃恒温烘干至恒重后称量。
全磷含量测定:将收取的大叶山蚂蝗地上部和根系烘干样品用液氮研磨成粉末,放回烘箱烘至恒重后称取0.05 g于50 mL消煮管中,加入5 mL浓硫酸,摇匀后放置4 h,使用消煮炉消煮。当溶液冒白烟时逐渐升高温度,始终保持微沸状态30 min。当溶液呈棕黑色时加入5~8滴30%过氧化氢,边滴边摇晃消煮管至溶液无色,再消煮20 min后冷却,双蒸水定容至50 mL,溶液澄清后待测。参照Murphy和Riley[13]钼锑抗比色法测定OD700吸光度值,计算全磷含量。
1.2.2脂质分子提取 大叶山蚂蝗叶片的脂质代谢组学分析在深圳华大基因BGI生物科技有限公司进行。脂质代谢物的提取参考Chauhan等[14]方法进行,略作修改:称取25 mg样品放入1.5 mL Eppendorf管中,加入800 μL -20℃预冷的提取液(二氯甲烷∶甲醇=3∶1,V∶V)和10 μL SPLASH内标储液,管内加入两颗钢珠,将混合物放入研磨仪中进行研磨(50 Hz,5 min),随后进行水浴超声(4℃,10 min),放入-20℃冰箱静置1 h。样品离心(4℃,25000 rpm,15 min)。离心后取600 μL上清液进行冻干,加入200 μL重组溶剂(异丙醇∶乙腈∶H2O=2∶1∶1,V∶V∶V)进行复溶,涡旋震荡1 min,4℃条件下水浴超声10 min后离心(25 000 rpm,15 min),取出钢球,将上清液转移至1.5 mL上样瓶中。每个样本的上清液各取20 μL混合成QC质控样本,用于评估LC-MS分析过程的重复性和稳定性。
本试验采用Waters 2D UPLC(Waters,USA)串联Q Exactive高分辨质谱仪(Thermo Fisher Scientifific,USA)来进行代谢物的分离和检测。
1.2.3基于高效液相色谱-质谱的代谢组分析 参考McLoughlin等[15]方法进行脂质代谢物的分离、鉴定和定量分析,略作修改。色谱条件:采用CSHC18柱(1.7 μm,2.1×100 mm,Waters,USA)进行UPLC分析。正离子模式的流动相由溶剂A(0.1%甲酸、60%乙腈水溶液、10 mM甲酸铵)和溶剂B(0.1%甲酸、10%乙腈水溶液、90%异丙醇和10 mM甲酸铵)组成。为了进行比较,溶剂A和溶剂B分别为在负离子模式下,不含甲酸(0.1%)。设置梯度洗脱方法如下:40%~43% B(0~2 min);43%~50% B(2~2.1 min);50%~54% B(2.1~7 min);54%~70% B(7~7.1 min);70%~99% B(7.1~13 min);99%~40% B(13~13.1 min);40% B(13.1~15 min)。流量设置为0.35 mL·min-1,柱温度保持在保持在55℃。注射量设置为5 μL。
质谱条件:利用Q Exactive质谱仪(Thermo Fisher Scientifific,USA)进行一级、二级质谱数据采集。质谱扫描的电荷质量比(m/z)在200~2 000m/z以内。MS1分辨率、自动增益控制(AGC)和最大注入时间(MIT)分别为70 000 ms、3 e6和100 ms。根据前驱体离子强度,选择前3个离子进行MS2分析,并将MS2分辨率、AGC和MIT的参数分别调整到17,500,1 e5和50 ms。阶梯式归一化碰撞能量(NCE)值分别设置为15,30和45 eV。电喷雾电离(ESI)参数设置为:鞘气流速40 L·min-1,辅助气体流速10 L·min-1,正离子模式下3.80(|KV|)喷雾电压,负离子模式下3.20(|KV|),离子传输管温度320℃,辅助气加热器温度350℃。为了保证检测过程中结果的可靠性,对样品进行了随机排序,以减少系统误差。在整个分析分析过程中,每10个样品注入一次QC样品。
差异脂质代谢物的鉴定:以Fold Change≥2或Fold Change≤0.5,且P<0.05条件下筛选出差异显著的脂质代谢物。
1.2.4数据统计分析 采用Microsoft Excel 2019软件(Microsoft,美国)进行数据统计和可视化作图,数据结果以平均值±标准误(Standard error,SE)表示。利用SPSS 18.0软件(IBM-SPSS,美国)对同一时期大叶山蚂蝗不同磷水平处理下的各指标进行独立样品T检验方差分析。脂质分析采用LipidSearch version 4.1(Thermo Fisher Scientific,USA)进行质谱数据分析筛选出潜在脂质分子,数据导入MetaX进行数据预处理和后续分析。采用SIMCA-P 14.0进行有监督的主成分分析(Principal component analysis,PCA)。
2 结果与分析
2.1 缺磷胁迫对大叶山蚂蝗生长的影响
如图1所示,缺磷胁迫会抑制大叶山蚂蝗生长。从-P处理的10 d开始,地上部的干重显著降低了29.9%~56.0%(P< 0.01,图1B)。但是,-P处理5 d和10 d对根系生长有促进作用,表现为根系干重显著增加33.9%~24.0%(P<0.05)(图1C)。+P处理相比,-P处理5~15 d,大叶山蚂蝗地上部和根系磷含量显著降低52.38%~87.95%和54.55%~77.78%(P<0.01,图1D,E)。以上结果表明,缺磷胁迫显著抑制了大叶山蚂蝗地上部的生长,降低了地上部和根系全磷含量,而短期缺磷处理(5 d和10 d)会促进了根系的生长。

图1 缺磷胁迫对大叶山蚂蝗的生长和生理指标的影响Fig.1 Effects of low phosphorus stress on the growth and physiological indictors of Desmodium gangeticum注:(A)缺磷胁迫下大叶山蚂蝗在不同时期的生长表型;(B)地上部干重;(C)根系干重;(D)地上部磷含量;(E)根系磷含量。*表示同一时期正常供磷(+P)和缺磷处理(-P)条件下差异显著,*:P < 0.05,**:P < 0.01;***:P < 0.001。下同Note:(A) Growth phenotypes of D. gangeticum at different periods under low phosphorus stress;(B) Shoot dry weight;(C) Root dry weight;(D) Shoot P content;(E) Root P content. *,** and *** indicate significant difference between +P and -P treatments under the same stages at 0.05,0.01 and 0.001 level,respectively. The same as below
2.2 大叶山蚂蝗叶片响应缺磷胁迫的脂质组分析
对-P处理与+P处理的大叶山蚂蝗叶片进行脂质组分析。PCA结果显示,-P处理的3个生物学重复(-P_1,-P_2,-P_3)与+P处理的3个生物学重复(+P_1,+P_2,+P_3)在第一主成分(PC1)明显分离,分别聚为一类,可以解释66.7%脂质代谢物的差异变化,表明处理间的差异明显,可用于后续分析(图2A)。大叶山蚂蝗叶片脂质代谢组共检测到240个脂质,其中无显著差异脂质158个,占所检测到脂质的65.83%;-P处理上调脂质43个,占所检测到脂质的17.92%;-P处理下调脂质39个,占所有代谢物的16.25%(图2B)。
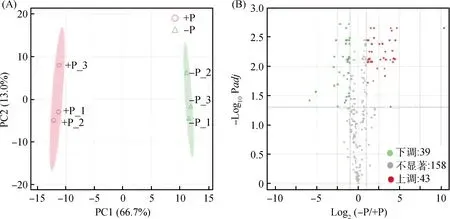
图2 脂质代谢物主成分分析(A)及火山图(B)Fig.2 Principal component analysis of lipid metabolites (A) and volcanic plot (B)注:(A)横轴为第一主成分(PC1),纵轴为第二主成分(PC2)。(B)绿色为下调的显著差异脂质代谢物,红色为上调的显著差异脂质代谢物,不显著的脂质代谢物为灰色Note:(A)The horizontal axis is the first principal component (PC1) and the vertical axis is the second principal component (PC2). (B) Significantly differentially down-regulated lipid molecules are in green,significantly up-regulated differential lipid molecules are in red,and insignificant lipid molecules are in gray
将82个差异脂质(上调脂质43个,下调脂质39个)进行分类,其可分为甘油磷脂类(GP)、糖脂类(SL)、甘油脂类(GL)、固醇脂类(ST)四大类(图3)。其中,39个下调的代谢物全为甘油磷脂类,包括磷脂酰乙醇胺(14个)、磷脂酰甘油(8个)和磷脂酰肌醇(6个)等八个亚类;43个上调的代谢物均为不含磷的脂质,包括糖脂类(38个),甘油脂类(3个)和固醇脂类(2个)。以上结果表明,缺磷胁迫导致大叶山蚂蝗叶片中含有磷酸基团的甘油磷脂质的相对含量降低,而不含磷的脂质的相对含量显著增加。
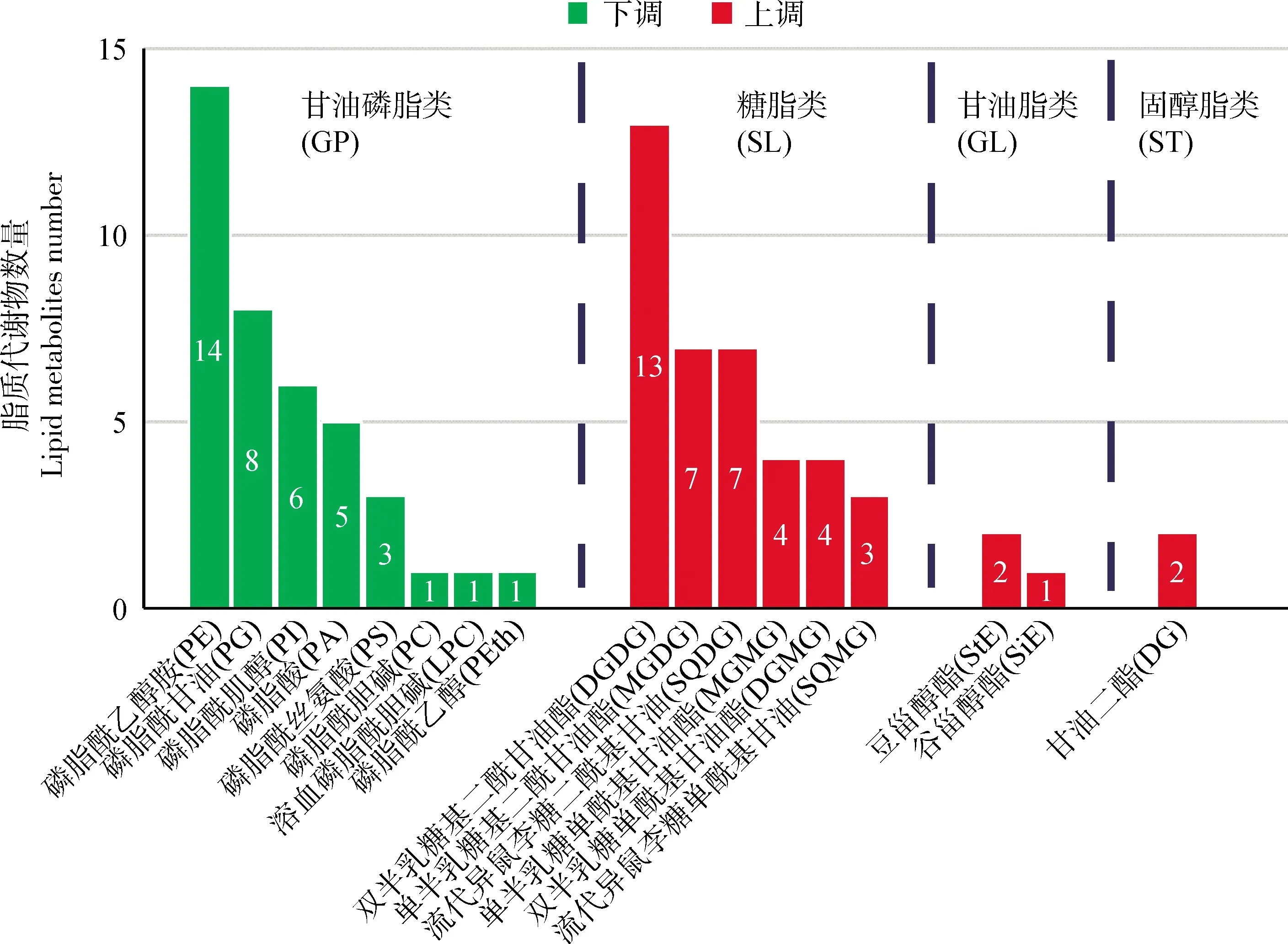
图3 差异脂质代谢物分类Fig.3 Classification of differential lipid metabolites注:绿色为下调的差异脂质代谢物,红色为上调的差异脂质代谢物。缩写分别表示GP,甘油磷脂类;SL,糖脂类;GL,甘油脂类;ST,固醇脂类;PE,磷脂酰乙醇胺;PG,磷脂酰甘油;PI,磷脂酰肌醇;PA,磷脂酸;PS,磷脂酰丝氨酸;PC,磷脂酰胆碱;LPC,溶血磷脂酰胆碱;PEth,磷脂酰乙醇;DGDG,双半乳糖基二酰甘油酯;MGDG,单半乳糖二酰基甘油酯;SQDG,硫代异鼠李糖二酰基甘油;MGMG,单半乳糖单酰基甘油酯;DGMG,双半乳糖基单酰甘油酯;SQMG,硫代异鼠李糖单酰基甘油;StE,豆甾醇酯;SiE,谷甾醇酯;DG,甘油二酯Note:Green represented down-regulated differential lipid metabolites,red indicated up-regulated differential lipid metabolites. Abbreviations represented that GP,glycerophospholipids;SL,saccharolipids;GL,glycerolipids;ST,lipids;PE,phosphatidylethanolamine;PG,phosphatidylglycerol;PI,phosphatidylinositol;PA,phosphatidic acid;PS,phosphatidylserine;PC,phosphatidylcholine;LPC,lyso-phosphatidylcholine;PEth,phosphatidylethanol;DGDG,digalactosyldiacylglycerol;MGDG,monogalactosyldiacylglycerol;SQDG,sulfoquinovosyldiacylglycerol;MGMG,monogalactosylmonoacylglycerol;DGMG,digalactosylmonoacylglycerol;SQMG,sulfoquinovosy-lmonoacylglycerol;StE,stigmasteryl ester;SiE,sitosteryl ester;DG,diglyceride
2.3 缺磷胁迫对大叶山蚂蝗叶片甘油磷脂积累的影响
脂质组分析发现,缺磷胁迫下大叶山蚂蝗叶片中鉴定到39个显著下调的脂质,均为甘油磷脂类(图4)。其中,与+P处理相比较,-P处理的大叶山蚂蝗叶片中,下调的磷脂酰乙醇胺(PE)有14个(相对含量降低了50.69%~98.31%),下调的磷脂酰甘油(PG)有8个(相对含量降低了50.25%~86.41%),下调的磷脂酸(PA)有5个(相对含量降低了53.27%~69.88%),下调的磷脂酰肌醇(PI)有6个(相对含量降低了50.98%~82.08%),下调的磷脂酰丝氨酸(PS)有3个(相对含量降低了55.95%~81.95%),及磷脂酰胆碱PC(32∶0) 相对水平降低了62.11%,溶血磷脂酰胆碱LPC(18∶2) 降低了64.99%,磷脂酰乙醇PEth(34∶1) 降低了79.12%。以上结果显示,下调数目和相对含量降低最多的是PE,其次是PG。
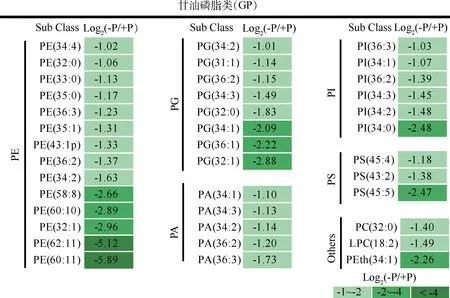
图4 显著下调差异脂质代谢物Fig.4 Significantly down-regulated differential lipid metabolites注:其他类包含了磷脂酰胆碱(PC)、溶血磷脂酰胆碱(LPC)、磷脂酰乙醇(PEth)Note:Others including phosphatidylcholine (PC),lyso-phosphatidylcholine (LPC),phosphatidylethanol (PEth)
2.4 缺磷胁迫对大叶山蚂蝗叶片糖脂、固醇脂和甘油脂积累的影响
脂质组分析发现,缺磷胁迫下大叶山蚂蝗叶片中鉴定到43个显著上调的脂质代谢物,其均为不含磷的脂质(图5)。其中,糖脂类(上调38个)尤为显著,13个双半乳糖基二酰甘油酯(DGDG)上调幅度最大的为DGDG(40∶1)(34.78倍);7个硫代异鼠李糖二酰基甘油(SQDG)上调幅度最大的为SQDG(35∶0)(9.38倍);7个单半乳糖二酰基甘油酯(MGDG)上调最高的为MGDG(42∶1)(17.51倍);双半乳糖基单酰甘油酯(DGMG)和单半乳糖单酰基甘油酯(MGMG)均包含4个上调的代谢物,上调最高的分别为DGMG(24∶0)(1332.57倍)和MGMG(23∶4)(18.25倍);3个硫代异鼠李糖单酰基甘油(SQMG)上调最高的为SQMG(18∶0)(8.40倍)。此外,3个固醇脂类最高上调的是豆甾醇酯StE(18∶3)(3.75倍),2个甘油脂类最高上调的是甘油二酯DG(35∶2)(2.57倍)。以上结果显示,在缺磷胁迫下,大叶山蚂蝗叶片中大量不含磷的脂质的积累增加。
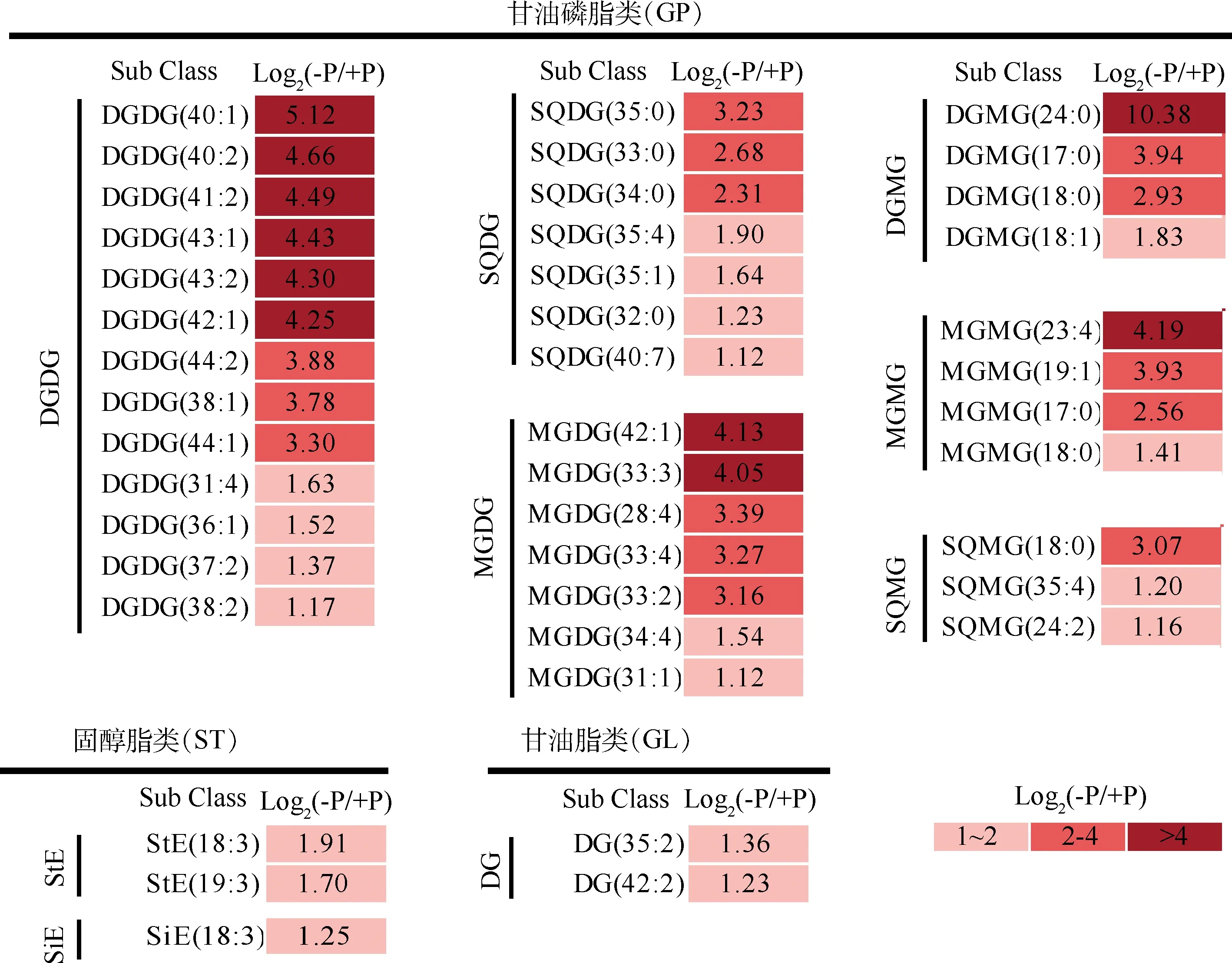
图5 显著上调的差异脂质代谢物Fig.5 Significantly up-regulated differential lipid metabolites
3 讨论
低磷胁迫会抑制植物的生长发育[16]。大量研究显示,缺磷会显著降低植物磷含量,进而抑制植物地上部的生长,降低其生物量。本研究也发现缺磷胁迫处理大叶山蚂蝗的10 d和15 d时,其地上部生长明显受抑制(图1A),地上部和根系磷含量也均显著降低(P<0.05,图1D,E)。该结果与其他植物中表现一致,比如柱花草(Stylosanthesguianensis)、水稻、大豆、白羽扇豆(Lupinusalbus)等[17-20]。
在低磷胁迫下,植物通过调整根系形态和构型,促进对外源磷的获取效率以提高磷吸收效率,包括增强侧根的生长、增加根毛密度、扩大根系分布范围等,这是植物适应低磷环境的有效策略之一[1,21]。本研究也发现,短期(5 d和10 d)的缺磷处理会促进大叶山蚂蝗根系生长,但随着缺磷处理时间延长(10 d),根系生长也会受到抑制(图1)。表明当遭受缺磷胁迫时,大叶山蚂蝗可能通过分配更多的碳水化合物至根系,促进其快速生长,以期获取更多的磷营养响应磷饥饿胁迫。
在缺磷环境中,植物加强对体内含磷代谢物的活化再利用以提高磷利用效率,包括核酸、磷脂、磷酸糖和磷酸化蛋白等[22]。磷脂是生物膜的主要组成成分,脂质磷占植物有机磷库的30%,在低磷环境中,磷元素供应不足,植物会通过降解膜磷脂释放Pi,再通过大量合成不含磷的脂质替代磷脂,维持生物膜完整性,帮助植物在缺磷环境下生存[1]。磷脂的循环再利用主要包括两个关键代谢过程,即磷脂降解和膜脂重塑。对于磷脂降解,含磷脂质(磷脂)通过磷脂酶水解,可释放Pi,供植物再利用[23]。前人研究显示,低磷胁迫下,多个作物根系中的多种磷脂水平显著降低,包括大豆、木豆(Cajanuscajan)、玉米[19,24-25]。本研究也发现,缺磷胁迫下大叶山蚂蝗叶片大量磷脂代谢物相对水平显著降低,主要包括PE、PG和PA等(图3,4)。结果暗示,大叶山蚂蝗叶片中大量含磷脂质被降解再利用,是其适应缺磷胁迫的重要策略之一。对于膜脂重塑,是植物通过磷脂降解产生的DAG为骨架,大量合成不含磷的脂质(如半乳糖脂质、硫脂、葡萄糖醛酸脂等)替代含磷膜脂,维持生物膜的结构和稳定性[1]。对拟南芥(Arabidopsisthaliana)、燕麦(Avenasativa)和山龙眼科(Proteaceae)等植物中已被证实,在缺磷环境中,磷脂可以被半乳糖脂、硫脂和葡萄糖醛酸脂等不含磷的脂质取代以释放出磷酸基团[9,26-28]。本研究中,缺磷胁迫下的大叶山蚂蝗叶片中大量不含磷的脂质(38个糖脂、3个类固醇脂和2个甘油脂)相对水平显著升高(图3,5)。结果暗示,缺磷环境下,大叶山蚂蝗叶片中磷脂被不含磷的脂质替换,在维持细胞膜完整性的同时促进了体内磷的循环再利用。
4 结论
综上所述,磷的缺乏显著抑制大叶山蚂蝗地上部的生长,降低其全磷含量。大叶山蚂蝗可能通过促进根系生长,加强叶片含磷脂质(主要是PE,PG和PA等)的降解和大量累积不含磷的脂质(主要是半乳糖脂和硫脂),提高体内的磷利用效率,以适应缺磷胁迫。
