复合无磷保水剂对反复冻融鲟鱼片理化特性及微观结构的影响
2022-07-07李桂敏赵春青窦容容颜子恒桑亚新亢春雨孙纪录
李桂敏,赵春青,窦容容,颜子恒,桑亚新,亢春雨,*,孙纪录,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.保定开放大学,河北 保定 071000)
冷冻处理是水产品加工、贮藏及市场流通过程中的主要形式,在此期间因温度波动不可避免发生多次冻结与解冻现象,即反复冻融的过程,此过程中肉制品会出现水分流失、色泽变差、微生物腐败、脂质和蛋白质氧化变性、质构特性改变等现象,这些劣变与肌肉的持水性有很大关系,因此专家学者希望通过提高肉制品的持水性改善反复冻融对肉制品造成的不良影响。传统的磷酸盐类保水剂通常会给产品增加金属涩味且不符合健康理念,因此,无磷保水剂成为研究热点之一。研究发现,碱性盐通过提高水产品pH值,稳定蛋白质空间结构提高保水性,使用含碳酸氢钠和柠檬酸钠的无磷保水剂能降低肉制品的解冻损失率和蒸煮损失率,对保持产品的色泽和质构特性有显著作用。山梨糖醇能够增强鱼糜的抗冻性,对保持肉糜的持水性和Ca-ATPase活性抑制解冻损失、蛋白质变性有较好的效果。
鲟鱼肉质鲜美,营养丰富,富含人体必需氨基酸、多不饱和脂肪酸和矿物元素。目前市场上与鲟鱼有关的食品多为鲟鱼子酱类,鱼肉产品非常少见。因此开发鲟鱼肉产品具有很好的市场竞争优势。
本实验研究由碳酸氢钠、柠檬酸钠和山梨糖醇按一定配比组成的复合无磷保水剂对反复冻融条件下鲟鱼片解冻损失率、pH值、硫代巴比妥酸(thiobarbituric acid,TBA)值等理化指标的变化及其微观结构的影响,旨在为鲟鱼片产品加工、保鲜、仓储提供重要的基础数据和理论参考。
1 材料与方法
1.1 材料与试剂
鲜活鲟鱼购于保定市河北农业大学科技市场,平均质量1.2~1.5 kg,充氧后1 h内运至实验室;山梨糖醇(食品级) 山东福田药业有限公司;碳酸氢钠、柠檬酸钠、氯化钠、TBA、磷酸氢二钾、磷酸二氢钾(均为分析纯) 国药集团化学试剂有限公司;所有分离用有机溶剂均为国产分析纯;Ca-ATP酶测试盒 南京建成生物工程研究所;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒 康为世纪生物科技有限公司。
1.2 仪器与设备
CP214分析天平 常州奥豪斯仪器有限公司;PHS-3DW pH计 合肥桥斯仪器设备有限公司;风冷速冻柜 广东华尔制冷有限公司;721G可见分光光度计上海仪电分析仪器有限公司;3-18K型高速冷冻离心机美国Sigma公司;XHF-DY高速分散匀浆机 山东博科生物产业有限公司;WSC-2B便携式精密色差仪 上海仪电物理光学仪器有限公司;TMS-Pro物性测试仪 美国FTC公司;RM2016病理切片机 上海莱卡仪器有限公司;E100正置光学显微镜 日本尼康公司。
1.3 方法
1.3.1 样品处理
鲜活鲟鱼在环境温度为10 ℃条件下进行敲击宰杀,去除头、尾、皮、内脏,用无菌冰水冲洗血渍,取鱼背部肌肉切片,鱼片规格为4 cm×2 cm×4 mm,随机分为3组,第1组用蒸馏水浸泡后置于-20 ℃冰箱冷冻保存为空白对照组,第2组用复合保水剂浸泡后置于-40 ℃风冷速冻机至中心温度到达冰点后保存于-20 ℃冰箱中为速冻处理组,第3组用复合保水剂浸泡后直接置于-20 ℃冰箱冷冻保存为缓冻处理组。
复合无磷保水剂由碳酸氢钠∶柠檬酸钠∶山梨糖醇按质量比3∶1∶2复配而成。在4 ℃条件下,按鱼片∶保水剂=1∶2.5(g/mL)在保水剂中浸泡2 h,每隔20 min缓慢搅拌一次。浸泡完成后用滤纸吸干鱼片表面水分,装入自封袋中,按分组要求密封保存。各组样品冻藏48 h,4 ℃解冻24 h为1个冻融循环,用于后续指标测定。
1.3.2 保水性指标测定
1.3.2.1 解冻损失率的测定
称取浸泡后的样品质量记为,鱼片解冻后用滤纸吸干表面水分,称取质量记为,按式(1)计算其解冻损失率:

1.3.2.2 蒸煮损失率的测定
将解冻后的鱼片放入蒸煮袋中,在90 ℃水浴锅中蒸煮5 min,自然冷却到室温,滤纸吸干鱼片表面水分,称取质量记为,按式(2)计算其蒸煮损失率:

1.3.2.3 水分含量的测定
参照GB 5009.3—2016《食品中水分的测定》进行。
1.3.3 pH值的测定
参照GB 5009.237—2016《食品pH值的测定》进行。
1.3.4 TBA值的测定
参照GB 5009.181—2016《食品中丙二醛的测定》进行。
1.3.5 肌原纤维蛋白含量的测定
肌原纤维蛋白提取参照Lu Han等的方法进行;蛋白质质量浓度测定采用双缩脲法,牛血清蛋白作为标准蛋白。
1.3.6 Ca-ATPase活性的测定
参照刘小莉等的方法进行处理。样品中加入9 倍体积的生理盐水均质,10 000 r/min离心10 min,所有操作在4 ℃条件下进行,取上清液稀释至适当浓度,参照Ca-ATP酶活性检测试剂盒说明书进行测定。
1.3.7 肌原纤维蛋白的SDS-PAGE分析
按照凝胶制备试剂盒配制10%分离胶5%浓缩胶,取10 μL样品120 V电压进行电泳,染色液染色,蒸馏水脱色后成像分析。
1.3.8 白度测定
使用色差仪测定每组鱼片表面的*、*、*值,按式(3)计算其白度值:

式中:*为鱼片的亮度;*为正表示鱼片偏红,为负表示鱼片偏绿;*为正表示鱼片偏黄,为负表示鱼片偏蓝。
1.3.9 质构测定
将鱼片切成1 cm×1 cm的块状进行TPA测定。测定参数:选取直径为50 mm的圆柱形探头,起始力为0.3 N,测试速率为60 mm/min,形变量为60%。
1.3.10 微观结构观察
将鱼片切成3 mm的小块,置于体积分数4%多聚甲醛溶液中固定24 h,用手术刀将组织修平整放于脱水盒内,采用乙醇梯度脱水后浸蜡包埋。包埋好的样品用石蜡切片机切片,60 ℃烘箱内烤片,水烤干蜡烤化后取出,脱蜡漂洗后采用苏木素和伊红染色,脱水封片,采用光学显微镜放大100 倍观察。
1.4 数据处理
所有实验均重复3 次,所有数据均采用SPSS 26软件(IBM公司)进行数据统计及显著性分析,<0.05,差异显著。采用Origin 2018软件(OriginLab公司)进行作图。
2 结果与分析
2.1 反复冻融条件下复合无磷保水剂对冷冻鲟鱼片保水性的影响
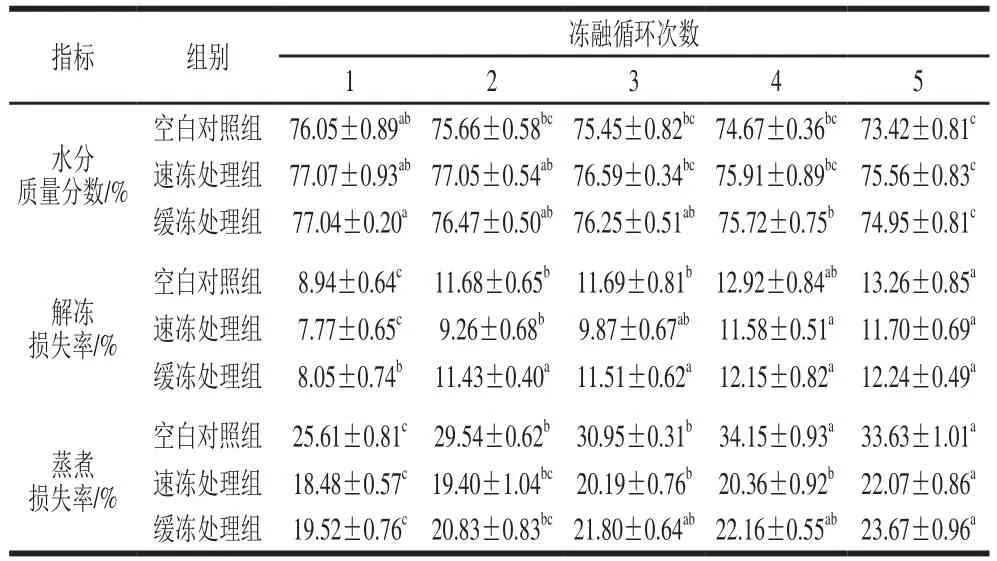
表1 反复冻融对鲟鱼片保水性指标的影响Table 1 Effect of freeze-thaw cycles on water-retaining properties of sturgeon fillets
由表1可知,在冻融循环前期3组鱼片的水分含量降低速率缓慢,后期下降速率增加,经保水剂处理的速冻组降低了1.51%,保水效果优于缓冻处理组和空白对照组。经过5 次冻融循环,鱼片的解冻损失率和蒸煮损失率显著上升(<0.05),速冻处理组上升速率低于缓冻处理组,且都低于空白对照组。说明通过保水剂和速冻处理可以延缓鱼片在冻融循环过程中持水性的降低。
鱼片的保水性关系着产品的口感和外观,同时还会影响游离氨基酸、核苷酸等营养成分的流失。反复冻融过程中,鱼片内不断形成大小不一的冰晶,对细胞造成的机械损伤逐渐累积,使得解冻损失率增加,水分含量降低。研究发现,水产品的解冻损失受细胞的冰晶状态和肌肉的微观结构影响,山梨糖醇浸泡能较好地保持产品的微观结构,显著降低鱼片解冻损失率,速冻处理让肌肉中的汁液迅速形成细小冰晶,因此速冻处理组鱼片的解冻损失最低。影响蒸煮损失的主要原因有:温度的升高;肌原纤维蛋白的收缩;等电点以及pH值的变化。速冻处理组和缓冻处理组由于加入了碳酸氢钠和柠檬酸钠使得肌肉的pH值呈碱性,偏离其本身等电点,从而抑制了蒸煮损失的增加。同时,山梨糖醇可降低水产品肌肉的水分活度,有效防止肌肉蛋白质变性,稳定蛋白质分子空间结构。因此经过保水剂浸泡和速冻处理的鱼片保水性高于其他组。
2.2 反复冻融条件下复合无磷保水剂对冷冻鲟鱼片pH值的影响
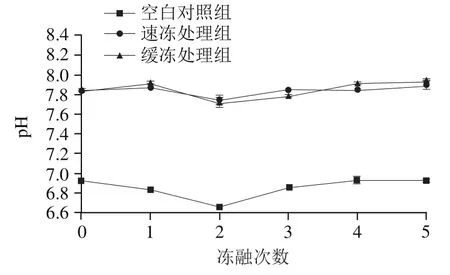
图1 反复冻融对鲟鱼片pH值的影响Fig. 1 Effect of freeze-thaw cycles on pH of sturgeon fillets
由图1可知,所有处理组鱼片的pH值先降低后升高最后趋于平缓。经过2 次冻融后,3组鱼片的pH值与初始值相比都显著降低(<0.05),其中空白对照组pH值降低了3.76%,速冻处理组和缓冻处理组下降了1.40%和1.66%,复合保水剂处理后的pH值变化趋势较空白对照组的更平稳,可能是由于保水剂中含碱性盐,对冻融过程中鱼肉pH值的降低起到了一定缓冲作用。
有研究表明,鱼片在冻融期间会发生一系列生化反应,主要包括糖原酵解、脂肪分解和ATP降解,这些反应会相应产生乳酸、脂肪酸和磷酸等酸性物质,使肌肉整体pH值下降。冻融后期,鱼肉蛋白质分解产生氨基酸、吲哚和胺类等碱性物质,鱼片pH值回升。
2.3 反复冻融条件下复合无磷保水剂对冷冻鲟鱼片TBA值的影响
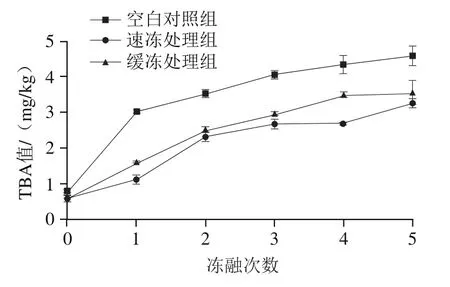
图2 反复冻融对鲟鱼片TBA值的影响Fig. 2 Effect of freeze-thaw cycles on TBA value of sturgeon fillets
由图2可知,随着冻融次数的增加,3个处理组鱼片的TBA值显著升高(<0.05)。经过5 次冻融循环,空白对照组的TBA值显著增加为初始的6.51 倍,高于含保水剂的速冻处理组和缓冻处理组。TBA值代表脂肪氧化终产物丙二醛为主的醛类化合物的含量,是评价肉制品脂肪氧化程度的一项指标。反复冻融过程中,鱼肉中的水分不断发生结晶与重结晶,一些促氧化成分随液汁流出;同时,鱼肉液汁产生的冰晶破坏了鱼片表面的完整性,使脂肪与空气的接触面积增加,加速了脂肪氧化酸败。有研究表明,山梨糖醇能够螯合肌肉中的金属离子,延缓不饱和脂肪酸氧化。本研究发现,含保水剂的速冻处理组和缓冻处理组在冻融过程中鱼片的TBA值均低于空白对照组,表明经复合保水剂处理能有效抑制鱼片在冻融循环过程中脂肪氧化的发生。
2.4 反复冻融条件下复合无磷保水剂对冷冻鲟鱼片肌原纤维蛋白的影响

图3 反复冻融对鲟鱼片肌原纤维蛋白含量的影响Fig. 3 Effect of freeze-thaw cycles on myofibrillar protein content of sturgeon fillets

图4 反复冻融过程中肌原纤维蛋白SDS-PAGE图谱Fig. 4 Effect of freeze-thaw cycles on SDS-PAGE profile of myofibrillar proteins in sturgeon fillets
由图3可知,随着冻融过程的进行,鲟鱼片中肌原纤维蛋白质量浓度显著降低。经过2 次冻融循环,空白对照组蛋白质质量浓度显著下降了54.82%,速冻处理组和缓冻处理组蛋白质质量浓度比初始值显著下降了26.07%和34.85%。经过5 次冻融处理,速冻处理组和缓冻处理组蛋白质质量浓度比初始值显著下降了48.55%和53.02%,下降幅度均低于空白对照组的74.74%。蛋白质SDSPAGE结果(图4)也清楚地显示出,经过5 次冻融,速冻处理组肌原纤维蛋白中原肌球蛋白和肌球蛋白轻链比另两组处理的条带更深、更粗,表明速冻处理组中盐溶性肌原纤维蛋白的含量与空白对照组和缓冻处理组相比浓度更高,这一结果表明速冻和保水剂处理对鲟鱼肌原纤维蛋白损伤最小。
肌原纤维蛋白占鱼肉蛋白质的50%~60%,是鱼肉中含量最高、最重要的蛋白质,影响着产品的营养品质及感官价值。在反复冻融过程中,蛋白质空间结构发生变化,形成氢键、二硫键、疏水键等,导致蛋白之间作用力加强,与水的作用力减弱,蛋白质溶解度下降。姜晴晴等研究发现,在冻融循环过程中,肌原纤维蛋白中的肌球蛋白比肌动蛋白更容易发生变性,与本研究结果相似。章蔚等通过研究发现,浸泡过碳酸氢钠的鱼肉样品冻藏期间蛋白溶解度的降低程度显著低于蒸馏水对照组。由于碳酸氢钠可以增强蛋白质间的静电斥力提高蛋白质溶解度;同时山梨糖醇含有的羟基,对抑制蛋白质冷冻变性有较好效果。本研究结果也显示,在冷冻鲟鱼片中加入碳酸氢钠、山梨糖醇和柠檬酸钠复合保水剂对延缓冻融循环条件下蛋白质变性有一定改善作用。
2.5 反复冻融条件下复合无磷保水剂对冷冻鲟鱼片Ca2+-ATPase活性的影响

图5 反复冻融对鲟鱼片Ca2+-ATPase活性的影响Fig. 5 Effect of freeze-thaw cycles on Ca2+-ATPase activity of sturgeon fillets
由图5可知,随着冻融次数的增加,空白对照组、速冻处理组和缓冻处理组Ca-ATPase活性均显著降低。经过2 次冻融循环,空白对照组Ca-ATPase活性剧烈下降了54.31%,速冻处理组和缓冻处理组Ca-ATPase活性分别下降了38.21%和40.39%。经过5 次冻融循环,速冻处理组和缓冻处理组Ca-ATPase活性比初始分别显著降低了62.51%和65.86%,下降幅度均低于空白对照组的72.16%。
肌球蛋白约占肌原纤维蛋白60%,由于其头部具有Ca-ATPase活性,因此Ca-ATPase活性可以间接反映出肌原纤维变性程度。在反复冻融过程中,肌球蛋白头部构象发生改变是造成Ca-ATPase活性下降的主要原因。梁鹏等研究发现,在蓝圆鲹冷冻鱼糜中加入山梨糖醇能显著抑制Ca-ATPase活性下降;王宁研究发现,含山梨糖醇和柠檬酸钠的复合抗冻剂可以显著抑制大黄鱼蛋白Ca-ATPase活性的降低。同时,由于复合保水剂中含有碳酸氢钠和柠檬酸钠,鱼片pH值可以较好地维持在弱碱性环境中以保护蛋白质不变性。本研究表明,在反复冻融条件下复合保水剂对鲟鱼片的Ca-ATPase活性降低有一定抑制作用。
2.6 复合无磷保水剂对反复冻融状态下冷冻鲟鱼片白度的影响
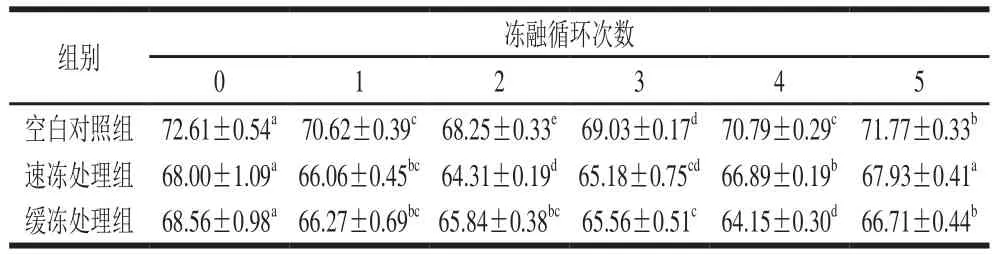
表2 反复冻融对鲟鱼片白度的影响Table 2 Effect of freeze-thaw cycles on whiteness value of sturgeon fillets
由表2可知,在冻融循环过程3个处理组鱼片的白度值都呈现出先降低后升高的趋势。其中,空白对照组鱼片在第2次冻融循环后白度值显著下降了6.0%,此时,速冻处理组和缓冻处理组鱼片白度比初始显著降低了5.42%和3.97%,下降幅度均低于空白对照组。从第3次冻融循环开始,各组鱼片白度值又呈现出缓慢增加趋势。经过5 次冻融循环,速冻处理组鲟鱼片白度值与初始值相比无显著差异。
分析鱼片在冻融循环过程中白度值都呈现出先降低后升高趋势的原因,可能是鱼片在冻融循环期间脂肪发生氧化反应,形成的羰基化合物和氨基酸等氨基化合物发生反应,生成深色产物,导致肌肉切面颜色变暗;此外,鱼肉中的铁、铜等金属离子被催化氧化后也可导致肌肉颜色的加深。在冻融循环后期,由于肌肉细胞受到冰晶的损伤,汁液损失量增加,鱼肉体内的色素随着汁液流失,导致白度增大;同时,渗出的汁液附着在鱼片表面使光反射增加,也是鱼片白度值增加的一个原因。在本研究中速冻处理组和缓冻处理组加入了复合保水剂,特别是速冻处理组在经过5 次冻融后其白度值变化最小,该结果与复合保水剂可有效缓解脂肪氧化和水分流失密切相关,因此经复合保水剂处理可以缓解鲟鱼片在冻融循环过程中白度值的降低,同时该研究也显示速冻处理相对于缓冻处理更有利于保持鱼片的白度值。
2.7 复合无磷保水剂对反复冻融状态下冷冻鲟鱼片质构的影响
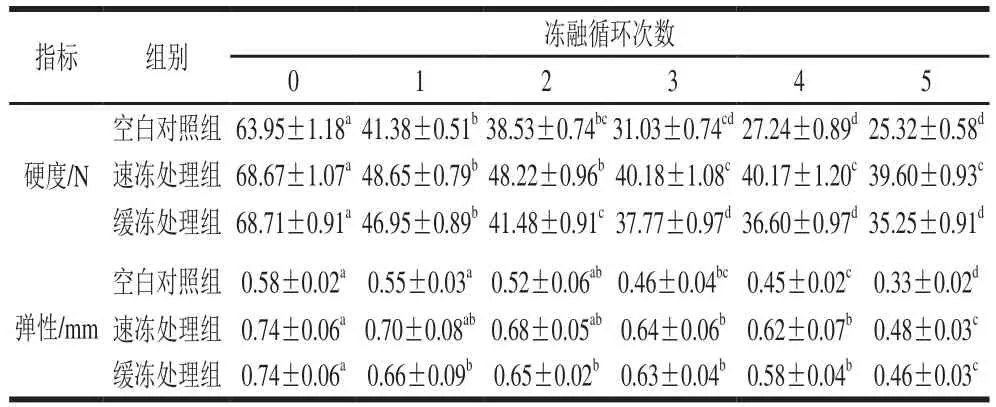
表3 反复冻融对鲟鱼片质构的影响Table 3 Effect of freeze-thaw cycles on texture characteristics of sturgeon fillets
由表3可知,经过5 次冻融循环,各处理组鱼片的硬度和弹性均显著降低,其中,速冻处理组和缓冻处理组的硬度分别降低了42.33%和48.69%,空白对照组降低了60.41%;速冻处理组和缓冻处理组的弹性分别降低了35.13%和37.84%,空白对照组降低了43.10%。
鱼片的质构特性与其持水性密切相关,由于速冻处理组和缓冻处理组都经过复合保水剂处理,对鱼片的水分流失和蛋白质的变性有一定抑制作用,所以两组鱼片在冻融循环各阶段的硬度和弹性值都高于空白对照组,与缓冻处理组相比,速冻处理的鲟鱼片质构损伤最小,表明速冻和保水剂处理是保持鲟鱼片质构品质行之有效的处理方式。
2.8 复合无磷保水剂对反复冻融状态下冷冻鲟鱼片微观结构的影响

图6 反复冻融过程中鲟鱼片微观组织图(×100)Fig. 6 Effect of freeze-thaw cycles on microstructure of sturgeon fillets (× 100)
如图6所示,新鲜鱼肉的肌肉纤维结构饱满,排列整齐,染色均匀,肌纤维束清晰可见(图6A)。经过5 次冻融后各组鱼片肌纤维结构都发生了明显形变。从速冻处理组纵切面(图6B)发现,其纤维束排列变得轻微杂乱且部分纤维发生黏连,其横截面(图6B)与新鲜样品相比纤维已不再圆润饱满。缓冻处理组纵切图(图6C)显示,鱼肉的纤维束排列较为分散杂乱,部分纤维已经断裂,其横截面(图6C)与速冻处理组相比,鱼肉纤维之间空隙更大更杂乱无章。空白对照组(图6D)形变最为严重,多数纤维束已经断裂且排列非常杂乱,纤维之间空隙很大,从该组鱼片的纵切面(图6D)和横切面(图6D)都能发现,肌纤维束边缘染色较好,纤维中间由于多次受到冻融冰晶的损伤形成了空洞而无法染色,这与Jiang Qingqing等的发现相似。
鱼片的微观结构与其持水性和肌肉腐败程度密切相关。鱼片在多次冻融过程中,受到冰晶的损伤逐渐累加,对肌纤维造成挤压加剧导致纤维发生形变。同时,鱼肉的结缔组织在自身蛋白酶和微生物的作用下发生降解,导致肌纤维粘黏,是鱼肉组织结构变模糊的主要原因。空白对照组由于没有保水剂的保护,在受到冰晶挤压时肌肉细胞内物质被排到细胞外的空隙中,随着解冻的液体流失,这是造成图6D中大量空洞产生的原因。从图6还可以看出,两个处理组纤维间隙更小,纤维完整度更高,这也与处理组持水性和弹性高于对照组的结果相呼应。因此,复合保水剂处理对鲟鱼片在冻融期间微观结构的劣变有一定抑制作用。
3 结 论
研究了鲟鱼片在反复冻融条件下理化特性及微观结构的变化。随着冻融次数的增加,3组鲟鱼片的解冻损失率、蒸煮损失率、丙二醛含量均显著上升,水分含量、白度值、肌原纤维蛋白含量、Ca-ATPase活性、硬度和弹性显著降低,与空白对照组相比,经碳酸氢钠、柠檬酸钠和山梨糖醇复配无磷保水剂处理的鲟鱼片各品质指标变化速率相对平缓。同时,保水剂处理能更好地保持鲟鱼片在冻融期间肌纤维的结构形态。综上,温度波动会导致鲟鱼片品质发生劣变,加入复合无磷保水剂对鲟鱼片冻融期间水分的流失、蛋白质的变性和微观结构的劣变有明显的抑制作用。本研究结果对鲟鱼片产品的开发、保鲜、贮藏等具有一定的理论和实践指导意义。
