复合米糠蛋白-卵白蛋白的起泡特性及相关机理分析
2022-07-07张燕鹏张曼君刁云春张维农胡志雄
张燕鹏,张曼君,刁云春,张维农,胡志雄,胥 伟,*
(1.武汉轻工大学 大宗粮油精深加工教育部重点实验室,湖北 武汉 430023;2.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
米糠蛋白(rice bran protein,RBP)不仅氨基酸配比合理均衡,营养价值较高,而且具有低过敏性、高消化率等良好的生理功能特性,因此是一种优质的植物蛋白质资源,特别适合开发应用于婴幼儿和特殊人群营养配方食品。另外RBP中高含量的白蛋白和球蛋白使其具有较好的溶解性和其他相关的加工功能特性,如起泡性和乳化性,因此也可被研究作为起泡剂与乳化剂而应用于食品加工中。卵白蛋白(ovalbumin,OVA)作为蛋清中的主要蛋白质,因其分子结构中含有较多的疏水性氨基酸组分,可作为乳化剂和发泡剂以使得多相体系保持良好的稳定特性,因此是食品加工制备过程中一种良好的功能性成分。已有研究表明,RBP在等电点附近的起泡能力较差,而OVA在等电点附近时其起泡能力则较好,这表明不同来源的蛋白质根据环境因子的变化会表现出不同的起泡特性,这也使得单一蛋白质在泡沫型食品加工过程中具有一定的局限性。因此在实际应用中如果可以将两种或更多的蛋白质复配应用,不仅可以增加蛋白质营养功效,同时也是一种简单高效的改善蛋白质溶液功能特性的方法。
本课题组前期研究发现当RBP溶液pH 4.0和pH 7.0时,添加1%的NaCl其起泡能力可以显著性增加,但只对pH 7.0条件下的泡沫稳定性有显著改善。因此结合上述的相关内容,本实验主要研究在pH 4.0和pH 7.0条件下添加1% NaCl后,RBP-OVA所组成RBP-OVA复合蛋白溶液起泡特性的变化规律,并对比研究分析溶液状态和泡沫状态下相关蛋白质的理化特性,以探讨RBP-OVA复合蛋白在起泡特性上的互补协同作用及其相关机理,以期为复合蛋白质在实际应用中提供理论依据,并为促进RBP在食品加工领域的应用发展提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
RBP(蛋白质质量分数84.9%)由实验室自制;OVA(纯度62%~88%)、1-苯胺基萘-8-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS,分析纯) 美国Sigma公司;盐酸、氢氧化钠、氯化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SorvallRC6Plus型高速冷冻离心机 美国Thermo Scientific公司;FiveEasy实验pH计 瑞士Mettle Toledo公司;Alpha 1-2 LD plus冷冻干燥机 德国Christ公司;KND-103F自动定氮仪 上海纤检仪器有限公司;手持式30631型电动打蛋器 日本ECHO公司;Zetasizer-NanoZS纳米粒度电位仪 英国Malvern Instrument公司;F-4600荧光分光光度计 日本日立公司;HJ-4多头磁力加热搅拌器 金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 RBP与OVA的复合蛋白质溶液配制
分别称取适量的RBP与OVA配制5 mg/mL蛋白质溶液,于磁力搅拌器上搅拌2 h后放入4 ℃冰箱水化过夜。将按照RBP-OVA质量比分别为1∶0、3∶1、1∶1、1∶3、0∶1配制蛋白质量浓度为5 mg/mL的RBP-OVA复合蛋白质溶液,并分别调节至pH 4.0和pH 7.0,另外取部分RBP-OVA复合蛋白质溶液再添加1% NaCl以研究盐离子对其起泡特性的影响。
1.3.2 蛋白质溶液起泡特性的测定
起泡特性的测定在解长远和Sheng Long等方法基础上作一定的修改。取30 mL蛋白质溶液于特制带刻度的试管(直径4 cm、高10 cm)中,将电动打蛋器伸入到溶液中约1 cm处,搅拌15 s后,立即测量泡沫体积,静置2 h后再次测定体积。按式(1)、(2)计算蛋白质的起泡能力及泡沫稳定性:

1.3.3 泡沫状态下蛋白质样品的制备
取RBP-OVA复合蛋白质溶液,按1.3.2节方法进行搅打起泡后,收集其上层泡沫待消泡后备用。
1.3.4 蛋白质粒径分布与Zeta电位测定
根据Wouters等的方法测定蛋白质的粒径分布与Zeta电位。取一定量的蛋白质溶液,于25 ℃、8 000 r/min离心15 min,调节蛋白质溶液的质量浓度为0.2 mg/mL,采用纳米粒度电位仪,测定蛋白质溶液的粒径分布与Zeta电位。
1.3.5 蛋白质的表面疏水性测定
参考冯芳等的方法,用ANS作荧光探针测定蛋白质的表面疏水性。取配制好的蛋白质溶液在25 ℃、8 000 r/min离心20 min后,分别配制质量浓度0.04、0.06、0.08、0.10、0.12、0.14 mg/mL的蛋白质溶液,并依次在5 mL不同质量浓度的蛋白质溶液中加入20 μL 8.0 mmo1/L的ANS溶液。采用荧光分光光度计测定加入ANS的蛋白质样品溶液及对照溶液的荧光强度,设定激发光和发射光分别为390 nm和470 nm,设定狭缝宽度为5 nm,将测定数据以蛋白质量浓度和荧光强度分别为横纵坐标作图,曲线斜率即为蛋白质的表面疏水性指数。
1.3.6 蛋白质的荧光光谱测定
参考Zhang Yanpeng等的方法测定RBP内源荧光光谱。取配制好的蛋白质溶液在25 ℃、8 000 r/min离心15 min后,将蛋白质溶液质量浓度调节为0.2 mg/mL,使用荧光光谱仪,设定激发波长为295 nm,在300~480 nm范围内1 200 nm/s进行扫描分析。
1.4 数据处理
所有实验均重复3 次求平均值,采用Origin 8.5和SPSS分析软件对实验数据进行处理分析。
2 结果与分析
2.1 蛋白质溶液的起泡特性分析
2.1.1 蛋白质溶液在pH 4.0条件下的起泡特性
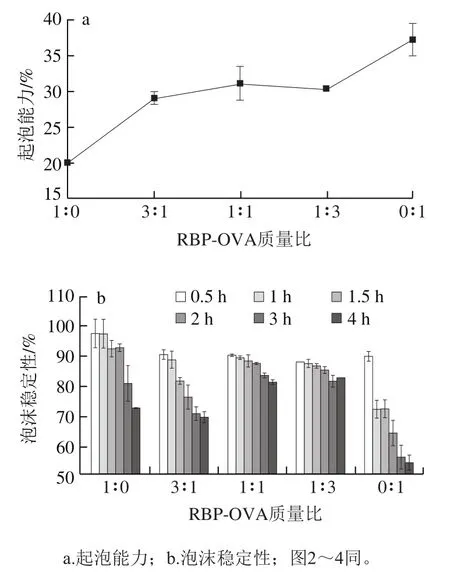
图1 蛋白质溶液在pH 4.0条件下的起泡特性Fig. 1 Foaming properties of proteins at pH 4.0
由图1a可知,当pH 4时RBP的起泡能力明显低于OVA,二者分别为20.0%和37.2%,而随着RBP在RBPOVA复合蛋白中含量的减少,其起泡能力逐渐增加。这可能与两种蛋白质在pH 4.0条件下所带的净电荷量,蛋白溶解度,粒径分布及分子结构不同有关,而这些理化性质可以影响蛋白质分子在界面的吸附速度,从而使其具有不同的起泡能力。由图1b可知,当pH 4.0时RBP的泡沫稳定性优于OVA,且当RBP-OVA质量比为3∶1、1∶1和1∶3时,RBP-OVA复合蛋白在2 h以后的泡沫稳定性相对OVA有显著(<0.05)的改善,并且在1∶1和1∶3条件下RBP-OVA复合蛋白溶液的泡沫稳定性在2 h后表现为协同作用,泡沫稳定性均高于单一的蛋白质溶液,这可能由于两种蛋白质在该条件下可以在界面处产生相互作用形成较好的黏弹性界面膜,使得RBP-OVA复合蛋白质溶液的泡沫体系相对稳定。
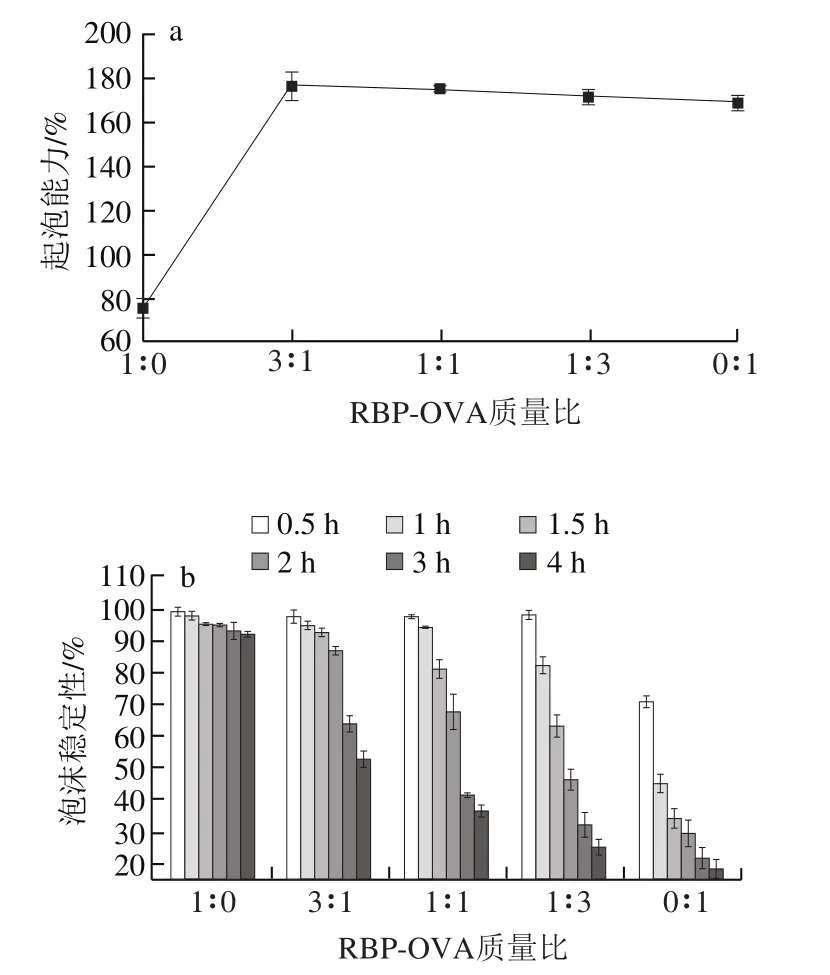
图2 蛋白质在pH 4.0、1% NaCl条件下的起泡特性Fig. 2 Foaming properties of proteins under pH 4.0 and 1% NaCl conditions
由图2a可知,在加入1% NaCl后两种蛋白质的起泡能力均显著增加,且RBP-OVA复合蛋白质的起泡能力表现为协同作用,特别是当RBP-OVA质量比为3∶1时,RBPOVA复合蛋白质的起泡能力可达176.9%,与OVA的起泡能力相比没有显著性差异(>0.05)。这说明盐离子的添加可改变蛋白质的表面净电荷,粒径分布或者分子结构,从而使得蛋白质分子易于吸附至气-水界面。由图2b可知,随着OVA在RBP-OVA复合蛋白质中比例的增加,其泡沫稳定性显著下降,当RBP-OVA质量比为3∶1时,RBP-OVA复合蛋白在1~1.5 h内的泡沫稳定性相对RBP泡沫稳定性无显著差异(>0.05),但相比OVA则有显著(<0.05)的改善。另外与未加NaCl的RBPOVA复合蛋白溶液相比,RBP-OVA质量比为3∶1时的RBP-OVA复合蛋白在2 h内的泡沫稳定性可显著性增加至86.7%,这表明在该条件下RBP-OVA复合蛋白质的分子结构与物化性质可保持较好的平衡,既能使其起泡能力得到较好的改善,同时也能使RBP-OVA复合蛋白保持较好的泡沫稳定性,从而为在等电点附近蛋白质得到更广泛的应用提供了基础。
2.1.2 蛋白质溶液在pH 7.0下的起泡特性
由图3a可知,当pH 7.0时,RBP的起泡能力优于OVA,且RBP-OVA复合蛋白质起泡能力随RBP比例的减少而降低。这表明与pH 4.0相比,两种蛋白质的物化性质和分子结构在pH 7.0发生了改变,使得其起泡能力发生了变化。图3b结果表明,在pH 7.0条件下,RBP的泡沫稳定性比OVA的稳定性差,OVA泡沫稳定性在4 h后依然可高达73.8%,因此在RBP中加入OVA后可一定程度上改善其泡沫稳定性,但随着OVA比例的增加其改善效果并没有明显的增加,这说明OVA对RBP-OVA复合蛋白质泡沫稳定性的提高有限。
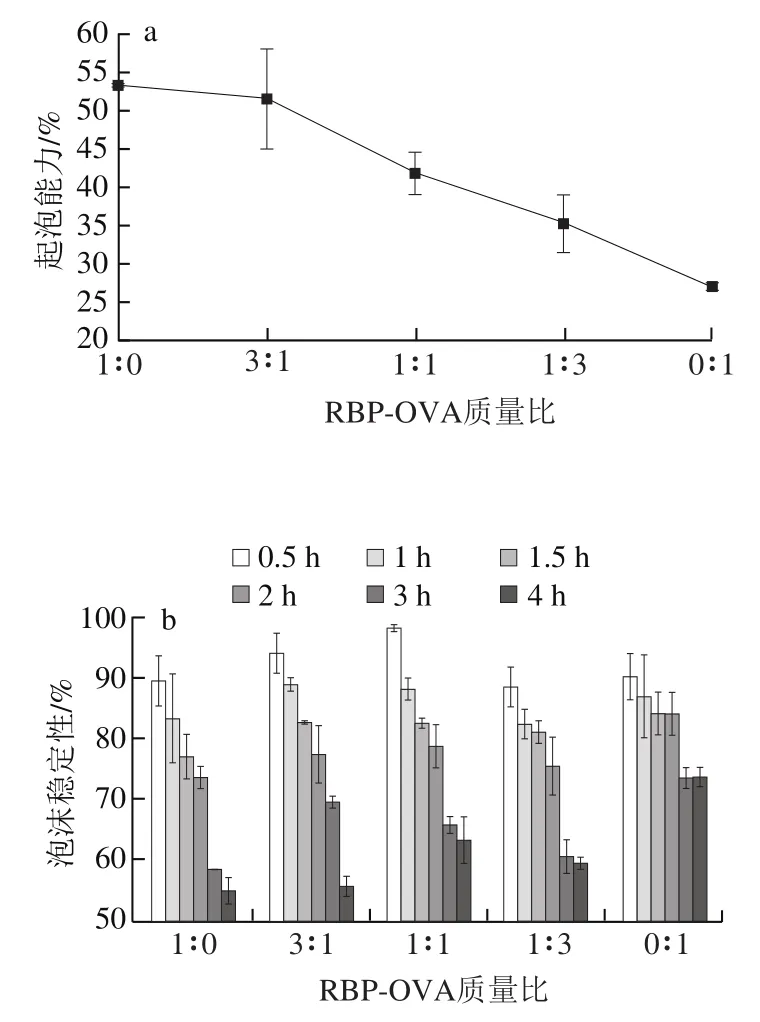
图3 蛋白质在pH 7.0条件下的起泡特性Fig. 3 Foaming properties of proteins at pH 7.0
由图4a可知,RBP的起泡能力优于OVA,起泡能力可达103.0%,但RBP-OVA复合蛋白质起泡能力随RBP比例的减少先减少后增加。与图3a相比,在pH 7.0条件下NaCl的添加均可以使得蛋白质的起泡能力增加,但RBPOVA复合蛋白质的起泡能力则表现为拮抗作用,这说明NaCl的添加使得两种蛋白质之间的相互作用不利于RBPOVA复合蛋白快速的吸附至气-水界面以降低界面张力。图4b结果表明,在该条件下,RBP-OVA复合蛋白质泡沫稳定性随RBP比例的减少先增加后减少,其泡沫稳定性表现为协同作用,当RBP-OVA质量比为1∶1时,起泡后4 h其泡沫稳定性依然可维持在69.4%,这可能与两种蛋白质在界面处的相互作用有关。


图4 复合蛋白质在pH 7.0、1% NaCl条件下的起泡特性Fig. 4 Foaming properties of mixed proteins under pH 7.0 and 1%NaCl conditions
综合上述有关蛋白质起泡特性的相关分析,进一步研究分析在pH 4.0、1% NaCl的条件下,RBP、OVA以及RBP-OVA复合蛋白(RBP-OVA质量比为3∶1)3种蛋白质体系的相关物化性质。因为在该环境条件下,两种蛋白质在起泡能力上表现为协同作用的同时也有效改善了RBP-OVA复合蛋白的泡沫稳定性。另外pH 4.0接近两种蛋白质的等电点,通过对该条件下RBP-OVA复合蛋白的相关理化性质进行分析,有利于促进两种蛋白在等电点时的加工利用。
2.2 蛋白质在溶液与泡沫状态下的粒径分布分析
由图5可知,对于各种蛋白质样品而言,气-液界面处的蛋白质与溶液中蛋白质具有相似的粒径分布。在pH 4.0、1% NaCl的条件下RBP的粒径大于OVA,而当在RBP中加入OVA后,RBP-OVA复合蛋白的粒径则变小且其粒径与OVA一致。这说明OVA的加入改变了蛋白质分子间的相互聚集状态,使得RBP-OVA复合蛋白的粒径变小,从而使其更易于快速扩散至气-液界面以改善RBPOVA复合蛋白的起泡能力。
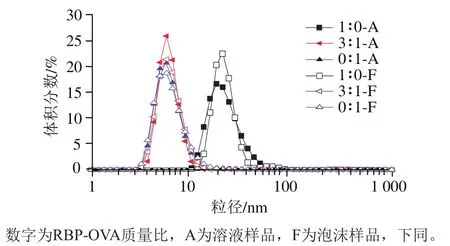
图5 蛋白质在溶液与泡沫状态下的粒径分布Fig. 5 Particle size distribution of proteins in solution and foam
2.3 蛋白在溶液与泡沫状态下的Zeta电位分析
由表1可知,在溶液状态下OVA所带净电荷量小于RBP,而较少的净电荷量有利于降低蛋白质在界面吸附时的空间位阻能量,因此有利于卵蛋白更快的吸附于界面,提高其起泡能力。当两种蛋白复合时,RBP-OVA复合蛋白的净电荷量增加,这说明在pH 4.0、1% NaCl条件下两种蛋白质之间可能发生了相互作用,使得RBPOVA复合蛋白所带表面电荷增加,水化能力增强,有利于增大其溶解性,进而使得RBP-OVA复合蛋白的起泡能力显著增加(图2a)。另外表1显示泡沫状态下RBP-OVA复合蛋白质与OVA所带净电荷相对溶液状态下均有所增加,这可能是因为这两类蛋白质在界面处所受盐离子的电荷屏蔽作用较弱,而蛋白质表面净电荷的增加可以使得气泡之间的电荷排斥作用增强,有利于泡沫体系的稳定性。从不同蛋白质在溶液与泡沫状态下的Zeta电位的变化可知,净电荷的变化会一定程度上影响RBP-OVA复合蛋白的起泡能力与稳定性,但同时也要考虑其他因素比如蛋白质在界面处的排列与相互作用及表面疏水性等物化性质对其起泡特性的影响。

表1 蛋白质在溶液与泡沫状态下的Zeta电位Table 1 Zeta potential of proteins in solution and foam
2.4 蛋白质在溶液与泡沫状态下的表面疏水性分析
由图6可知,在溶液和泡沫状态下,OVA因其含有较多的疏水基团,蛋白质的表面疏水性较高,并且随RBP所占比例的减少RBP-OVA复合蛋白质的表面疏水性也显著增加,而表面疏水性的增高有利于RBP-OVA复合蛋白质更容易附到气-液界面形成泡沫体系。同时结合粒径以及Zeta电位的实验结果可知,OVA的物化性质更有利于RBP-OVA复合蛋白起泡能力的提高,这也与图2a中蛋白质起泡能力结果一致。图6结果还表明,泡沫状态下蛋白质的表面疏水性低于溶液状态下的蛋白质,这说明对于蛋白质的起泡特性而言,蛋白质的表面疏水性达到一定程度后将不会再对其起泡特性产生影响,因此还需要考虑吸附于界面的蛋白质分子结构的影响。
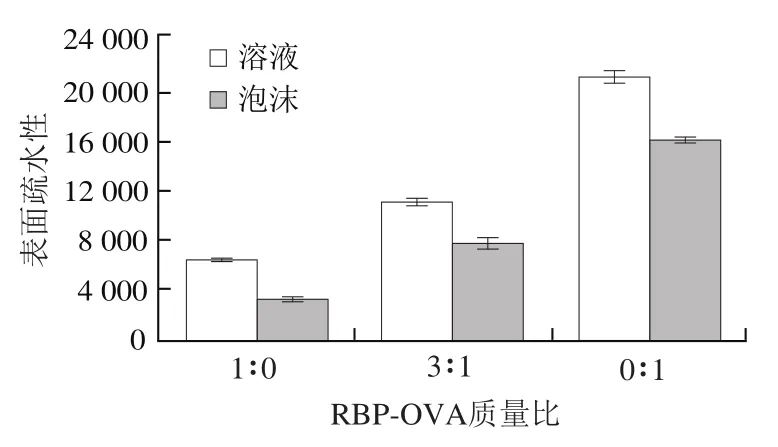
图6 蛋白质的表面疏水性分析Fig. 6 Analysis of surface hydrophobicity of proteins
2.5 蛋白质在溶液与泡沫状态下的荧光光谱分析
由图7可知,在pH 4.0、1% NaCl的环境条件下,RBP荧光图谱中的最大发射波长在356 nm,而OVA与RBP-OVA复合蛋白的最大发射波长则在338 nm左右,这说明RBP的分子结构相对比较展开,分子柔性较高,因此其在界面可以快速发生重排以行成黏弹性界面膜,从而有利于泡沫体系的稳定性。当RBP溶液中加入OVA后,RBP-OVA复合蛋白的最大荧光波长发生蓝移,这说明RBP与OVA发生相互作用而使得RBP-OVA复合蛋白质分子发生折叠而变的紧密,使得RBP-OVA复合蛋白质的分子柔性结构相对弱于RBP,因此在泡沫稳定性上低于RBP。同时OVA与RBP-OVA复合蛋白在泡沫状态下的荧光强度低于液体状态,这表明界面处蛋白质分子微环境的极性增加,分子结构发生去了去折叠。

图7 蛋白质在溶液与泡沫状态下的内源荧光光谱图Fig. 7 Intrinsic fluorescence spectra of proteins in solution and foam
综合上述研究可知,RBP与OVA在pH 4.0、1% NaCl的环境条件下之所以可产生协同效应,主要是因为二者在与起泡特性相关的分子特性方面具有一定的互补性,这样有利于从物化性质的不同方面改善RBP-OVA复合蛋白的起泡能力与泡沫稳定性。
3 结 论
分析了在pH 4.0、7.0,1% NaCl等环境条件下,RBP、OVA及二者复合蛋白的起泡特性。研究结果表明NaCl的添加有利于改善蛋白质的起泡能力,且在pH 4.0、NaCl添加量为1%的条件下,当RBP-OVA质量比为3∶1时,其RBP-OVA复合蛋白的起泡能力和泡沫稳定性达到一个相对平衡的状态,起泡能力可达176.9%,泡沫在2 h内可稳定在86.7%。这表明在适合的条件下以一定的比例将蛋白质进行复合,可改善蛋白质产品的起泡能力和泡沫稳定性,这对泡沫型食品加工的实际加工应用具有一定的指导意义。
通过对蛋白质在溶液和泡沫状态下相关物化性质的研究表明,在pH 4.0、1% NaCl的环境条件下,RBP与OVA之间可发生相互作用而影响RBP-OVA复合蛋白的净电荷量、粒径、表面疏水性及分子结构等蛋白质分子特性,并且这些分子特性在起泡能力与泡沫稳定性方面可以产生一定的协同效应以改善RBP-OVA复合蛋白的起泡特性。
