黄体期注射PGF2α对母羊血清生殖激素及相关细胞因子的影响
2022-07-07段春辉宋志攀岳思聪张英杰刘月琴
李 宇,段春辉,宋志攀,岳思聪,王 媛,张英杰,刘月琴*
(1.河北农业大学动物科技学院,保定 071000; 2.衡水志豪畜牧科技有限公司/河北省肉羊产业研究院,衡水 053000)
母畜进入初情期后开始出现周期性的发情表现,同时伴随着卵巢上卵泡发育、成熟排卵及黄体的形成与退化的周期性变化过程。排卵后残留的卵泡壁塌陷,卵泡膜的结缔组织、毛细血管等伸入到颗粒层,在LH的作用下转化成体积较大,富含毛细血管并具有内分泌功能的细胞团,称黄体。黄体分泌大量P对发情周期和妊娠均有重要意义。若卵子未受精,黄体在某个时间节点发生以P水平降低为标志的功能性退化,以及以体积减小,丧失完整性为标志的结构性退化。黄体退化导致P水平降低,刺激新卵泡发育,促使动物再次发情,黄体正常退化是母畜周期性发情的重要前提。黄体周期性的生成、发育与退化是受很多信号通路调控的复杂过程,涉及炎症、凋亡、血管生成、类固醇生成等多环节,研究发现细胞因子的转录丰度对黄体退化有影响。其中,肿瘤坏死因子(TNF)、白介素(IL)和干扰素(IFN)是机体主要的免疫活性物质,在调控动物周期性生殖活动方面具有重要作用。
前列腺素F2α(prostaglandin F2α,PGF2α)作为多种非灵长类哺乳动物种属的生理性黄体溶解剂,可以促进黄体加速退化,在生产上广泛应用于诱导母畜同期发情与繁殖障碍治疗。研究表明,用PGF2α处理假孕大鼠后1、2、8 h时血清P浓度显著降低,卵巢组织孕酮分解代谢相关通路蛋白(NR4A1-S)、信号传导途径相关蛋白(p-ERK-1/2)在PGF2α处理后1和2 h显著提升;发情周期第10~12天的母牛肌注PGF2α后30 min至2 h时黄体血流急性增加,注射后30 min P水平显著下调,并随着时间的推移进一步降低。说明PGF2α可以极短时间内到达并作用于黄体,通过调控黄体血管舒张影响黄体分泌功能,调节母畜内分泌环境。研究表明,在猪、牛、绵羊等多个物种均存在早期黄体对PGF2α不应答的现象,但也有研究发现排卵后第7~10天的母羊在PGF2α处理后仍有33%未发生黄体溶解,说明各时期黄体对PGF2α敏感性不同,因此在生产上采用PGF2α一次处理母羊时发情率往往不如人意,需要注射两次才能达到理想效果。因此,本试验分别在母羊黄体前期、中期和末期注射PGF2α,分析PGF2α对母羊激素和黄体退化相关细胞因子的影响,以期明确PGF2α在黄体期不同阶段的作用特点,并为解析PGF2α启动湖羊黄体溶解的机制和提高母畜繁殖效率提供理论依据。
1 材料与方法
1.1 试验时间与地点
本试验于2020年11月20日至2020年12月29日在河北省衡水市武邑县志豪畜牧科技有限公司进行。
1.2 试验动物及饲养管理
选择体重相近((34.94±2.99) kg)、体况良好、健康的7月龄育成湖羊母羊60只。试验开始前对试验羊进行统一称重、驱虫,并对圈舍进行清扫消毒。所有试验羊均舍饲养殖,饲喂TMR日粮,精粗比为2∶8,每日于07:00和16:30饲喂,自由饮水。
1.3 试验设计
所有试验羊在正式试验开始前进行发情周期同步化处理:采用氟孕酮海绵栓(MAP,45 mg·只,SYNCRITE-45 Vaginal Sponge,澳大利亚)埋置13 d, 撤栓同时肌注PMSG(300 IU·只)。选择撤栓后24~48 h内发情羊48只,随机分为6组,每组8只。发情当天记为发情周期第0天,3个试验组母羊分别在第6(黄体前期试验组)、11(黄体中期试验组)、16天(黄体末期试验组)于早上饲喂前肌注1 mL氯前列醇钠(0.1 mg,宁波三生生物科技有限公司),3个对照组母羊在相同黄体时期注射1 mL 生理盐水(NS)。每次注射后0.5、1、2、3 h颈静脉采血5 mL,静置4 h后3 000 r·min离心10 min, 收集上清置于-20 ℃冰箱保存待测。
1.4 测定指标
采用酶联免疫分析测定试剂盒(南京建成生物工程研究所)测定FSH、LH、PRL、P和E5种生殖激素水平,以及TNF-α、IL-1β、IL-6、IFN-β 4种炎症因子。
1.5 数据处理及分析
采用SPSS 22.0软件的独立样本检验(-test)程序分析同时期同时间点两组间数据差异。使用单因素方差分析法(one-way ANOVA)分析相同时期组内各时间点数据差异与各时期各组激素整体水平差异,并用最小显著差检验法(LSD)进行多重比较。<0.05表示差异显著。数据均以“平均值±标准误(mean±SE)” 表示。
2 结 果
2.1 在黄体期不同阶段注射PGF2α对试验羊血清中FSH、LH、PRL、P4和E2水平的影响
由图1可知,各黄体时期对照组与试验组组内FSH、LH、PRL、E和P水平均未在注射后3 h内出现显著变化(>0.05)。黄体前期试验组P水平在注射后3 h显著低于对照组(<0.05),中期试验组P水平在注射后1 h显著低于对照组(<0.05);前期试验组E水平在注射后3 h显著高于对照组(<0.05),其余各时期各时间点试验组和对照组血清FSH、LH、PRL、E和P水平均没有显著差异(>0.05)。
由表1可知,对照组FSH水平在整个黄体期没有显著变化(>0.05),黄体前期试验组FSH水平显著高于中期和末期试验组(<0.05);注射PGF2α后,前期试验组FSH水平显著高于对照组(<0.05),对黄体中、末期FSH水平没有显著影响(>0.05)。LH水平黄体末期对照组显著高于前期和中期对照组(<0.05),3个时期的试验组LH水平差异不显著 (>0.05);注射PGF2α对各黄体时期LH水平影响不显著(>0.05)。PRL水平黄体中、末期对照组和试验组分别显著高于前期对照组和试验组(<0.05);注射PGF2α对各黄体时期PRL影响不显著(>0.05)。P水平黄体中期对照组显著高于末期对照组(<0.05),中期和末期对照组与前期对照组差异不显著(>0.05);中期和末期试验组P水平显著高于前期试验组(<0.05);注射PGF2α后,前期试验组和中期试验组P水平分别显著低于前期对照组和中期对照组(<0.05),在黄体末期没有显著影响(>0.05)。E水平黄体末期对照组显著高于前期与中期对照组(<0.05),前期与中期对照组差异不显著(>0.05),3个试验组E水平没有显著差异(>0.05); 注射PGF2α后,前期和中期试验组E水平显著高于前期和中期对照组(<0.05),黄体末期没有影响(>0.05)。

A. 不同黄体期注射PGF2α和NS后0.5~3 h FSH质量浓度变化;B.不同黄体期注射PGF2α和NS后0.5~3 h LH质量浓度变化;C.不同黄体期注射PGF2α和NS后0.5~3 h PRL质量浓度变化;D.不同黄体期注射PGF2α和NS后0.5~3 h P4质量浓度变化;E.不同黄体期注射PGF2α和NS后0.5~3 h E2质量浓度变化。不同小写字母表示同时期不同时间点组内差异显著 (P<0.05),“*”表示同时期同时间点组间差异显著(P<0.05),无字母或“*”表示差异不显著 (P>0.05)。下图同A. FSH concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; B. LH concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; C. PRL concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; D. P4 concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; E. E2 concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases. Different letters mean significant differences at different times in the same phase within group (P<0.05), "*" means significant difference between groups at the same time(P<0.05), no letter or "*" means no significant difference (P>0.05). The same as below图1 黄体期注射PGF2α后0.5~3 h内母羊血清FSH、LH、PRL、P4和E2质量浓度变化Fig.1 Changes of FSH, LH, PRL, P4 and E2 concentrations of ewes in 0.5-3 h after injection of PGF2α during luteal phase

表1 黄体期注射PGF2α对母羊FSH、LH、PRL、P4和E2 3 h内整体水平的影响
2.2 在黄体期不同阶段注射PGF2α对母羊血清中TNF-α、IL-1β、IL-6和IFN-β水平的影响
由图2可知,各黄体时期对照组与试验组TNF-α、IL-1β、IL-6和IFN-β水平在注射后3 h内均未出现显著变化(>0.05)。黄体前期试验组TNF-α水平在注射PGF2α后2、3 h显著高于对照组(<0.05);前期试验组IL-6水平在PGF2α注射后3 h显著高于对照组(<0.05);其余各时期各时间点试验组和对照组血清TNF-α、IL-1β、IL-6和IFN-β水平均没有显著差异(>0.05)。
由表2可知,3个试验组和对照组TNF-α水平在整个黄体期没有显著变化(>0.05);注射PGF2α后,黄体前期试验组TNF-α水平显著高于对照组(<0.05),对黄体中、末期TNF-α水平影响不显著(>0.05)。IL-1β水平中期对照组显著高于前期对照组(<0.05),二者与末期对照组差异不显著(>0.05);3个试验组IL-1β水平没有显著差异(>0.05);注射PGF2α对各黄体时期IL-1β 水平没有显著性影响(>0.05)。3组试验组和对照组IL-6水平没有显著差异(>0.05);注射PGF2α后,黄体前期试验组IL-6水平显著高于对照组(<0.05),对黄体中、末期IL-6水平影响不显著(>0.05)。黄体末期对照组IFN-β水平显著高于前期对照组(<0.05),二者与中期对照组没有显著差异(>0.05),末期试验组IFN-β水平显著高于前期和中期试验组(<0.05),前期和中期试验组没有显著差异(>0.05);注射PGF2α对黄体各时期IFN-β水平没有显著影响(>0.05)。
3 讨 论
3.1 在黄体期不同阶段注射PGF2α对母羊生殖激素的影响
生殖激素是动物生殖信号系统的重要组成部分,可以反映和介导动物生理状态。促黄体素(LH)和促卵泡素(FSH)是由垂体前叶合成并分泌的促性腺激素,FSH作用于卵巢刺激卵泡生长发育和成熟,LH是主要的排卵激素和黄体功能调节因子。促性腺激素释放激素(GnRH)是LH和FSH的上游调控激素,由下丘脑脉冲式释放,与垂体促性腺细胞上的受体结合后促进促性腺激素释放,进而影响动物繁殖活动。本研究中,自然状态下母羊在黄体前期、中期血液中FSH、LH水平无显著差异,说明在黄体期卵巢上卵泡发育处于抑制状态,黄体分泌的高水平P抑制下丘脑和腺垂体活动,使GnRH分泌较少从而导致FSH、LH浓度较低;在黄体末期LH水平显著高于前期和中期,FSH水平无明显升高,可能是黄体末期P水平开始下降,对下丘脑和腺垂体的抑制作用减弱,而此时LH和FSH对GnRH的促分泌反应不同,LH较FSH反应快速,可能是因为卵巢分泌的抑制素对垂体FSH特异性的抑制作用导致FSH对GnRH的促分泌反应不如LH明显。在不同黄体时期注射PGF2α对母羊FSH与LH的影响不同,在黄体前期注射PGF2α后FSH的水平显著高于在中期和末期注射PGF2α,可能是因为黄体前期P处于低水平,PGF2α作用于黄体导致P水平进一步下降,对下丘脑的抑制作用减弱,从而促进FSH水平的上升,FSH水平升高对促进小、中卵泡发育有积极影响,而LH无明显变化,可能是因为黄体前期注射PGF2α后下丘脑以较低的脉冲频率释放GnRH作用于垂体,主要引起FSH分泌。LH在卵泡期分泌量较稳定,直到排卵前出现LH峰,对触发排卵意义重大,由于黄体期GnRH分泌频率和水平均较低,在发情周期中FSH水平升高一般早于LH,因此由本研究结果可知在黄体前期进行PGF2α处理可能更有利于卵泡发育与动物发情。
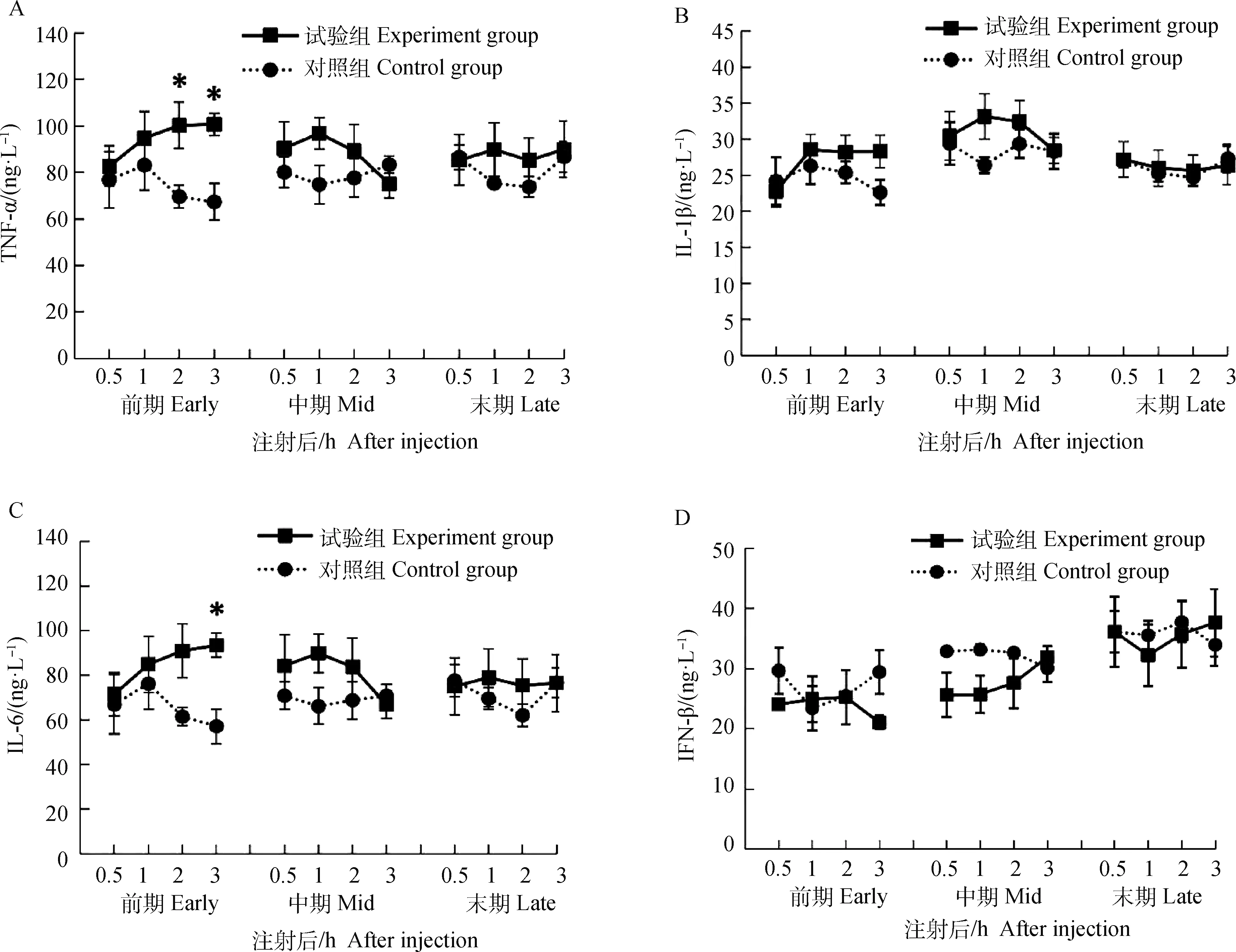
A.不同黄体期注射PGF2α和NS后0.5~3 h TNF-α质量浓度变化;B.不同黄体期注射PGF2α和NS后0.5~3 h IL-1β质量浓度变化;C.不同黄体期注射PGF2α和NS后0.5~3 h IL-6质量浓度变化;D.不同黄体期注射PGF2α和NS后0.5~3 h IFN-β质量浓度变化A. TNF-α concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; B. IL-1β concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; C. IL-6 concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases; D. IFN-β concentration changes at 0.5-3 h after injection of PGF2α and NS at different luteal phases图2 黄体期注射PGF2α后0.5~3 h内母羊血清TNF-α、IL-1β、IL-6和 IFN-β质量浓度变化Fig.2 Changes of TNF-α, IL-1β, IL-6 and IFN-β concentrations of ewes in 0.5-3 h after injection of PGF2α during luteal phase

表2 黄体期注射PGF2α对母羊TNF-α、IL-1β、IL-6和IFN-β 0.5~3 h整体水平的影响
催乳素(PRL)与母畜泌乳、卵泡发育等生殖活动息息相关,PRL分泌受到促乳素释放因子(PIF)和促乳素抑制因子(PRF)的共同调节。研究表明,高浓度的外周PRL会抑制母羊、小鼠等多个物种FSH、LH对GnRH的应答,阻碍排卵启动,低浓度PRL可促进卵泡生长发育。高水平PRL可以抑制大鼠卵巢增重,减少大鼠窦前卵泡直径与数量,说明高水平PRL可以直接和间接抑制卵泡发育和卵巢活动。以上研究表明,高浓度的PRL会抑制性腺活动,低浓度的PRL可促进性腺活动。本研究中,不同黄体阶段PRL水平不同,母羊PRL水平在黄体中、末期显著高于黄体前期,说明黄体前期是应用外源生殖激素调控动物性腺活动的最佳时期,黄体中期和末期高水平的PRL可能是黄体中、末期对PGF2α应答程度不如前期的原因。Pinaffi等利用氟尼辛葡甲胺(PGF2α抑制剂)处理黄体晚期至围排卵期的母牛,处理8 h内每间隔1 h检测1次PRL水平,结果显示处理后1~6 h对PRL无影响,在7 和8 h显著降低了PRL水平。Ginther等利用氟尼辛葡甲胺处理黄体中期的母马并在处理后10 h内每间隔1 h检测1次PRL水平,结果表明抑制PGF2α后1~3、9~10 h对PRL水平无显著影响,在4~8 h显著降低了PRL水平。说明PGF2α对哺乳动物PRL的影响存在处理时间的差异,而本研究在不同黄体时期注射PGF2α后3 h内对PRL均没有产生影响,而3 h后是否产生了影响还需进一步研究。
孕激素(P)主要由黄体细胞分泌,直接反映黄体功能,对妊娠的建立与维持十分关键。P在卵泡期处于低水平,排卵后受LH调节分泌量上升,对卵泡发育和母畜发情有重要调控作用,大剂量的P可负反馈抑制卵泡发育。研究表明,PGF2α可以显著降低血清P水平。温鑫认为,PGF2α对P分泌的抑制作用主要体现在对P代谢为20αDHP的促进作用。也有研究表明,PGF2α可以通过调控胆固醇至线粒体的运输途径抑制P合成。本试验中,母羊P水平在整个黄体期呈现先上升后下降的趋势,在黄体前期最低,黄体中期最高,与前人研究结果一致,符合P生理分泌规律。本研究中,在黄体前期、中期注射PGF2α显著降低了P水平,在黄体末期注射PGF2α对P水平无显著影响,说明PGF2α对黄体的溶解作用存在阶段差异性:在黄体前期、中期进行PGF2α处理可以有效促进黄体发生功能性退化,对诱导母羊发情有促进作用,而黄体处于末期时可能已经结束功能性退化,进入结构性退化阶段,对PGF2α不敏感,未能影响血清P水平,与王守岩等研究结果一致。并且,黄体前期血清P水平在注射PGF2α后始终呈现下降趋势,直至3 h时显著低于对照组,黄体中期血清P水平在注射PGF2α后1 h时显著低于对照组,并出现了由下降趋势至上升趋势的转折,推测黄体处于中期时功能较完全,外源PGF2α短暂处理不足以促使黄体持续退化,内源PGF2α的渐增阵发性释放需要时间满足黄体退化需要,因此在黄体前期进行单次PGF2α处理,短期内促黄体溶解效率强于黄体中期。
雌激素以E活性最高,主要由卵泡内膜细胞和颗粒细胞产生,分泌量随卵泡发育逐渐增加,在排卵前达到峰值,在调节卵泡发育、排卵等生殖过程中起主要调节作用。贾银海等认为,E水平与卵巢上卵泡的发育变化一致,具有周期性。E在发情周期中的分泌规律与P相反,本研究取得一致结论。本研究表明,在黄体前期、中期注射PGF2α后E水平显著升高,在黄体末期注射PGF2α后对E水平无显著影响,说明PGF2α可以诱导处于前期、中期的黄体组织退化,P水平降低,减弱对卵泡发育的抑制作用从而促进新一波卵泡发育。本试验中,黄体末期E水平最高,可能是因为黄体末期P水平下降,卵泡开始发育,但此阶段卵巢对PGF2α不敏感,此时进行PGF2α处理对卵巢活动作用较小。此外,在黄体前期注射PGF2α后母羊E水平始终呈现上升趋势,直至处理后3 h显著高于对照组,在黄体中期注射PGF2α后,E水平于1 h时由上升趋势转变为下降趋势,该结果进一步验证了外源PGF2α短暂处理不足以维持中期黄体持续退化的猜想,卵泡发育的抑制作用未能完全解除,说明在黄体前期进行PGF2α处理对诱导卵泡发育效果更好。
3.2 在黄体期不同阶段注射PGF2α对生殖调控相关细胞因子的影响
细胞因子是由多种组织产生的一类小分子物质,在细胞间传递信息发挥调控作用。肿瘤坏死因子(TNF-α)具有调控卵泡发育、黄体退化等生殖过程的作用,卵泡期卵泡液中的TNF-α主要来源于颗粒细胞和巨噬细胞,高浓度TNF-α可促进排卵前、后颗粒细胞和卵泡膜合成大量前列腺素,参与排卵的启动。研究表明,黄体组织中存在TNF-α,早期黄体中TNF-α数量较少,在黄体萎缩时TNF-α水平提高,与黄体内免疫细胞及其他细胞因子通过灭活和吞噬作用终止黄体寿命,同时TNF-α可以抑制LH促孕酮合成的关键酶,损害黄体期LH对黄体功能的支持作用,可能与黄体退化的启动有关。有研究证明,PGF2α可以诱导TNF-α表达,TNF-α进一步刺激PGF2α合成,启动PGF2α自动扩增过程,且TNF-α可以促进黄体对PGF2α的溶解敏感性提升,参与黄体溶解进程。本研究结果表明,黄体期注射PGF2α均可以上调母羊血清中TNF-α水平,说明PGF2α可通过提高TNF-α水平启动黄体溶解,与以上研究结果一致。在黄体前期注射PGF2α显著提高了TNF-α水平,注射PGF2α后2、3 h血清TNF-α水平显著高于对照组,在黄体中期、末期注射PGF2α后TNF-α水平上升但无显著差异,说明在黄体前期母羊对PGF2α处理更敏感,有利于黄体组织的退化。本研究中,不同黄体阶段母羊血清中TNF-α水平无显著差异,但在自然状态下随着黄体期的延长TNF-α水平呈上升趋势,与黄体组织退化规律一致。
白细胞介素(IL)可以从免疫角度以自分泌、旁分泌和远距内分泌影响动物生殖活动,其中IL-1β、IL-6与生殖关系最为密切。有研究结果指出,IL-1β可以促进子宫内膜PGF2α分泌,以发挥促进黄体溶解的作用。研究表明,IL-6可影响下丘脑-垂体-性腺轴和下丘脑-垂体-肾上腺轴的功能,IL-6还参与了黄体结构性退化,可以体外抑制黄体细胞类固醇激素分泌。本研究表明,在黄体期注射PGF2α后,IL-1β和IL-6水平出现了不同幅度的升高,尤其在黄体前期注射PGF2α后3 h血清中IL-6水平以及整体水平均显著升高,说明PGF2α可以通过提高IL-6和IL-1β水平启动黄体溶解。从数据上看,黄体前期PGF2α短期处理对诱导黄体退化效果较好,黄体末期效果不大。另有研究表明,在大鼠初级卵泡与次级卵泡的颗粒细胞、卵泡膜细胞均有IL-1β表达,并且随发育水平逐渐增加,IL-1β可以促进原始卵泡的活化与发育,说明IL-1β参与调控卵泡发育过程,PGF2α可以通过提高IL-1β水平间接促进卵泡募集与发育。本研究中,母羊IL-1β水平在黄体中期达到最高并在黄体末期下降,与王玮和沈鸿敏的研究结果一致,说明IL-1β参与了黄体功能的调控。
干扰素β(IFN-β)主要由成纤维细胞、白细胞分泌,是具有抗病毒、抗增殖功能的细胞因子。目前普遍认为,另一种干扰素—IFN-γ与生殖系统关系较为密切,报道IFN-β对繁殖活动影响的相关文献较少。有研究指出,IFN-β可以通过抑制促凋亡基因、表达,促使抗凋亡基因-2表达,降低脊髓损伤后细胞凋亡率。本试验中,自然状态下血清IFN-β水平随黄体时期推移逐渐提高,注射PGF2α后血清IFN-β水平出现不同程度的下调,推测IFN-β参与卵巢活动调控,对维持黄体功能有调控作用。在黄体期注射PGF2α可通过降低IFN-β水平促进黄体溶解,且在黄体前期IFN-β水平较低。
4 结 论
PGF2α对黄体的溶解作用具有明显的阶段差异性,黄体前期时,母羊对PGF2α的短期应答更强烈,且卵巢可以响应PGF2α为卵泡发育提供更佳的发育环境。
