培育品系中鸡青胫性状的遗传规律分析及分子基础初探
2022-07-07徐尚立穆继安李方博张瑾麒赵敏孟龚道清耿拓宇
赵 超,徐尚立,李 硕,穆继安,李方博,张瑾麒,赵敏孟,刘 龙,龚道清,耿拓宇
(扬州大学动物科学与技术学院,扬州 225009)
家禽的外观性状如冠形、羽色、胫色等属于质量性状,易于观测,是家禽品种的重要标志,在新品种(品系)培育过程中通常倍受关注。鸡的胫色就是一种深受消费者、生产者和育种者关注的重要性状,可分为主要受黑色素影响的深色胫和主要受叶黄素影响的浅色胫。由于鸡胫部存在表皮层和真皮层两种皮层,且各有不同色素的沉积,因此在肉眼观察时,胫色实际上是两种皮层色素产生的共同效果。
深色胫的形成主要是由黑色素沉积于胫部皮肤所致,因而黑色素合成的调控是关键。黑色素可分为真黑色素和褐黑色素。黑色素的合成起始于在酪氨酸酶(TYR)对L-酪氨酸的催化作用,产生的多巴经两个不同的途径分别生成真黑色素和褐黑色素,这取决于酪氨酸酶的活性,活性高时生成真黑色素,活性低时生成褐黑色素。以往的研究表明,深色胫的遗传方式有两种,即隐性伴性遗传和常染色体显性遗传。关于深色胫的隐性伴性遗传,早在二十世纪初,Bateson和Punnett就通过杂交试验证明了鸡的胫色性状存在伴性遗传方式,而1935年Knox提出,深色胫的抑制基因是显性伴性基因,即黄胫个体携带显性伴性基因,而深色胫个体携带隐性伴性基因。该显性伴性抑制基因已被命名为真皮黑色素抑制基因,浅色胫的基因型为Z-,深色胫为Z-。后来的研究表明,该基因为不完全显性伴性遗传,深色胫的表型变化不仅与基因有关,而且与(Fibromelanosis, 常染色体显性遗传并作用于真皮层)有关,对有上位效应。深色胫的表型是由和两个基因共同作用的结果。此外,Shinomiya等研究发现,突变对乌骨鸡乌肤性状的调控具有剂量效应。相对于真皮层的黑色素沉积由和基因控制,黑色素在表皮层的沉积则受到黑色素扩散基因(Extension)的调控,属于常染色体显性遗传。来自基因连锁分析等方面的研究证据,已将该基因位点定位于鸡11号染色体上的黑素皮质激素受体1(melanocortin 1 receptor,1)基因。
MC1R拥有7个跨膜功能结构域(transmembrane domain,TM),作为最小的G蛋白耦合受体,它的全长只有945 bp,无内含子,可编码314个氨基酸,有超过60%的序列与哺乳动物同源。MC1R与其由垂体分泌的配体α-MSH结合,所形成的复合物可将无活性的二磷酸鸟苷(GDP)转变为有活性的三磷酸鸟苷(GTP),以此激活膜上的腺苷酸环化酶(adenylate cyclase,AC)系统,并经Mg作用催化将ATP转化为cAMP,后者激活酪氨酸酶,参与黑色素生成。遗传学、生物化学和药理学的证据均表明,来自MC1R的信号对TYR活性的调控是黑色素生成的重要因素。
由于黑羽也是黑色素沉积于羽毛所致,因此1基因不仅决定表皮层深色胫的形成,而且决定黑色羽毛的形成。2003年Kerje等通过杂交试验推测1基因中错义突变E92K和M71T是形成红色原鸡和白来航鸡出现黑色羽毛的主要突变位点;Guo等通过对5个不同群体4种不同羽色鸡的1基因进行生物信息学方法分析,发现c.274G>A促进真黑素沉积,而c.637T>C减少真黑素沉积;胡卓成等推测,在白绒乌骨鸡1基因中的错义突变H215P可能是抑制黑色素在羽毛沉积的原因;席苏望等发现,在江西地方鸡的1基因突变中,c.212T>C、c.274G>A和c.644A>C与黑色羽毛的形成相关联。这些研究均支持1是影响表皮层黑色素沉积的重要基因。
本研究针对培育品系W系中的青胫性状,通过正、反交杂交试验,以明晰W系青胫性状的遗传规律,同时通过胫部皮肤的转录组测序筛查差异表达基因与富集通路,从而为W系青胫性状的选择提供指导,以及为阐明青胫性状形成的分子机制奠定基础。
1 材料与方法
1.1 试验动物
本研究为探明W品系培育过程中青胫性状的遗传规律,首先以培育品系中黑羽青胫成年公鸡与洛岛红黄羽黄胫成年母鸡为正交、黑羽青胫成年母鸡与洛岛红黄羽黄胫成年公鸡作为反交(公、母鸡配比为1∶ 5)。在杂交试验开始前配种母鸡停止输精3周,以确保正式输精前所产蛋均为无精蛋。采用人工授精方式,收集种蛋两批,2周一批,剔除畸形蛋、破损蛋后入孵,出雏时进行系谱记录,记录性别、胫色和羽色。在雌性雏鸡中随机选取青胫和黄胫鸡各10只,处死后采集胫部皮肤样,快速放于液氮中,并转至-70 ℃冰箱中保存待用。本研究中的动物试验方案符合动物福利与使用的相关准则,并获得扬州大学动物福利与使用委员会的批准。
1.2 转录组测序
以青胫皮肤样为处理组,黄胫皮肤样为对照组(=4)。皮肤样用干冰转运至北京诺禾致源科技股份有限公司,并由该公司完成RNA-seq测序分析。测序分析的基本流程如下:使用Illumina 的NEBNextUltraRNA Library Prep Kit试剂盒建库,在M-MuLV 逆转录酶体系和DNA polymerase I 体系下合成双链cDNA,然后经过AMPure XP beads筛选后扩增和再纯化,建立文库,并基于Illumina测序平台对文库边合成边测序;接着对原始数据进行过滤(主要包括剔除带接头的reads、剔除含N(N表示无法确定碱基信息)的reads、剔除低质量的reads(Qphred ≤20的碱基数占整个read长度的50%以上的reads);将过滤后得到的高质量序列经HISAT2 v2.0.5比对到参考基因组上;利用DESeq2 软件(1.16.1)进行差异表达分析以及利用ClusterProfiler R 软件实现差异表达基因的GO富集分析和KEGG分析等。差异表达基因(differentially expressed genes, DEGs)的筛选标准采用宽松(|log(Fold Change)|>0,adj<0.05)与严格(|log(Fold Change)|>1,adj<0.05)两种标准。
1.3 荧光定量PCR分析
随机选取8个差异表达基因,利用NCBI网站上在线工具Primer-BLAST(www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物(表1)。引物由苏州金唯智生物科技有限公司合成。RNA提取采用诺唯赞生物有限公司生产的RNA-easy Isolation Reagent (Vazyme #R701)试剂盒,cDNA合成采用HiScriptIII RT SuperMix for qPCR (+gDNA wiper) (Vazyme#R323)试剂盒,使用Vazyme AceQ qPCR SYBR Green Master Mix试剂盒进行荧光定量PCR分析。具体操作按试剂盒说明书进行。荧光定量PCR采用10 μL体系,包括Mix 5 μL,上、下游引物各0.2 μL,cDNA 1 μL,水3.6 μL;反应程序为95 ℃ 5 min,40个循环(95 ℃ 10 s,60 ℃ 30 s)。内参基因为。以2法计算各目的基因的相对表达量。

表1 荧光定量PCR引物的序列
1.4 统计分析
用EXCEL2016软件整理数据,用IBM SPSS Statistics 26对青、黄胫的分离比例进行卡方检验,定量数据用检验统计分析,<0.05设定为统计显著性的标准。
2 结 果
2.1 青胫性状的遗传规律分析
为探明W系中青胫性状的遗传规律,本研究利用W系中黑羽青胫成年公、母鸡与洛岛红黄羽黄胫成年公、母鸡进行正、反杂交。正交共获得344只雏鸡,其中公鸡青、黄胫分别为172和20只,母鸡青、黄胫分别为121和31只,合计正交后代中青胫293只,黄胫51只(表2)。反交共获得329只雏鸡,其中公鸡青、黄胫分别为156和29只,母鸡青、黄胫分别为100和44只,合计反交后代中青胫256只,黄胫73只(表2)。正、反杂交合计共获得673只雏鸡,其中公鸡青、黄胫分别为328和49只,母鸡青、黄胫分别为221和75只,合计青胫549只,黄胫124只(表3)。统计分析表明,无论是正交、反交还是所有杂交,后代中青胫个体的数量均显著高于黄胫个体的数量,这提示青胫性状相对于黄胫性状为显性。再者,无论是正交还是反交,后代公、母性别中均出现青、黄胫两种表型,并不表现出伴性遗传的现象,因此W系的青胫性状是常染色体显性遗传。这里值得一提的是,根据胫色与羽色的记录,结果发现黑羽与青胫完全关联,黄羽与黄胫完全关联,提示相对于黄羽黄胫表型,W系中的黑羽与青胫性状可能受同一个基因所控制。
由于W系中的青胫性状是常染色体显性遗传方式,因此可以不分性别地将正交和反交的后代按胫色类型合并。为探明本研究中青、黄胫性状的控制基因数量,则将正交和反交后代中没有胫色分离的杂交组合剔除,这样在存在胫色分离的杂交组合后代中,共有238只雏鸡,其中青胫雏鸡121只,黄胫雏鸡117只(表4)。根据卡方检验可知,青胫与黄胫的比值与分离比1∶1无显著差异(=0.846),提示青、黄胫性状受一对等位基因控制。
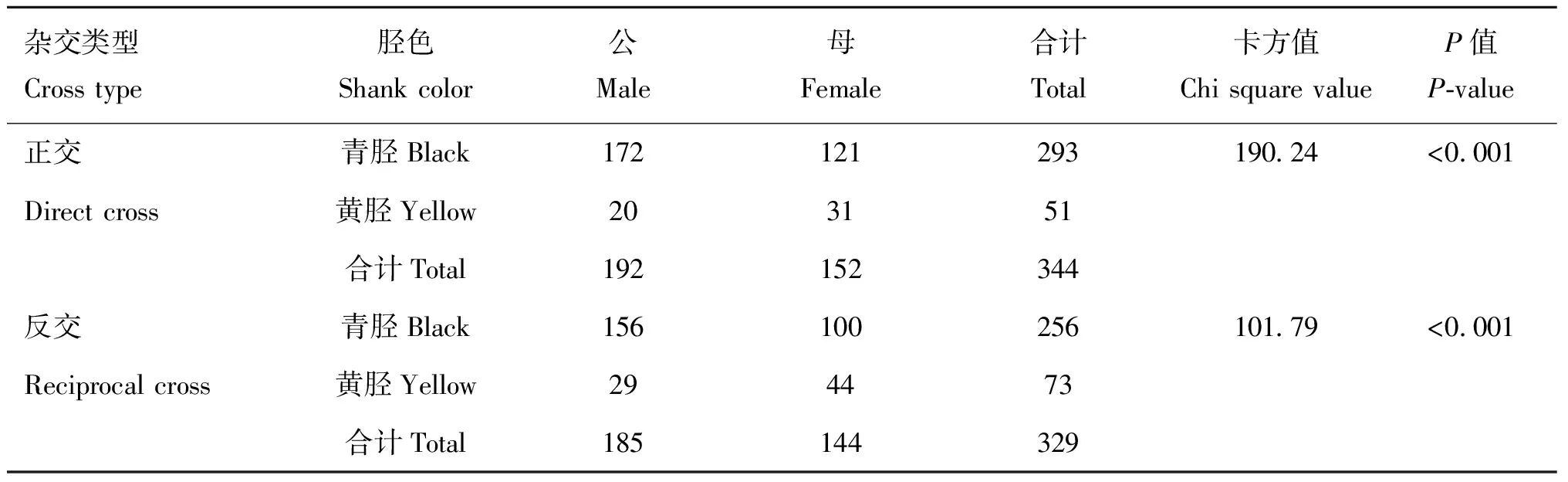
表2 正交和反交后代的胫色统计

表3 所有杂交后代的胫色统计

表4 所有胫色分离杂交组合的后代胫色统计
2.2 转录组学分析
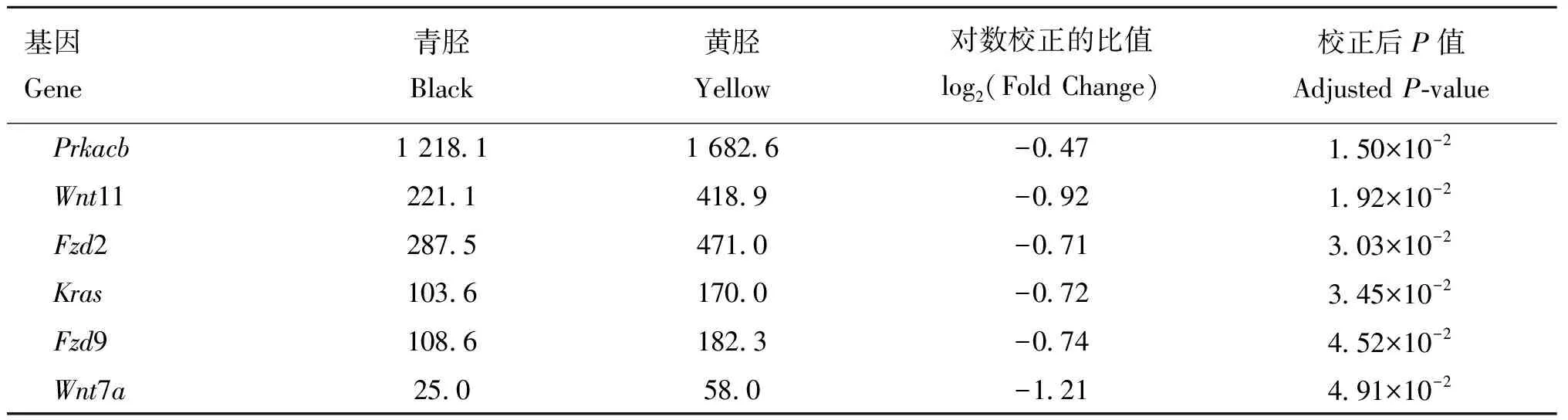
为探明青胫性状形成的分子机制,本研究对雏鸡青、黄胫皮肤的转录组进行了测序分析。测序数据显示,两组样品的Raw reads平均值分别为43 754 542.5和45 229 562,过滤后Clean reads平均值分别为41 832 926.5和44 216 740,平均Q30值分别为93.90%和92.51%(表5),达到下一阶段分析的标准。在此基础上,通过比较基因在青、黄胫皮肤中的表达值,按照宽松筛选标准共筛选到5 597个差异表达基因,其中相对于黄胫,青胫中有2 660个差异基因表达上调,2 937个表达下调(图1),而按照严格筛选标准共筛选到2 785个差异表达基因,其中相对于黄胫,青胫中有1 075个差异基因表达上调,1 710个表达下调(因篇幅所限,具体见OSID开放科学资料附表1)。在宽松筛选标准下,参与黑色素合成的差异表达基因列于表6中。值得注意的是,与黑色素合成有直接关系的几个基因如1、、1在青胫皮肤中的表达量与
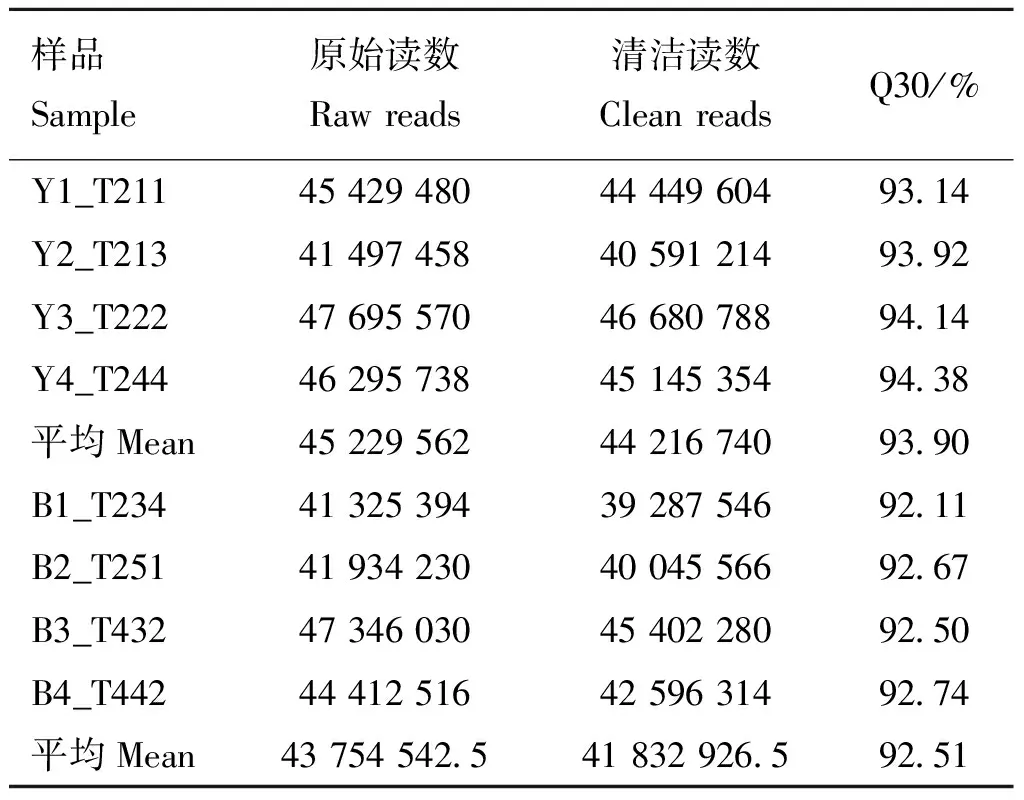
表5 测序数据的统计表
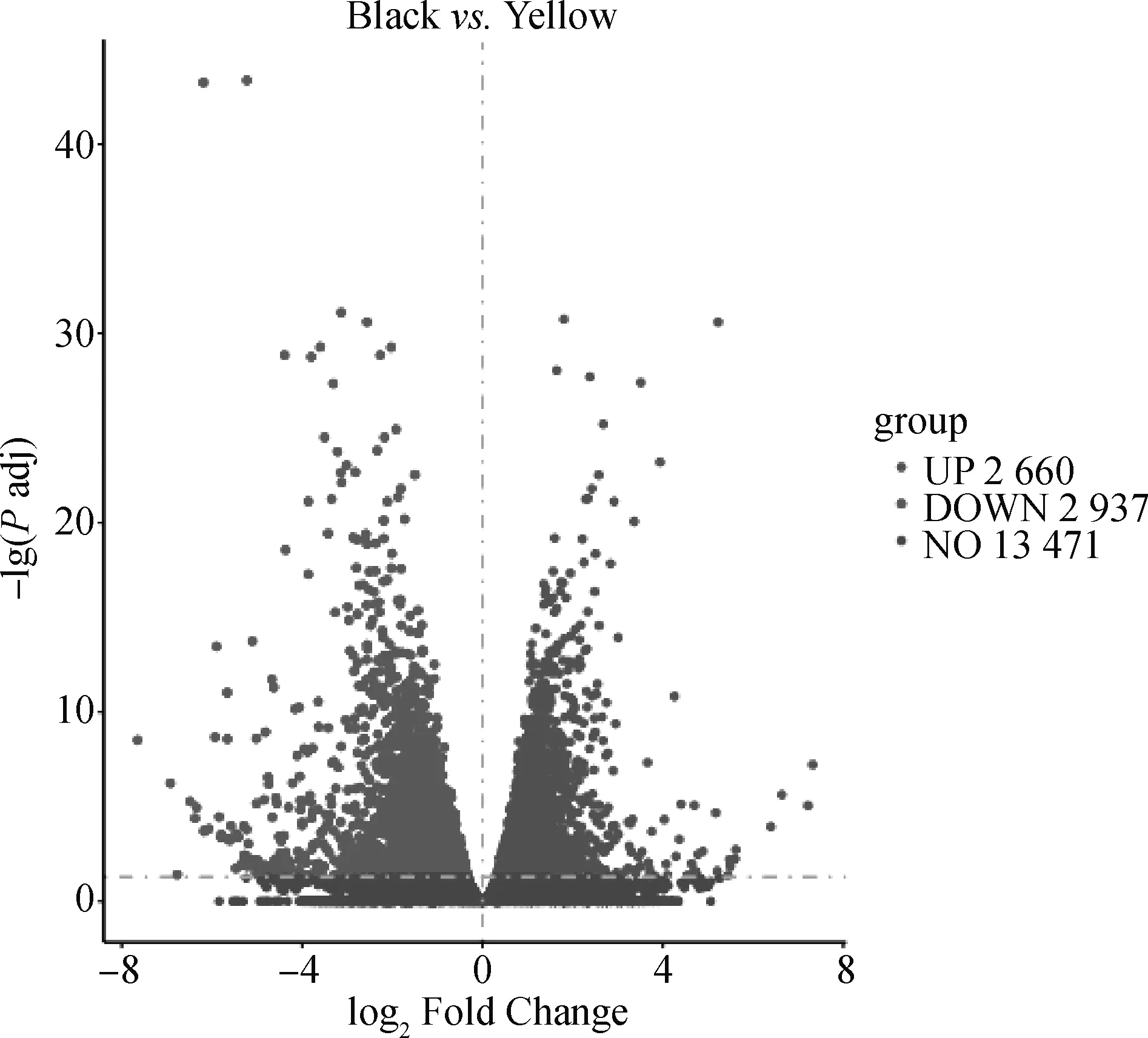
横轴为log2 (Fold Change),纵轴为-lg(Padj)。火山口的右侧为上调的差异表达基因(DEG),火山口的左侧为下调的DEG。Padj表示校正后的P值The horizontal axis denotes log2 (fold change) and the vertical axis denotes -lg(Padj). The right side of the crater denotes the upregulated expression of the differentially expressed gene (DEG), and the left side of the crater denotes the downregulated expression of the DEGs. Padj represents the adjusted P value图1 DEGs火山图Fig.1 Volcano map of differentially expressed genes
黄胫皮肤中的表达量存在极显著差异。此外,在筛查到的差异表达基因中还发现一些以往报道尚未提及参与胫色形成的上游调控基因,如家族基因和家族基因,它们在青、黄胫皮肤中的表达量也存在显著差异(adj <0.05,表6)。
利用差异表达基因进行GO和KEGG通路富集分析,按宽松筛选标准发现46条GO term和15个KEGG pathway显著富集差异表达基因(因篇幅所限,具体见OSID开放科学资料附表2,附表3),按严格筛选标准发现41条GO term和21个KEGG pathway显著富集差异表达基因(因篇幅所限,具体见OSID开放科学资料附表4、附表5)。按宽松筛选标准筛选的显著富集GO term中,有26条GO term注释到生物学过程,10条注释到细胞组分,10条注释到分子功能。在这三大类别中分别选取富集程度最高的10个列于图2,如生物学过程中的RNA加工(RNA processing)、细胞表面受体信号通路(cell surface receptor signaling pathway)、蛋白质磷酸化(protein phosphorylation)、多细胞生物发育(multicellular organism development)等,细胞组分中的细胞外基质(extracellular matrix)、多聚细胞骨架纤维(polymeric cytoskeletal fiber)、中间丝(intermediate filament)、中间丝细胞骨架(intermediate filament cytoskeleton)等,分子功能中的磷酸转移酶活性(phosphotransferase activity)、醇基受体(alcohol group as acceptor),蛋白质丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)、激酶活性(kinase activity)、蛋白酪氨酸激酶活性(protein tyrosine kinase activity)等。总体上,这些高度富集的GO term主要与细胞外基质与受体信号、信号传导、细胞骨架与迁移有关。按宽松筛选标准筛选的显著富集KEGG pathway中,富集程度最高的20条通路被列于图3,包括Melanogenesis(黑色素生成)、Adherens junction(黏附连接)、Sphingolipid metabolism(鞘脂代谢)、Wnt signaling pathway(Wnt信号通路)、mTOR signaling pathway(mTOR信号通路)、MAPK signaling pathway (MAPK信号通路)、ErbB signaling pathway(ErbB信号通路)等。按严格筛选标准获得的结果与上述类似。总体上,这些高度富集的KEGG pathway除了与黑色素生成通路有关外,还与细胞外基质与受体信号、信号传导、细胞黏附、细胞骨架与迁移、鞘脂与糖脂代谢等通路有关。

表6 富集于黑色素生成通路上的差异表达基因
(转下页 Carried forward)

图中横坐标为GO Term,纵坐标为GO Term富集显著性水平,用-lg(P adj)表示。从左往右,第1~10条、第11~20条和第21~30条分别为注释到生物学过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular function,MF)上富集程度最高的GO term。Padj表示校正后的P值the horizontal axis denotes GO term, and the vertical axis denotes the enrichment significance level of GO term, which is represented by -lg(P adj). From left to right, columns 1-10, columns 11-20 and columns 21-30 show the highest enriched GO terms in the categories of biological process (BP), cell component (CC) and molecular function (MF), respectively. Padj represents the adjusted P value图2 DEGs的GO富集分析柱状图Fig.2 The histogram for GO enrichment analysis of DEGs
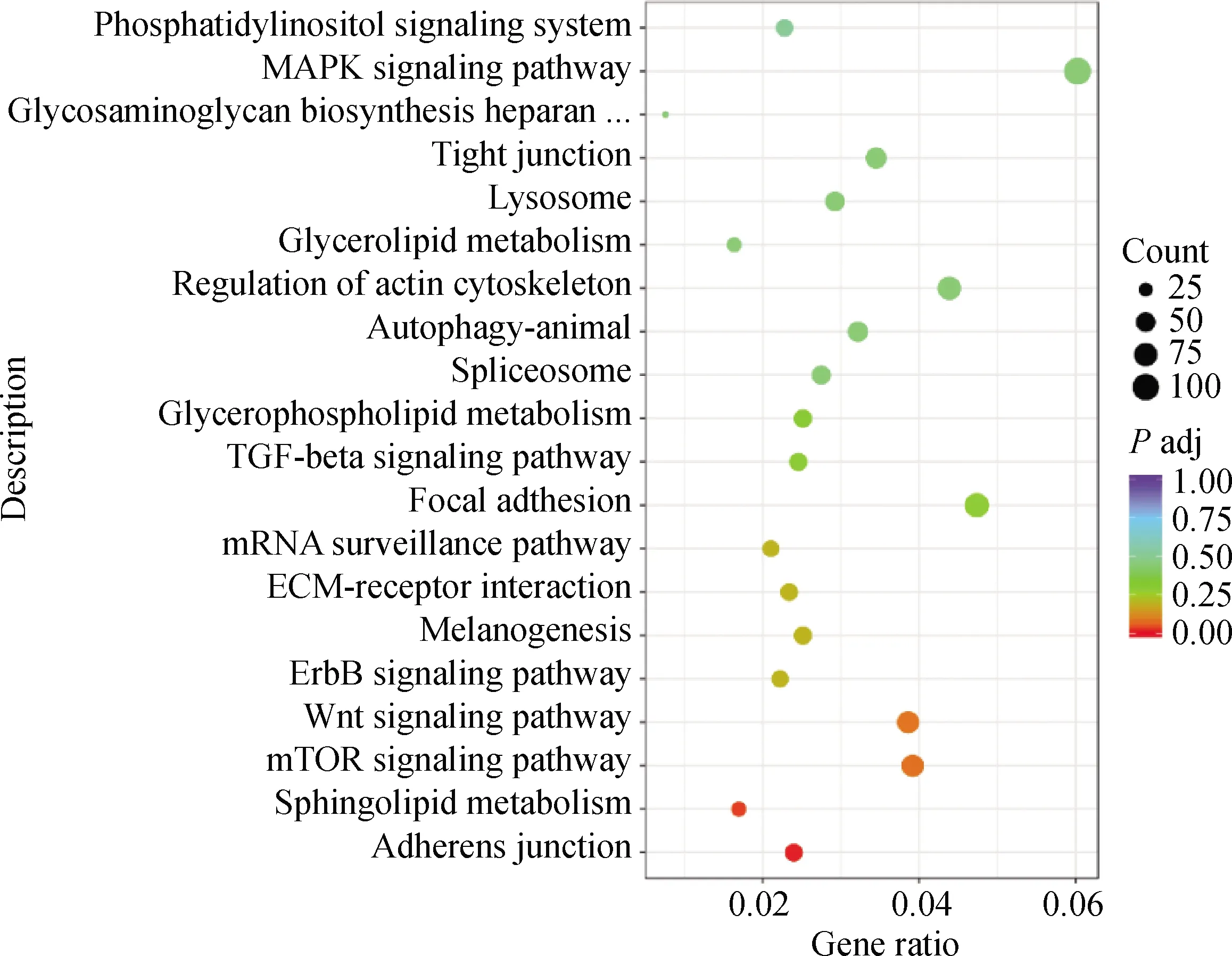
图中横坐标为注释到KEGG通路上的差异基因数与差异基因总数的比值,纵坐标为KEGG通路。图中圆点的颜色代表差异表达基因在该通路上富集程度的统计显著性,颜色由蓝色向红色变化表示统计上该通路的富集程度越高;而圆点的大小代表差异表达基因的数量,圆点越大表示该富集通路上的差异表达基因的数量越多The horizontal axis denotes the ratio of the number of the differentially expressed genes (DEGs) in the specified KEGG pathway to the total number of DEGs, and the vertical axis denotes the KEGG pathway. The colors of dots represent the statistical significance of the enrichment degree of DEGs in the specified pathway, and the change of color from blue to red indicates that the enrichment degree of the pathway become higher statistically. The sizes of the dots represent the number of DEGs. The larger the dot, the more DEGs in the KEGG pathway图3 DEGs的KEGG通路富集分析散点图Fig.3 Dotted plot for KEGG pathway enrichment analysis of DEGs
2.3 定量PCR对差异表达基因的验证
随机选取8个差异表达基因进行荧光定量PCR验证。如图4所示,相对于黄胫组,1r、、3、2和6基因在青胫皮肤中表达显著升高,而5、4和1基因在青胫皮肤中表达降低,但4和1基因表达水平在青、黄胫组间的差异未达到统计上的显著水平。总体而言,定量PCR的测定结果表明,转录组测序分析结果是可靠的。
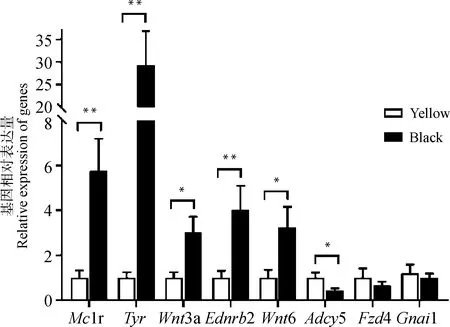
胫部皮肤中各基因的相对表达量以黄胫组该基因表达量的倍数变化表示,n=6,*表示P<0.05,**表示P<0.01The relative expression of each gene is expressed as fold change over the expression of a given gene in yellow group, n=6, * denotes P<0.05, ** denotes P<0.01图4 定量PCR对DEGs的验证Fig.4 Validation of differentially expressed genes by quantitative PCR
3 讨 论
胫色一直是鸡育种中的一个重要外观性状,而青胫性状则长期以来受到消费者的青睐。尽管有关青胫性状的遗传方式和控制基因的定位已取得很大的进展,但仍有一些问题有待深入研究加以解决,如:对青胫性状控制基因的确定尚缺少充足的证据,控制基因通过何种机制参与青胫性状的形成。本研究首先通过正反杂交明确了培育品系W系青胫性状的遗传方式为常染色体显性遗传方式,青、黄胫性状受一对等位基因控制,并依据这些发现和前人的研究成果推测该控制基因为1基因。其次,本研究通过比较青、黄胫皮肤的转录组,发现1基因在青胫皮肤中的表达量远高于黄胫皮肤中的表达量,进一步支持1基因是W系鸡青胫性状的控制基因。此外,通过转录组分析,不仅发现黑色素合成通路中的基因如、1参与青胫性状的形成,而且还筛查到一些以往报道尚未提及的上游基因如和家族基因可能受1基因的影响而参与青胫性状的形成,这为进一步阐明青胫性状形成的分子机制奠定了良好的基础。
以往的研究表明,青胫性状存在常染色体显性遗传和隐性伴性遗传。前者受位点(1基因)控制,而后者受基因控制。在本研究的正反杂交试验中,青胫和黄胫两种胫色均出现在正交和反交后代的同一性别中,且后代中青胫个体数远多于黄胫个体数,这种胫色的遗传方式均与受位点控制的常染色体显性遗传方式一致。Knox曾围绕控制黑羽性状的位点对胫色性状的影响做过较为系统的研究,结果表明青胫性状的遗传属于常染色体遗传,且受位点上的基因控制。迄今为止,位点上共发现8个等位基因,依显性程度排序为、、、、、、和,且对、为不完全显性。田明和孙桂荣等的研究结果也表明,即使存在基因,基因型为EE的个体仍然是黑色胫,不过研究也发现位点非纯合(E-)时,基因型为E-ZW的胫色表现为白色和黑色之间的中间色,这可能是深色表皮层和浅色真皮层共同产生的视觉效果。在本研究中,剔除后代没有胫色分离的杂交组合(青胫亲本的基因型为EE),而对有分离的杂交组合(青胫亲本的基因型为Ee)的后代进行胫色统计,可以发现青、黄胫的个体数之比与分离比1∶1非常接近,表明W系的青胫与洛岛红的黄胫可能受到位点上的一对等位基因控制。
以往的研究将1基因定位到控制鸡羽色性状的位点上,不过这种定位主要依赖于连锁分析。本研究也发现杂交后代的羽色与胫色一同分离,即后代中只有黑胫黑羽和黄胫黄羽的个体,而没有黑胫黄羽和黄胫黑羽的个体,这进一步说明W系中的黑胫性状也受位点上的1基因控制。虽然关于1基因的序列突变与羽色变化的关联分析研究较多,但关于该基因参与青胫性状形成的机制研究却较少。1作为一种定位于细胞膜上的受体,能够与其配体α-MSH结合,可以激活一系列信号传导分子如、,从而最终作用于、1等基因,影响黑色素的合成。的确,转录组分析不仅发现1在青、黄胫皮肤中的表达差异,也发现、的家族基因及、1基因在青、黄胫皮肤中的表达存在明显差异,这些结果均支持W系的青胫性状受1控制的观点。再者,差异表达基因的GO term和KEGG pathway富集分析均表明青胫的形成涉及细胞外基质与受体信号、信号传导、细胞骨架与迁移、细胞黏附、鞘脂与糖脂代谢。1和其配体α-MSH的结合就涉及细胞外基质与受体信号、信号传导,而黑色素的合成与转运则涉及黑色素细胞和黑素小体的迁移,因此和细胞骨架与迁移有关。综上所述,1及其所在通路上的基因参与并控制W系中青胫性状的形成。
在本研究中,青、黄胫皮肤的转录组分析还揭示了一些在以往报道中尚未提及参与胫色形成的基因如16、3、10。这些基因主要在本研究所揭示的信号通路(Wingless/Integrated Signaling Pathway)上。以往研究表明,该通路上某些基因的突变与黑色素瘤的发生密切关系。还有研究发现,当神经嵴细胞缺失1或3基因时,这些细胞就不能分化为黑素细胞,而当恢复3基因后,基因的表达得以维持,这些细胞又开始分化为黑素细胞。因此,信号通路也参与黑色素的合成,与本研究转录组分析时青、黄胫间差异表达基因显著富集的信号通路一致。至于1的信号通路如何影响信号通路上的基因表达,仍有待深入研究。
4 结 论
本研究明确了培育品系W系的青胫性状为常染色体显性遗传,为该性状受1基因控制提供了有力证据,并发现了一些以往报道尚未提及参与青胫性状形成的基因与通路。这些发现将有助于鸡品种(系)培育过程中青胫性状的选择与青胫性状形成的分子机制的阐明。
