LED绿光照明对坝上长尾鸡胚胎期小肠及法氏囊发育的影响
2022-07-06赵惠媛郝文文耿立英张传生李祥龙
赵惠媛,郝文文,耿立英,张传生,李祥龙
(河北科技师范学院动物科技学院,河北省特色动物种质资源挖掘与创新重点实验室,河北 秦皇岛,066004)
禽类作为一种色敏性动物,对于不同波长光的辨色力极强,继而影响其生长发育、生产性能、免疫功能等[1]。郝文文等[2]研究发现,孵化期使用适宜绿光照明可以促进鸡胚肌纤维发育;谭子超等[3]研究发现,以绿光LED为光源间歇照明可提高肉鸡生长性能,毛鸡出栏的经济效益最高;谢电等[4]在研究中使用15 lx的绿光照明生长早期(0~6 d)雏鸡,通过对小肠各段绒毛高度、粘膜厚度及杯状细胞数量等指标进行测定,发现该条件下绿光照可在一定程度上改善肉鸡小肠黏膜结构,继而提高小肠消化吸收能力,促进生长发育;李然等[5]研究发现,蓝光在产蛋高峰期及后期可显著提高海兰褐蛋鸡脾脏细胞免疫功能;段龙等[6]研究发现,间歇光照可显著提高肉仔鸡(14~42 d)的脾脏和法氏囊指数。除了作为一种消化器官,小肠还具有免疫功能,其粘膜层中的淋巴细胞可对肠道中的病原体发生相应的免疫反应,属于肠道相关淋巴组织中的重要成员[7]。作为肠道免疫系统的重要组成部分,肠道相关淋巴组织还包括法氏囊、肠道淋巴结、盲肠扁桃体、幽门扁桃体[8]等免疫器官,其中法氏囊是禽类所特有的中枢免疫器官,是B淋巴细胞发育分化的场所,多能干细胞于鸡胚孵化发育的第8~18天来到法氏囊[9],在激素作用下形成具有免疫活性的B淋巴细胞,以淋巴滤泡的形式存在。禽类作为一种经济型动物,提高其消化能力、增强免疫功能,可显著改善其生产性能,继而带来良好的经济效益。坝上长尾鸡生存于坝上高寒环境中的特殊性,造就了其抗寒力强、耐粗饲的优良特性[10],然而其生产性能较低、产肉率低限制了其在养殖领域中的发展,在孵化阶段鸡消化系统的早期发育对于实现出壳后雏鸡的体质量增长发育尤为关键,而与之相关的肠道相关淋巴组织作为机体免疫的第一道屏障,可有效抵御病原体的侵袭,增强机体免疫力。因此,笔者以坝上长尾鸡为研究对象,研究不同强度的LED绿光照明对孵化期小肠及法氏囊发育的影响,为在生产实践中合理改良坝上长尾鸡种蛋孵化条件提供一定的科学依据。
1 材料与方法
1.1 试验材料
试验所需120枚质量相近的坝上长尾鸡种蛋购自张家口市绿色田园禽业科技有限公司,孵化前对其进行消毒、编号、称质量。
试验所需的甲醛溶液、无水乙醇、二甲苯、苏木素染液、伊红染液、盐酸、石蜡及中性树脂等均购自石家庄丰悦科技有限公司。
奥林巴斯BX-40倒置显微镜购自OLYMPUS公司(中国)。NLF-320型微电脑全自动孵化器购自山东农科孵化设备有限公司。
1.2 试验方法
1.2.1试验设计 选取重量相近的坝上长尾鸡种蛋120枚,随机分成4组,分别为弱光组(30~80 lx绿光),中光组(90~140 lx绿光),强光组(150~200 lx绿光),黑暗组。孵化条件:1~6 d温度38.0 ℃,湿度60%;7~18 d温度37.8 ℃,湿度55%;19~20 d温度37.2 ℃,湿度65%。各光照组种蛋分别于孵化的10~18 d给予12 h光照-12 h黑暗的照明,光源波长为525 nm±10 nm。各组分别于16,18,20日胚龄时收集6枚种蛋,二氧化碳法处死鸡胚后,取小肠各段(十二指肠、空肠、回肠)和法氏囊,置于1.44 mol/L甲醛中固定24 h,以备待测试验。
1.2.2石蜡切片 本试验对不同组别的鸡胚十二指肠、空肠、回肠及法氏囊进行了组织石蜡切片并染色,以观察不同组别鸡胚各器官的显微结构。石蜡切片步骤如下:
①分别将各组不同胚龄的鸡胚十二指肠、空肠、回肠及法氏囊用1.44 mol/L甲醛溶液固定24 h。
②梯度脱水(顺序及时间为50%(体积分数,下同)的乙醇1 h,70%乙醇1 h,85%乙醇1 h,95%乙醇40 min共2次,无水乙醇30 min共2次)。
③二甲苯透明(每小时更换1次二甲苯,共3次)。
④浸蜡与包埋:将透明化的组织浸入60 ℃的石蜡中进行浸蜡处理,共3次,每次1 h,随后将组织包埋于包埋盒中。
⑤塑型与切片:包埋好的石蜡块塑型成棱台状固定于木托上,即可用切片机进行组织切片,厚度为5 μm。
⑥展片与粘片:切好后的组织薄片需在42 ℃水浴锅中进行展片,随后捞至涂有蛋白甘油的载玻片上,于37 ℃恒温箱中过夜烘干后即可进行H.E染色。
1.2.3H.E染色 H.E染色法又称之为苏木素—伊红染色法,染色步骤如下:
①首先将石蜡切片利用二甲苯进行脱蜡处理,共2次,每次10 min。
②将切片依次在梯度浓度下降的酒精中浸泡处理(顺序为无水乙醇2 min,无水乙醇2 min,95%乙醇2 min,80%乙醇2 min,70%乙醇2 min),最后用蒸馏水洗2 min。
③将切片放入苏木素染液中浸泡3 min。
④将切片放入1%(体积分数)盐酸酒精中酚化2下,自来水冲洗3 min。
⑤将切片放入淡氨水中返蓝20 s,自来水冲洗5 min,直至显微镜下细胞核呈现清晰的蓝色。
⑥将切片放入伊红染液中染色3 min。
⑦切片依次放入70%乙醇30 s,80%乙醇30 s,90%乙醇30 s,95%乙醇5 min共2次,无水乙醇5 min共2次进行脱水处理。
⑧切片放入二甲苯中进行透明处理,每次10 min,共2次。
⑨擦片后利用中性树脂封片,随后镜检即可。
1.2.4显微镜观察及数据采集 利用奥林巴斯BX-40倒置显微镜进行组织切片观察,并利用显微镜成像系统拍摄照片进行数据采集。分别测量各组鸡胚E16,E18和E20时十二指肠、空肠及回肠绒毛高度及肌层厚度,绒毛高度以每张切片中最长的10根绒毛长度平均值为测定数值,肌层厚度以每张切片最厚肌层位置厚度为测定数值。分别测量各组鸡胚E16,E18,E20时法氏囊滤泡面积,以每张切片中最大的10个滤泡面积平均值作为测定数值。
1.2.5数据处理与统计分析 本次试验采用SPSS 20.0统计学软件进行单因素方差分析,利用LSD检验方法进行多重比较,数据结果用“平均值±标准差”表示,P<0.05表示存在显著差异。
2 结果与分析
2.1 不同光照度LED绿光照明对坝上长尾鸡胚胎期小肠绒毛和胚层发育的影响
观察各组鸡胚十二指肠段组织切片(图1),并对其绒毛高度和肌层厚度进行测量。结果表明:在16胚龄时,弱光组绒毛高度显著高于黑暗组(P<0.05),而中光组和强光组与黑暗组无显著性差异(P>0.05)(表1);中光组肌层厚度显著高于弱光组和强光组(P<0.05),黑暗组与该3组无显著性差异(P>0.05)。在18胚龄,4组间绒毛高度均存在显著性差异(P<0.05),其中中光组最高,强光组最低;中光组肌层厚度显著性高于黑暗组(P<0.05),其余各组间无显著性差异(P>0.05)。在20胚龄,弱光组绒毛高度显著高于其余3组(P<0.05),其中中光组和强光组绒毛高度显著性低于黑暗组(P<0.05);中光组肌层厚度显著性高于弱光组(P<0.05),其余各组间无显著性差异(P>0.05)。

注:E16,E18,E20分别代表16胚龄,18胚龄,20胚龄。下同。图1 不同光照度LED绿光孵化下坝上长尾鸡胚胎期十二指肠显微结构
观察各组鸡胚空肠段组织切片(图2),并对其绒毛高度和肌层厚度进行测量。结果表明:在16胚龄,弱光组绒毛高度显著性高于中光组和黑暗组(P<0.05),强光组绒毛高度显著性低于中光组和黑暗组(P<0.05)(表1);试验各组间肌层厚度均存在显著性差异(P<0.05),其中弱光组最高,黑暗组最低。在18胚龄,中光组和黑暗组绒毛高度显著性高于弱光组和强光组(P<0.05),中光组和黑暗组之间无显著差异(P>0.05);而弱光组和中光组肌层厚度显著性高黑暗组(P<0.05),强光组与黑暗组之间无显著差异(P>0.05)。在20胚龄,弱光组绒毛高度显著性高于其它3组(P<0.05),其余各组间无显著性差异(P>0.05);强光组肌层厚度显著性高于弱光组和中光组(P<0.05),黑暗组肌层厚度最低,显著性低于另外3组。
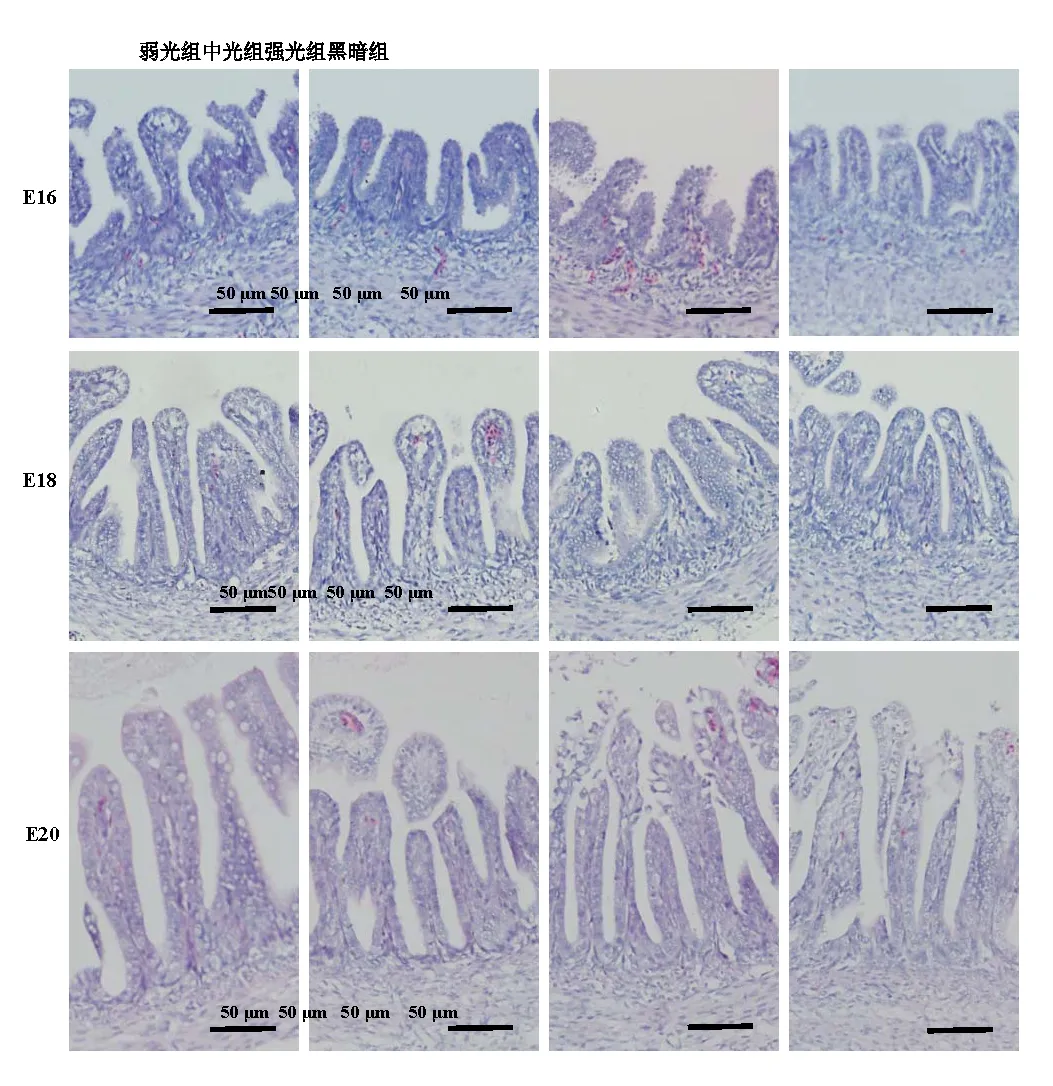
图2 不同光照度LED绿光孵化下坝上长尾鸡胚胎期空肠显微结构
观察各组鸡胚回肠段组织切片(图3),并对其绒毛高度和肌层厚度进行测量。结果表明:在16胚龄时,弱光组和中光组绒毛高度显著性高于黑暗组(P<0.05),强光组与黑暗组间无显著性差异(P>0.05)(表1);肌层厚度中光组最高,弱光组次之,均显著性高于黑暗组(P<0.05),强光组与黑暗组间无显著性差异(P>0.05)。在18胚龄时,黑暗组绒毛高度显著高于另外3组(P<0.05),强光组最低;中光组和强光组肌层厚度显著高于黑暗组(P<0.05),弱光组与黑暗组间无显著差异(P>0.05)。在20胚龄,中光组和强光组绒毛高度显著低于黑暗组(P<0.05),弱光组与黑暗组间无显著差异(P>0.05);黑暗组肌层高度显著低于另外3组(P<0.05)。
2.2 不同强度LED绿光照明对坝上长尾鸡胚胎期法氏囊发育的影响
观察各组鸡胚法氏囊组织切片(图4),并对其滤泡大小进行测量。结果发现:在16胚龄时,弱光组法氏囊滤泡的平均面积显著性大于其余3组(P<0.05),中光组和强光组略大于黑暗组,差异不显著(P>0.05)(表2);到了18胚龄,弱光组法氏囊滤泡平均面积仍然显著性大于中光组和黑暗组(P<0.05),此时强光组法氏囊滤泡平均面积显著性小于中光组和黑暗组(P<0.05);在20胚龄时,3个光照组法氏囊滤泡平均面积均显著性大于黑暗组(P<0.05)。
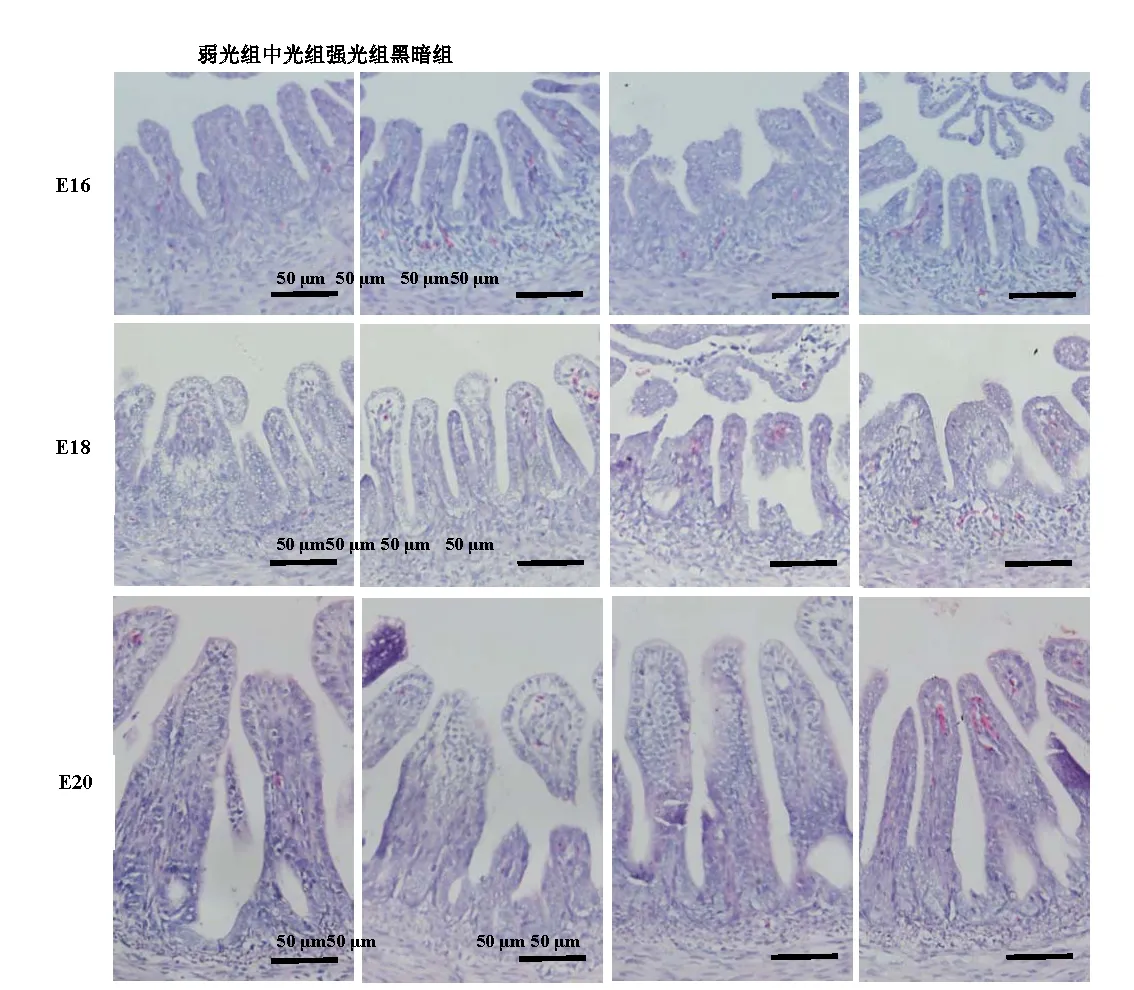
图3 不同光照度LED绿光孵化下坝上长尾鸡胚胎期回肠显微结构
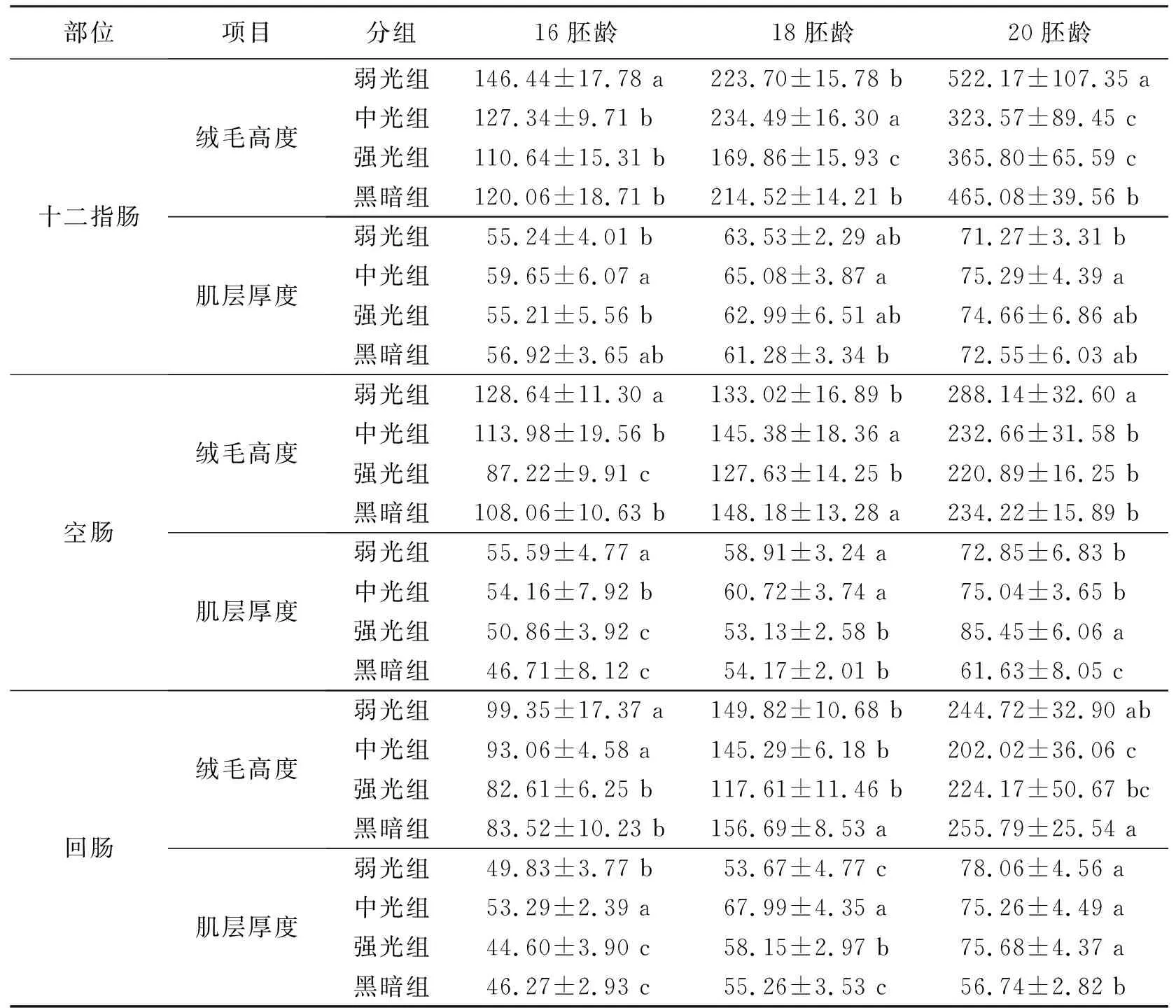
表1 不同光照度LED绿光对坝上长尾鸡胚胎期小肠绒毛和肌层发育的影响 μm
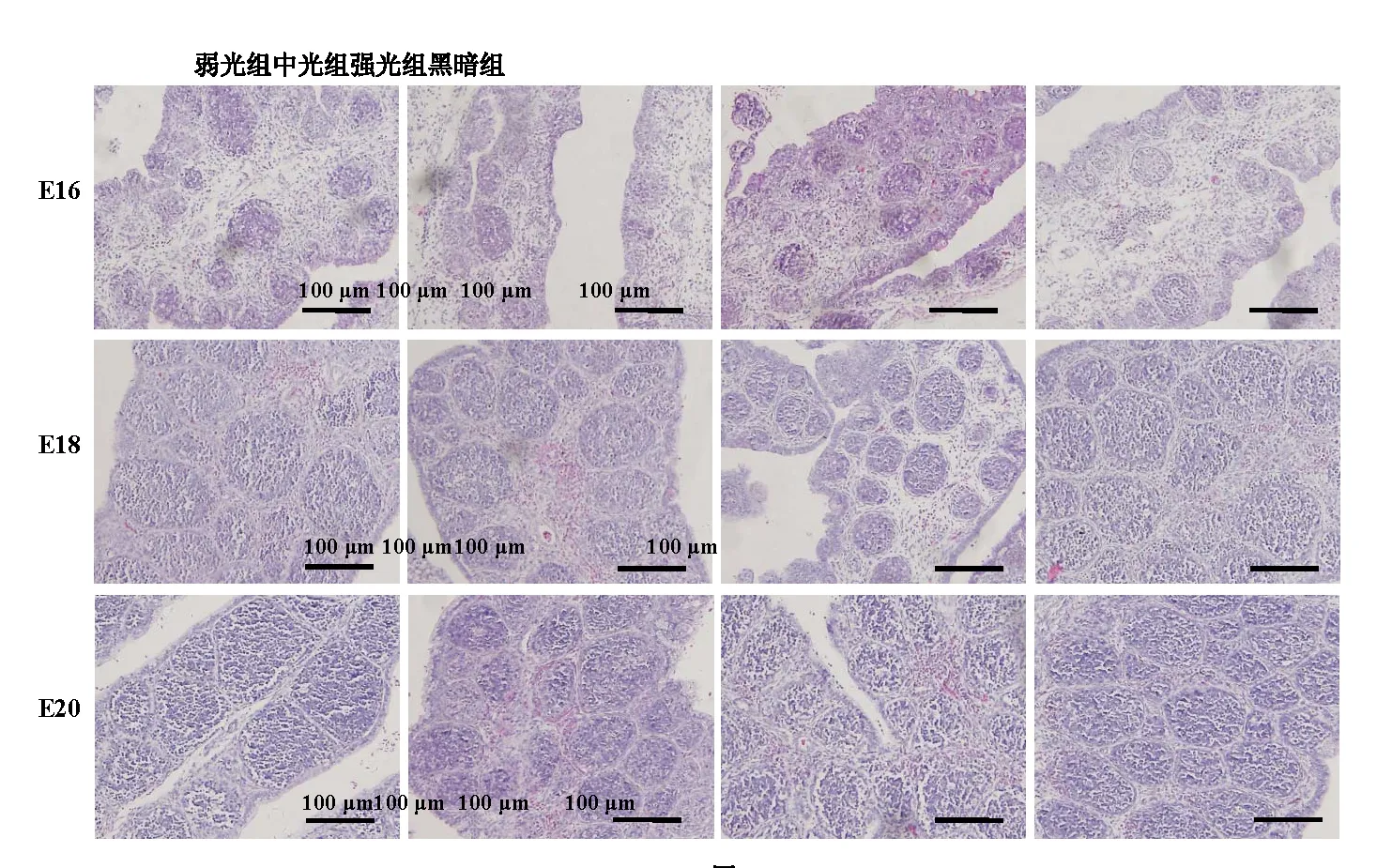
图4 不同光照度LED绿光孵化下坝上长尾鸡胚胎期法氏囊显微结构

表2 不同光照度LED绿光对坝上长尾鸡法氏囊滤泡平均面积的影响 μm 2
3 讨 论
3.1 不同光照度LED绿光对坝上长尾鸡胚胎期小肠发育的影响
在种蛋孵化过程中,第15~20胚龄期是小肠消化吸收与免疫功能快速发育的关键时期[11]。本次试验以坝上长尾鸡为研究对象,研究该阶段绿光照明对小肠发育的影响,结果表明,弱光组(30~80 lx)鸡胚小肠各段的绒毛高度及肌层厚度显著高于黑暗组,表明该光照条件利于坝上长尾鸡胚胎期小肠的发育。这与谢电等[4]研究绿光对AA肉雏鸡肠道发育中的结果一致。在鸡胚发育过程中,15胚龄时小肠肠壁的粘膜层、粘膜下层、肌层及浆膜结构已初步形成,此时粘膜层向内突起形成绒毛结构,绒毛上皮主要由柱状细胞和杯状细胞构成,细胞尚不具备吸收营养物质的能力;直至18胚龄,绒毛已增高至小肠壁厚度的一半,细胞功能日益完善[11];到20胚龄时,小肠绒毛呈现长叶状,其柱状细胞已经完全成熟、具有选择性吸收的能力,杯状细胞分泌的粘液,一方面促进营养物质的消化吸收,另一方面与柱状细胞分泌的糖蛋白结合进而形成肠道粘膜上皮表面的保护层,成为抵御潜在致病原的物理屏障[12,13]。30~80 lx光照度下鸡胚小肠绒毛高度显著提高,意味着其上皮中柱状细胞和杯状细胞的数量也随之上升,有利于增强孵化后雏鸡的营养吸收能力,提高其生长能力;另外,小肠绒毛上皮间存在淋巴细胞,可以抵御肠道病原微生物的侵袭从而保护机体。小肠肌层由平滑肌构成,受植物性神经调控而进行有节律的收缩,肌层增厚,其收缩力提高,加快小肠壁的蠕动,从而加快肠道营养物质进入到循环系统。适宜强度的绿光照明可通过促进鸡胚的小肠发育提高营养吸收能力,从而促进生长发育。
3.2 不同光照度LED绿光对坝上长尾鸡胚胎期法氏囊发育的影响
法氏囊是禽类特有的中枢免疫器官,是B淋巴细胞发育成熟的场所,同时其还与盲肠扁桃体、PP结等共同构成肠道粘膜相关淋巴组织,构成机体免疫的第一道屏障[14]。禽法氏囊的发生是一个较为复杂的过程,4~5胚龄时即产生法氏囊原基[15],直至第15~16胚龄才形成大小不一的淋巴滤泡,在18胚龄时法氏囊基本形成,随着胚龄的增加,法氏囊淋巴滤泡之间界限清晰,面积明显增大[16]。本试验条件下,在20胚龄时,各光照组坝上长尾鸡的法氏囊滤泡平均面积均显著大于黑暗组。与黑暗组相比,弱光组、中光组和强光组鸡胚法氏囊滤泡平均面积分别增长了49.43%,33.60%,27.66%。这表明在胚胎发育过程中,绿光照射可以促进鸡胚法氏囊的发育,器官形态可影响功能变化,由此推测绿光可通过增大法氏囊的滤泡面积从而提高其免疫功能,最终促进机体生长发育。
4 结 论
在本试验中,孵化期使用绿光照明种蛋对于坝上长尾鸡胚胎期小肠各段和法氏囊的发育产生了一定影响,其中使用30~80 lx的绿光照明可促进小肠绒毛发育、肌层增厚,法氏囊滤泡增大,而光照度过高对于肠道的发育则有一定的抑制作用。
