致冬季蛋鸡呼吸道传染病的病原检测与分析
2022-07-06张海龙何云凤党儒尧李佩国李蕴玉
张海龙,何云凤,党儒尧,陈 玥,李佩国,李蕴玉
(河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛,066600)
鸡呼吸道传染病大多是由一种病原体单独感染或多种病原体混合感染引起的,在寒冷的冬春季节最常发生,可危害所有日龄的鸡,临床表现为咳嗽,喷嚏等呼吸道症状,发病率和死亡率较高[1],病程较长,难于治愈,成为危害我国养鸡业生产较为严重的疾病[2]。在生产实践中,当鸡群出现呼吸道症状后,往往不经确诊就大剂量使用抗生素、抗病毒药,存在药物品种、剂量和使用疗程的盲目性,不仅增加了生产成本,还破坏了肠道正常菌群,产生耐药菌株,甚至导致二重感染,给诊断和治疗带来一定的困难[3]。2020年11月17日,河北省秦皇岛市抚宁区某养殖场饲养的8 000只175日龄的海兰褐蛋鸡出现精神沉郁,采食量减少,咳嗽,气喘,有啰音,每天死亡10余只,为了确定引起蛋鸡呼吸道疾病的病原,进行了病原检查,现将结果报告如下:
1.1 病料来源
2020年11月17日,河北省秦皇岛市抚宁区某蛋鸡养殖场场主携带病死鸡来河北科技师范学院动物医院就诊,经病理剖检观察后采集肝脏,脾脏,气管等组织,备检。
1.2 主要试剂与仪器
DNA,RNA提取试剂盒,RNA反转录试剂盒均购于TIANGEN生物公司;肠杆菌科和其他非苛养革兰氏阴性杆菌鉴定试剂盒(比色法)购于bioMerieux,sa公司;DL2000 Marker,2×Taq Marker Mix 购于北京康为世纪生物科技有限公司;TSB培养基,血琼脂平板,TSA平板购于北京奥星生物技术公司;胎牛血清购于Gibco公司;药敏纸片购于杭州微生物试剂有限公司。培养箱(IGS100)由美国热电公司生产;超净工作台(SW-CJ-ZFD)由南京贝登电子商务公司生产;核酸凝胶电泳仪槽(DYCP-31DN)与PCR仪(C1 000 TOUCH)由北京六一生物科技有限公司生产。
1.3 试验动物
选择36日龄健康的肉杂鸡20只作为试验动物购买于秦皇岛市昌黎县某养鸡场。
1.4 细菌鉴定与药敏检测
1.4.1细菌分离与培养 将病死鸡的肝脏组织划线接种于血琼脂平板,于37 ℃培养12~18 h,挑取优势菌落进行涂片镜检,观察其形态结构。
1.4.2细菌生化鉴定 按试剂盒说明书对分离的菌株进行操作,用自动生化鉴定仪进行生化鉴定。
1.4.3细菌PCR鉴定 按照试剂盒说明书进行细菌DNA的提取,用16S rRNA的通用引物进行PCR扩增。反应条件为:94 ℃,5 min;94 ℃,45 s;56 ℃,30 s;72 ℃,1 min;72 ℃,5 min,引物序列:16S rRNA-F:5’-AGAGTTTGATCCTGGCTCAG-3’,16S rRNA-R:5’-TACGGCTACCTTGTTACGAC-3’。反应体系:2×Taq PCR Master mix 10 μL,上下游引物各1 μL,模板2 μL ,无RNA酶水6 μL。将PCR产物于10 g/L的琼脂糖凝胶中进行电泳鉴定,观察结果并将阳性产物进行测序,测序结果进行同源性分析和遗传进化树分析。
1.4.4致病性试验 将20只36日龄肉杂鸡随机分为2组,每组10只,试验组每只鸡腹腔注射分离培养的菌液0.25 mL (CFU 108/mL),对照组每只鸡注射相同剂量的生理盐水,观察发病和死亡情况,对死亡的鸡进行剖检,无菌取其肝脏、肺等组织进行细菌分离鉴定和镜检。
1.4.5药敏试验 按照美国临床检验标准委员会(NCCLS) 推荐的标准K-B纸片法对分离的菌株进行药敏试验,将TSB培养基(含50 mL/L的胎牛血清)培养的菌液,用灭菌的棉签涂布在平板上,用无菌镊子取药敏纸片贴于培养基表面,37 ℃培养18~24 h,观察结果并记录。
1.5 病毒检测
1.5.1鸡新城疫病毒(NDV)和鸡传染性支气管炎病毒(IBV)PCR检测 无菌采集病死鸡的气管、脾脏,匀浆破碎后12 000 r/min,离心5 min,取200 μL的上清液,按照RNA提取试剂盒提取RNA,用反转录试剂盒将RNA反转录为cDNA,以cDNA为模板进行PCR的扩增,NDV反应条件为95 ℃,3 min;94 ℃,30 s;55 ℃,30 s;72 ℃,45 s;72℃,7 min。IBV反应条件为94 ℃,10 min;94 ℃,40 s;57 ℃,40 s;72 ℃,1 min;72 ℃,10 min。NDV与IBV的反应体系为2×Taq PCR Master mix 10 μL,上下游引物各1 μL,模板2 μL ,无RNA酶水6 μL。引物序列NDV-F;5’-AAGGAGCCTTGATCTATCTGTCGG-3’,NDV-R:5’-TGTGCCCCTTCTCCAGCTTAGTA-3’。引物序列IBV-F:5’-GAGGATCCATGGCGAGCGGTAAAGTATCTGGAA-3’,IBV-R:5’-GCCTCGAGTCAAAGTTCATTTTCACCAAGTGCT-3’。取PCR产物各5 μL于10 g/L的琼脂糖凝胶中进行鉴定,观察结果。
1.5.2鸡传染性喉气管炎病毒(ILTV)PCR检测 无菌采集病死鸡的喉头气管,匀浆破碎后离心取上清液200 μL,按照DNA提取试剂盒说明书进行样品DNA的提取,以提取的DNA为模板,进行PCR扩增,反应条件为95 ℃,5 min;94 ℃,30 s;60 ℃,20 s;72 ℃,20 s;72 ℃,10 min。反应体系为2×Taq PCR Master mix 10 μL,上下游引物各1 μL,模板2 μL,无RNA酶水6 μL,引物序列ILTV-F:5’-GAAGATCTAATTATAGCCCAGGCGTGCAACCG-3’,ILTV-R:5’-CCCTCGAGTTAAGGATCCACGTAACTACCAAGTTCCACCCCGGAG-3’。取适量的PCR产物于10 g/L的琼脂糖凝胶中进行鉴定,观察结果。
2 试验结果
2.1 临床剖检结果
剖检结果显示,患有鸡呼吸道传染病的鸡脾脏肿大(图1 A),肝脏呈土黄色(图1 B),并有针尖大的出血点,腺胃乳头水肿,乳头上有出血点(图1 C),喉头、气管出血,伴有粘液和血凝块(图1 D),卵泡变形,破裂,有黄色液体流入腹腔(图1 E)。
2.2 细菌鉴定与药敏检测
2.2.1细菌分离培养与镜检结果 采集病鸡肝脏组织在血液琼脂平板上进行划线培养,结果显示,长出灰白色、圆形、湿润、大小均匀不溶血的露珠样菌落(图2 A);涂片经瑞氏染色可见阴性短杆状,两极浓染的蓝色球杆状菌,有荚膜(图2 B)。
2.2.2细菌生化鉴定结果 分离的菌株能发酵葡萄糖、果糖、甘露醇,不发酵麦芽糖、鼠李糖,L天冬氨酸芳胺酶、精氨酸双水解酶、尿素酶呈阴性;鸟氨酸脱羧酶、氧化酶为阳性,吲哚试验为阳性。经自动生化仪鉴定分析,结果为多杀性巴氏杆菌,命名为FN-Q菌株。
2.2.3FN-Q菌株PCR扩增结果 PCR扩增实验结果表明分离的2株FN-Q菌株在大约1 500 bp处出现目的条带,与预期结果相符(图3)。
2.2.4FN-Q菌株的同源性及进化树分析 同源性分析实验结果表明 FN-Q株的16S rRNA基因序列与Genbank中多杀性巴氏杆菌同源性达到99.5%以上(图4);系统进化树分析实验结果表明,FN-Q株与MN022586.1参考株处于同一分支,亲缘性最近,FN-Q株、MN022586.1和MH150894.1参考株形成一个独立的分支;FN-Q株与MG597096.1处于不同的分支,亲缘性关系最远,可能FN-Q株发生了变异(图5)。
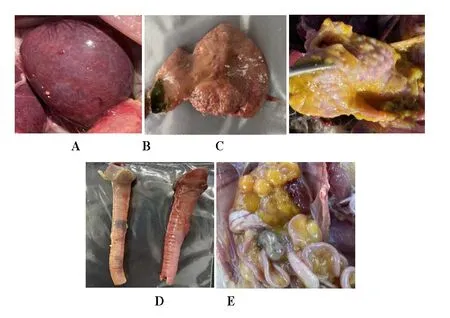
图1 病鸡的病理剖检结果
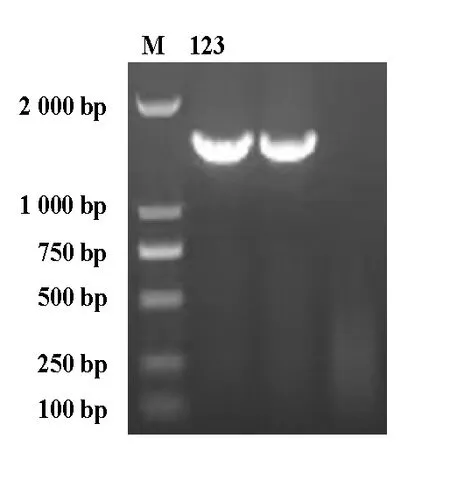
图3 分离菌株16S rRNA基因PCR 扩增结果M: DL2000 Marker;1,2:检测样品;3:阴性对照
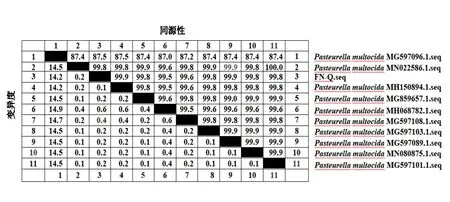
图4 FN-Q菌株同源性分析
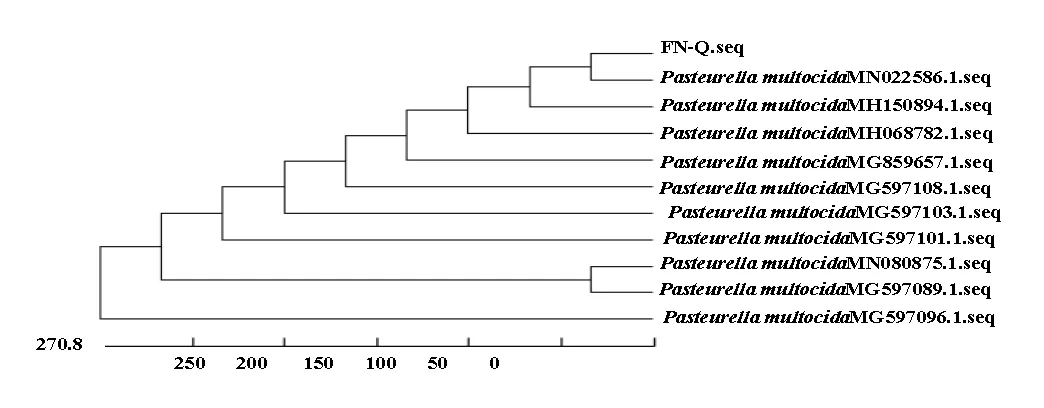
图5 FN-Q菌株系统进化分析
2.2.5FN-Q菌株的致病性检测结果 对照组鸡的采食、饮水、排泄均正常。试验组鸡只于攻菌后12 h开始发病,20只鸡于24~36 h全部死亡。无菌采集死亡鸡的肺脏、肝脏等组织进行细菌分离鉴定,鉴定结果与2.2.1分离的菌株一致,说明该菌株有很强的致病性。
2.2.6FN-Q菌株的药敏试验结果 FN-Q菌株对卡那霉素、恩诺沙星、头孢曲松、丁胺卡那4种药物有较强的敏感性,对头孢拉定、氟苯尼考、环丙沙星3种药物中敏,对磺胺间甲氧嘧啶、四环素、链霉素、新霉素、庆大霉素等7种药物耐药(表1)。
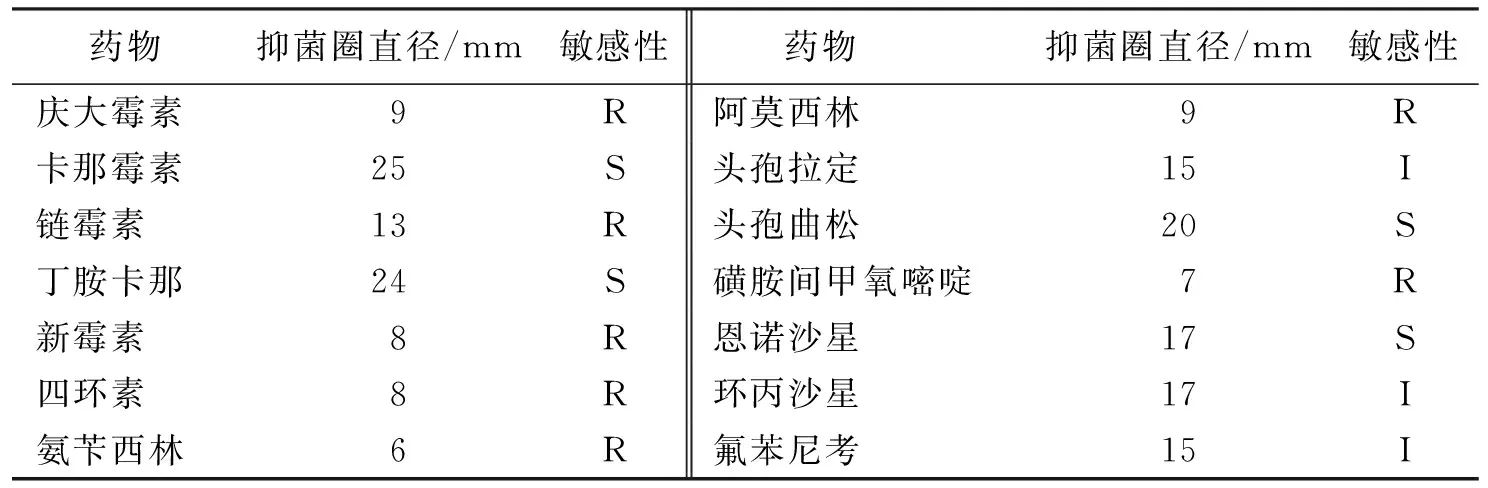
表1 FN-Q菌株的药敏试验结果
2.3 病毒PCR检测结果
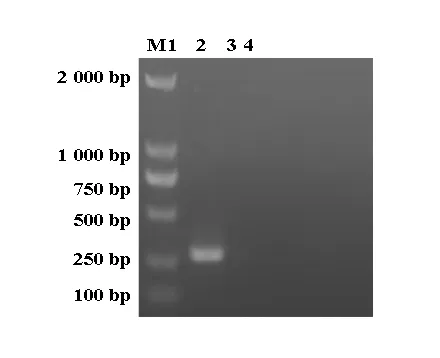
图6 鸡NDV PCR 检测结果M: DL2000 Marker;1:阳性对照;2,3:检测样品;4: 阴性对照
2.3.1鸡NDV PCR检测 2份样品PCR扩增后,在280 bp处没有出现与阳性对照片段大小一样的目的基因(图6),说明组织样品中不存在NDV感染。
2.3.2鸡IBV PCR检测 2份样品PCR扩增后均出现1 230 bp大小的目的基因片段,与阳性对照片段大小一致(图7),说明2份组织样品中均存在IBV感染。
2.3.3鸡ILTV PCR检测 2份样品PCR扩增后均出现334 bp大小的目的基因片段,与阳性对照片段大小一致(图8),说明2份组织样品中均存在ILTV感染。
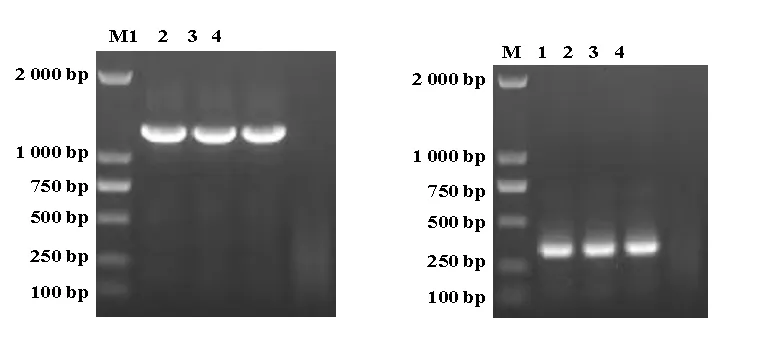
图7 鸡IBV PCR 检测结果 图8 鸡ILTV PCR 检测结果 M: DL2000 Marker;1:阳性对照; M: DL2000 Marker;1:阳性对照; 2,3:检测样品;4: 阴性对照 2,3:检测样品;4: 阴性对照
3 讨 论
呼吸道病是养鸡场最常见的一类疾病[4],引起鸡呼吸道病的原因有两类,即传染性和非传染性,传染性病原包括细菌、病毒、支原体等,非传染性包括环境与管理等因素。冬季是呼吸道疾病的高发季节,进入冬季气温低下,气候干燥,致病性微生物能较长时间存活,以及鸡舍通风与保温之间矛盾突出,有害气体增加,如果不注重改善饲养环境,饲养密度过大,消毒不规范,免疫程序不合理,极易引起呼吸道疾病的发生[5]。本次试验通过对病死鸡剖检病理观察和病原检测,发现导致该场鸡死亡的原因为ILTV,IBV和多杀性巴氏杆菌混合感染。近几年,鸡呼吸道病原体多重交叉感染的现象逐年增多,所造成的经济损失在大部分鸡群中占全部疾病的50%以上。其中,鸡传染性喉气管炎是由ILTV引起的一种急性、接触性上部呼吸道传染病,其特征是呼吸困难、咳嗽和咳出含有血样的渗出物,典型病变在气管和喉部组织[6~8],目前因用于预防传染性喉气管炎感染的减毒疫苗的毒力偏强,免疫后可能形成潜伏感染,导致该病防治困难。
鸡传染性支气管炎是由鸡IBV引起的一种急性、高度传染性的呼吸道疾病[9],IBV的血清型众多,根据血清型的不同,鸡感染后出现的症状也各不相同,除侵害呼吸系统外,还导致泌尿系统和生殖系统的损伤。鸡群在雏鸡阶段感染IBV后,到了产蛋期易出现“假母鸡”,鸡群产蛋率较低[10, 11],维持在70%~80%左右[12]。产蛋期感染IBV后,产蛋率下降约10个百分点,蛋壳质量变差,严重影响鸡群的生产性能。免疫接种是防控传染性支气管炎的主要手段,但在生产实践中即使免疫后也时常会有发病现象,主要是因为不同血清型毒株的交叉保护作用较差,当疫苗毒株与当前流行毒株不一致时,不能产生针对流行毒株的特异性抗体,从而导致鸡群发病。
禽巴氏杆菌病,又称禽霍乱,是由多杀性巴氏杆菌引起的一种急性败血性传染病,最急性型常见不到明显变化[13],发病率和致死率很高。多杀性巴氏杆菌是一种条件性病原菌,当饲养管理不当,天气突然变化,机体抵抗力下降或感染其他疾病时,均可诱发该病。目前,接种菌苗和使用抗生素仍是临床上防治禽巴氏杆菌病的首选。但巴氏杆菌疫苗存在有效期短、毒力反强,成本高等问题;抗生素的频繁使用导致耐药性和药残问题也亟待解决。姜海清[14]研究表明,分离的禽霍乱菌株对氨苄西林和土霉素耐药,常超越等[15]研究发现,禽巴氏杆菌菌株QHP-1株对阿莫西林、氨苄西林、四环素等5种抗生素耐药;本次试验从病死鸡肝、脾等组织分离的FN-Q菌株对四环素、链霉素、新霉素、氨苄西林、庆大霉素等7种药物耐药,其耐药种类呈上升趋势,且该菌株有较强的致病性,这可能与用药习惯以及盲目长期使用某种抗菌药物有关。综上所述,对于鸡呼吸道疾病的防控,首先要制定科学的饲养管理方案,保持鸡舍舒适的温度、湿度和清洁的环境,确保适当的通风。制定日常巡查制度并做好记录,做到早发现、早处理。在免疫方面制定合理的免疫程序,选择与流行株一致的疫苗株,并定期监测免疫抗体水平,投药前最好进行敏感药物的检测,做到科学精准防治。
