葛根素对阿尔茨海默病果蝇的神经保护作用及机制
2022-07-06郭珂一周峥宇赵幸娟
郭珂一,周峥宇,赵幸娟
(1.郑州大学附属郑州中心医院神经内科,河南 郑州 450000;2.郑州大学第五附属医院神经内科,河南 郑州 450000)
阿尔茨海默病(Alzheimer′s disease,AD)是最常见的中枢神经系统退行性疾病,其病理学特征是β淀粉样蛋白(amyloid β-protein,Aβ)异常沉积[1-2],细胞内磷酸化的微管Tau蛋白螺旋化聚集形成的神经原纤维缠结[3-4]及神经元丢失[1,5]。AD的主要临床表现是进行性记忆能力减退、语言障碍、行为障碍、认知功能障碍等。国际阿尔茨海默症协会(Alzheimer′s Disease International,ADI)发布的《2019全球阿尔茨海默症报告:对痴呆的态度》中指出,2019年全世界有超过5 000万人患有AD或其他类型的痴呆,这一数值预计2050年将达到1.52亿。关于AD的发病机制有多种假说,包括β淀粉样蛋白级联假说[6]、胆碱能假说、Tau蛋白假说、神经免疫炎症假说、氧化应激假说、基因突变假说等,但其具体发病机制尚不清楚,且尚无特效治疗药物。葛根素有生津止渴升阳的作用,目前研究已证实,葛根素具有逆转Aβ诱导的神经损伤等活性,对AD模型大鼠的认知功能具有改善作用[7-8],但其作用机制仍不十分明确。因此,本研究利用经典的GAL4/UAS系统构建AD果蝇模型,探究葛根素对其神经保护作用及机制,以期为葛根素在临床AD治疗中的应用提供理论依据。
1 材料与方法
1.1 实验动物选择北极型突变Aβ42(arctic mutation Aβ42,UAS-Aβ42arc)、p〔Gal4〕A307、W1118共3种品系的黑腹果蝇,均由中国科学院上海高等研究院黄福德教授惠赠。将果蝇放入装有用1 300 mL 蒸馏水、11.2 g琼脂粉、30.00 g酵母粉、77.70 g玉米粉、63.20 g葡萄糖、31.62 g蔗糖配制成的培养基的锥形瓶中,置于恒温培养箱中培养,设置湿度60%,温度25 ℃,保种的果蝇每20 d更换1次培养基。
1.2 试剂与仪器葛根素购自美国Merck公司,免疫染色封闭液、免疫荧光染色一抗稀释液、免疫荧光染色二抗稀释液、Alexa Fluor 555 二抗购自上海碧云天生物技术有限公司,Triton-X100、1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)、抗荧光衰减封片、抗荧光衰减封片剂、体积分数4%组织细胞固定液购自北京索莱宝科技有限公司,6E10 一抗购自美国BioLegend公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司,人Aβ42 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA) 试剂盒购自美国Invitrogen公司,碳酸氢钠、甲酸、氢氧化钠购自西陇科学股份有限公司,蛋白酶抑制剂cocktail购自美国Bimake公司;纯水超系统购自美国Millipore公司,恒温培养箱、烘箱购自南宁精密仪器仪表公司,体式显微镜购自日本Nikon公司,电子秤购自方瑞公司,制冰机购自斯科茨曼制冰系统(上海)有限公司,CO2麻醉板购自北京健乃喜生物技术有限公司,电磁炉购自美的集团有限公司,高速冷冻离心机购自美国贝克曼库尔特公司,共聚焦显微镜购自德国Leica公司,多功能酶标仪购自瑞士Tecan公司。
1.3 实验方法
1.3.1 果蝇杂交选择生长良好具有较多即将羽化蛹的培养瓶,清除瓶内成蝇,利用CO2麻醉,收集羽化6 h内的雌蝇为处女蝇,放入培养瓶观察3 d,确保雌蝇未受精。构建GAL4/UAS系统的Aβ42arc转基因果蝇:将携带逃跑通路p〔Gal4〕A307表达的处女蝇(15~20只)与UAS-Aβ42arc雄蝇(5~10只)放于装有果蝇培养基的锥形瓶中杂交,于杂交第7天时清空培养瓶中的亲本,收集子一代果蝇标记为Aβarc果蝇。将p〔Gal4〕A307处女蝇与W1118雄蝇杂交,收集子一代为正常对照组。
1.3.2 实验动物分组和处理取Aβarc果蝇随机分为AD模型组、0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组。0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组分别用终浓度为0.10、0.20、0.24 mmol·L-1葛根素按 24 g·L-1的比例添加酵母,混均后用移液器均匀地打在果蝇的培养基表面,AD模型组及正常对照组用含24 g·L-1酵母的超纯水均匀打在培养基表面,每日1次,培养基每3 d更换1次,至第21天进行爬管能力检测。
1.3.3 果蝇爬管能力的检测取正常对照组、AD模型组、0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇进行爬管能力检测。果蝇爬管实验检测时间点根据果蝇成长情况选用羽化后日龄21 d的雄蝇为目的果蝇。应用果蝇爬管能力检测仪(中国科学院上海高等研究院黄福德教授设计)进行实验,装置包括1个矩形的金属框架(长32 cm,宽5 cm,高12 cm),框架内可放置10个果蝇爬行管(直径2.4 cm,高10.0 cm),下方有电机、计时器,通过杠杆原理,升高及下降上方的金属框架,1次驱动可产生4次升降,将果蝇置于管底,间隔1 min后进行下一次驱动,利用果蝇负趋地性来测试爬行能力,之后使用果蝇爬管分析软件RflyDetection 2.0进行统计。每管果蝇测试3次,以上实验独立重复3次,统计果蝇跌落至管底后21 s时所爬行高度。根据葛根素0.10、0.20、0.24 mmol·L-1浓度组果蝇爬管能力,确定0.20 mmol·L-1为葛根素最适浓度,进行果蝇寿命、脑组织中Aβ含量及斑块面积测定实验。
1.3.4 果蝇寿命监测取正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组果蝇各80只均平均分到4个培养瓶,每瓶20只,置于25 ℃的恒温培养箱中培养,空气湿度控制在60%左右,3 d更换1次培养基,同时记录果蝇死亡情况,直至果蝇全部死亡。瓶壁保持干燥,防止果蝇沾粘至死。
1.3.5 ELISA法检测果蝇脑组织中Aβ蛋白表达按照人Aβ42 ELISA试剂盒产品说明书,对标准品进行连续稀释,将人Aβ42标准品重构为1 ng·L-1。分别取正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组各25只果蝇,将果蝇头放入Ep管中,添加50 μL 含1×蛋白酶抑制剂的ELISA标准样品稀释液,彻底均质化,室温孵育4 h,将匀浆在4 ℃ 下16 000×g离心20 min,取上清液。检测时取3 μL上清液,用PBS稀释20倍,每孔滴加50 μL,设置空白对照孔;每孔加入50 μL人Aβ42检测抗体溶液,空白对照孔除外,室温下振荡孵育3 h;吸出溶液,用1×PBS洗涤4次,之后加入100 μL辣根过氧化物酶标记抗兔IgG,空白对照孔除外,室温下孵育30 min,将溶液吸出,用1×PBS洗涤4次。加入100 μL色原体,室温下避光孵育30 min,最后加入100 μL终止液,混合均匀,检测450 nm处的吸光度值,绘制标准曲线:y=0.002 9x+0.045 4,R2=0.990 1,根据标准曲线计算果蝇脑组织中Aβ表达水平。
1.3.6 免疫荧光法检测果蝇脑组织中Aβ斑块面积分别取正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组3只果蝇,将果蝇放置在添加体积分数4%组织固定液的Ep管中3 h,之后应用含吐温20的磷酸盐缓冲液(phosphate buffered saline containing Tween-20,PBST)洗3次,每次15 min。体式显微镜下剥出果蝇脑组织,PBST清洗3次,每次15 min。免疫染色封闭液封闭30 min,滴加一抗6E10(滴度1100),4 ℃过夜孵育,PBST洗3次,每次15 min,滴加Alexa Fluor555二抗 (滴度1500)孵育2 h,PBST洗3次,每次15 min。用微量移液枪将脑组织吸出置于载玻片上,滴加抗荧光衰减封片剂,盖上盖玻片,指甲油封片,应用共聚焦显微镜观察并计算脑组织中Aβ斑块面积占比。
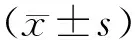
2 结果
2.1 5组果蝇爬管能力比较正常对照组、AD模型组、0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇爬管高度分别为(6.82±0.43)、(1.86±0.27)、(3.14±0.16)、(4.20±0.21)、(3.56±0.20)cm。5组间果蝇爬管高度比较差异有统计学意义(F=139.620,P<0.05);AD模型组、0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇爬管高度显著低于正常对照组,0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇爬管高度显著高于AD模型组,0.20 mmol·L-1葛根素干预组果蝇爬管高度显著高于0.10 mmol·L-1葛根素干预组和0.24 mmol·L-1葛根素干预组,差异均有统计学意义(P<0.05);0.10 mmol·L-1葛根素干预组与0.24 mmol·L-1葛根素干预组果蝇爬管高度比较差异无统计学意义(P>0.05)。
2.2 正常对照组、AD模型组和0.20 mmol·L-1葛根素干预组果蝇寿命比较结果见图1。正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组果蝇的中位生存期分别为48.0、27.0、40.5 d,AD模型组、0.20 mmol·L-1葛根素干预组果蝇的中位生存期显著短于正常对照组,0.20 mmol·L-1葛根素干预组果蝇的中位生存期显著长于AD模型组,差异有统计学意义(P<0.05)。

图1 正常对照组、AD模型组和0.20 mmol·L-1葛根素干预组果蝇寿命Fig.1 Lifespan of drosophila in the normal control group,AD model group and 0.20 mmol·L-1 puerarin intervention group
2.3 正常对照组、AD模型组和0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平比较正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平分别为(0.00±0.00)、(44.83±3.42)、(29.73±2.44) ng·L-1,3组果蝇脑组织中Aβ表达水平比较差异有统计学意义(F=265.540,P<0.05);AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平显著高于正常对照组,0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平显著低于AD模型组,差异有统计学意义(P<0.05)。
2.4 正常对照组、AD模型组和0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比比较
结果见图2。正常对照组、AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比分别为(0.00±0.00)%、(3.25±0.74)%、(1.04±0.22)%。3组间果蝇脑组织中Aβ斑块面积占比比较差异有统计学意义(F=72.360,P<0.05); AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比显著高于正常对照组,0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比显著低于AD模型组,差异有统计学意义(P<0.05)。

A:正常对照组;B:AD模型组;C:0.20 mmol·L-1葛根素干预组。图2 正常对照组、AD模型组和0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块(免疫荧光染色)Fig.2 Aβ plaques in the brain tissue of drosophila in the normal control group,AD model group and 0.20 mmol·L-1 puerarin intervention group (immunofluorescence staining)
3 讨论
AD是最常见的神经退行性疾病之一,近年来其发病率呈升高趋势,但其发病机制尚不明确,尚无特效药,且我国人口基数大,老龄化加剧,因此,防治AD及新药研发显得尤为重要。中药的研发有其独特的优势,同时也存在着诸多不稳定性因素,因此,确定中药有效成分及剂量是AD创新性药物研发的重中之重。
研究证实,葛根素可保护AD模型大鼠Aβ损伤的神经元细胞、抑制脑内神经元凋亡,改善认知功能和空间记忆功能[9-13]。但大多数研究均是针对大鼠、小鼠及细胞,关于葛根素对AD果蝇的神经保护作用的研究报道较少。黑腹果蝇为动物模型,具有繁殖周期短,基因简单,与人类基因同源,易于培养,经济实惠,便于分子标记和表型标记等优势。驱动子A307在逃跑通路表达,可使Aβ在果蝇的神经元胞体和轴突内沉积,使神经肌肉接头的突触能力下降,导致果蝇行为学表型恶化和脑内Aβ斑块沉积加剧。应用UAS-Aβ42arc转基因果蝇与携带逃跑通路启动的p〔Gal4〕A307果蝇杂交可构建AD果蝇模型[14]。
果蝇爬管能力是果蝇模型实验中常用检测指标,利用负趋地性,反映果蝇运动能力,可用来评估葛根素对AD果蝇的神经保护效果[15]。本研究结果显示,AD模型组、0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇爬管高度显著低于正常对照组,0.10 mmol·L-1葛根素干预组、0.20 mmol·L-1葛根素干预组、0.24 mmol·L-1葛根素干预组果蝇爬管高度显著高于AD模型组,0.20 mmol·L-1葛根素干预组果蝇爬管高度显著高于0.10 mmol·L-1葛根素干预组和 0.24 mmol·L-1葛根素干预组,0.10 mmol·L-1葛根素干预组与0.24 mmol·L-1葛根素干预组果蝇爬管高度比较差异无统计学意义;说明AD模型果蝇的运动能力显著降低,而葛根素可显著改善AD果蝇的运动能力,其中0.20 mmol·L-1葛根素对AD模型果蝇的运动能力的改善作用最明显。因此,选择0.20 mmol·L-1为葛根素最适浓度,进行后续果蝇寿命、果蝇脑组织中Aβ含量及斑块测定实验。
AD果蝇实验中果蝇寿命是重要的评估指标,AD通常会导致动物模型存活时间减少,因此,观察果蝇的生存时间可以判断药物对果蝇发挥神经保护的效果。本研究结果显示,AD模型组和0.20 mmol·L-1葛根素干预组果蝇的中位生存期显著短于正常对照组,0.20 mmol·L-1葛根素干预组果蝇的中位生存期显著长于AD模型组;说明AD模型果蝇存在神经损伤,其寿命明显缩短,葛根素可在一定程度上对AD果蝇产生神经保护作用,从而延长AD果蝇的寿命。
Aβ相对分子质量为4 000,具有神经毒性,可诱导神经细胞损伤,是典型AD的病理特征之一。Aβ由APP水解产生,依照氨基酸特性所组成,可呈单体亦可呈聚合体存在,其中寡聚体尤为重要,目前Aβ被认为是造成AD认知障碍及神经损伤的主要因素;其低分子量寡聚体的主要二级结构β折叠,易折叠成β-片层结构,增加细胞神经毒性[16-18]。Aβ作为AD的重要指标,是诊断及治疗中不可代替的标准之一。本研究结果显示,AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平显著高于正常对照组,0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ表达水平显著低于AD模型组;AD模型组、0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比显著高于正常对照组,0.20 mmol·L-1葛根素干预组果蝇脑组织中Aβ斑块面积占比显著低于AD模型组;证实AD的发病与脑组织中Aβ的形成和沉积而产生神经毒性相关,而葛根素可以通过减少AD果蝇脑组织中Aβ含量和抑制Aβ在脑组织中的沉积,从而产生神经保护作用。
综上所述,葛根素可通过减少AD果蝇脑组织中Aβ含量和抑制Aβ沉积来发挥神经保护作用,从而提高AD果蝇运动能力,延长AD果蝇寿命。
