雷帕霉素脂质纳米粒的制备及其对裸鼠乳腺癌的抑制作用
2022-07-06王金梅刘凡凡丁孝良
王金梅,张 凯,刘凡凡,丁孝良
(郑州大学附属郑州中心医院药学部,河南 郑州 450000)
乳腺癌是严重危害女性健康的恶性肿瘤之一,其发病率逐年升高,且患者呈年轻化趋势[1-2]。传统的化学治疗药物常用于乳腺癌的术前及术后辅助治疗,具有特异性差、靶向性低、不良反应大等问题,因此,寻找安全有效的化学治疗药物对乳腺癌的治疗具有重要意义[3]。雷帕霉素(rapamycin,RAPA)是一种大环内酯类免疫抑制剂,同时也是雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的特异性抑制剂,对肝癌、肺癌、乳腺癌、前列腺癌等肿瘤细胞具有抑制作用[4-6]。RAPA在发挥抗肿瘤作用时具有选择性高、毒副作用小的特点[7],适合用于抗肿瘤药物的开发。脂质纳米粒作为一种可程控式释放药物的给药系统,在药物、基因和抗原传递领域引起了人们的广泛关注[8-9]。本课题组前期制备了载雷帕霉素介孔二氧化硅核-脂质纳米粒(rapamycin loaded mesoporous silica nanoparticles core-lipid nanoparticles,RAPA-MSN-LN),并对其抑制乳腺癌细胞生长及诱导细胞凋亡作用进行了研究,但并未深入探究该给药系统的体内抗乳腺癌作用。因此,本研究建立人乳腺癌细胞MCF-7荷瘤裸鼠模型,评价RAPA-MSN-LN对MCF-7乳腺癌细胞的抑制作用,并观察其对荷瘤裸鼠主要器官组织的损伤情况,以及其诱导肿瘤细胞凋亡的作用,以期为RAPA-MSN-LN的临床研究提供参考。
1 材料与方法
1.1 实验动物10只无特定病原体(specific pathogen free,SPF)级雌性Sprague Dawley(SD)大鼠购自河南省实验动物中心,许可证号SCXK(豫)2015-0004。20只4~6 周龄SPF级雌性BALB/c裸鼠购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002。
1.2 细胞、试剂与仪器人乳腺癌细胞MCF-7购自中国科学院;雷帕霉素购自大连美仑生物技术有限公司,十六烷基三甲基氯化铵(cexadecyl trimethyl ammonium chloride,CATC)购自成都贝斯特试剂有限公司,三乙醇胺(triethanolamine,TEA)、硅酸四乙酯(tetraethyl orthosilicate,TEOS)购自阿拉丁试剂(上海)有限公司,3-氨丙基三甲基氧基硅烷[(3-aminopropyl)trimethoxysilane,APTMS]购自国药集团化学试剂有限公司,二油酰磷脂酰乙醇胺(dioleoyl phosphoethanolamine,DOPE)购自上海艾韦特医药科技有限公司,胆固醇购自北京索莱宝生物科技有限公司,二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(distearoyl phosphoethanolamine-PEG2000,DSPE-PEG2000)购自美国Corden Pharma公司,原位末端转移酶标记(TdT-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒购自福州飞净生命科技有限公司,其他试剂均为分析纯,缓冲溶液和样品溶液配制用水均为超纯水;AB135-S型分析天平购自瑞士Mettler Toledo公司,WSJB-03恒温磁力搅拌器购自河南中良科学仪器有限公司,TDL80-2B型离心机购自上海安亭科学仪器厂,DZF-6021型真空干燥箱购自上海精宏实验设备有限公司,RE-52AA型旋转蒸发仪购自上海亚荣生化仪器厂,JEM-1400透射电子显微镜购自日本电子株式会社,Malvern Zetasizer Nano-2000动态光散射粒径仪购自英国马尔文仪器有限公司,Waters e2695高效液相色谱仪购自美国Waters公司,Mili-Q超纯水系统购自美国Millipore公司,BH-2型荧光显微镜购自德国莱卡公司,JY 92-II 超声波细胞粉碎机购自宁波新芝生物科技股份有限公司。
1.3 RAPA-MSN-LN的制备取2 g CATC、20 mg TEA和20 mL超纯水置于圆底烧瓶中,超声溶解后,在80 ℃油浴条件下搅拌20 min,逐滴滴加1.5 mL TEOS,回流反应4 h。反应结束后,12 000 r·min-1离心30 min收集沉淀,使用无水乙醇和去离子水洗涤沉淀,然后将沉淀置于含氯化钠的甲醇溶液(8 g·L-1)中萃取3次,将最终沉淀真空干燥后得到MSN粉末。参考文献[10]中的方法,使用APTMS在MSN表面修饰上氨基。将7 mg MSN超声分散于10 mL无水乙醇中,磁力搅拌下加入冰乙酸(50 μL),反应0.5 h后,逐滴加入APTMS(25 μL),反应1 h,然后12 000 r·min-1离心 5 min 获得沉淀,将所得沉淀用无水乙醇和去离子水洗涤,真空干燥后得MSN-NH2。
分别称取一定量的RAPA和MSN-NH2粉末,使药物载体比例为21,各加入4 mL甲醇超声分散后混匀,磁力搅拌12 h,12 000 r·min-1离心5 min,分离上清液(用以测定包封率),所得沉淀为RAPA/MSN纳米粒。
分别称取一定量的DOPE、胆固醇、DSPE-PEG2000(质量比为717)至茄型瓶中,加入15 mL氯仿充分溶解后,采用旋转蒸发的方式除去氯仿(45 ℃,30 min)。取制备好的RAPA/MSN纳米粒,超纯水分散后加入茄型瓶中,45 ℃下旋转水合1 h。收集反应液并置于超声波细胞粉碎机中超声处理5 min,功率200 W,工作3 s,间隔5 s;所得混悬液即为RAPA-MSN-LN。
1.4 RAPA-MSN-LN的质量评价
1.4.1 形态观察取适量RAPA-MSN-LN溶液滴在铜网上,使用JEM-1400型透射电子显微镜观察RAPA-MSN-LN的形貌。
1.4.2 粒径和电位表征取1 mL的RAPA-MSN-LN溶液,加入超纯水稀释3倍后,利用激光粒度分析仪测定纳米粒的粒径及Zeta电位。平行制备3份样品,测定后取均值。
1.5 RAPA含量和包封率的测定精密称取5 mg RAPA,以5 mL甲醇为溶剂配制RAPA的储备液(1 g·L-1),然后将储备液稀释成一系列标准浓度:0.5、1.0、5.0、10.0、25.0、50.0、75.0、100.0 mg·L-1。采用高效液相色谱法对所有样品进行检测,色谱条件:色谱柱为Symmetry C18 (4.6 mm×250.0 mm,5 μm),流动相为甲醇水乙腈 = 671815,流速:1.0 mL·min-1,柱温40 ℃,检测器为紫外检测器(L-2489),检测波长277 nm,每个样品进样20 μL。根据测定结果以样品浓度为横坐标,峰面积为纵坐标,建立标准曲线回归方程。
取“1.3”中所得上清液,测量上清液体积,然后按照上述色谱条件,采用高效液相色谱法对上清液进行检测,将所得峰面积代入回归方程计算上清液中RAPA浓度,再根据上清液体积,计算上清液中RAPA含量。上清液中RAPA含量=上清液中RAPA浓度×上清液体积。 最后计算RAPA的包封率,包封率(%)=(RAPA投入量-上清液中RAPA含量)/RAPA投入量×100%。
1.6 RAPA-MSN-LN在大鼠体内的药物代谢动力学检测
1.6.1 血浆样品的处理分别取150 mL乙腈和50 mL甲醇,按照体积比31的比例进行混合,所得溶液为破乳液。取100 μL大鼠血浆样品,加入 2 mL 破乳液,充分混匀后,12 000 r·min-1离心20 min,取上清液,室温条件下通氮气挥干,向所得沉淀中加入1 mL甲醇,超声溶解后,12 000 r·min-1离心20 min,取上清液,采用高效液相色谱法检测峰面积并计算血浆中RAPA浓度。
1.6.2 血浆中药物RAPA标准曲线的建立参考“1.5”项中标准曲线建立方法,配制一系列浓度(0.5、1.0、5.0、10.0、25.0、50.0、75.0、100.0 mg·L-1)RAPA溶液。取各浓度溶液50 μL,分别加入100 μL血浆样品,充分混匀后,按照“1.6.1”项中方法对所有样品进行处理,获得上清液,然后采用高效液相色谱法对上清液进行检测,以RAPA浓度为横坐标,峰面积为纵坐标,建立血浆中药物RAPA的标准曲线回归方程。
1.6.3 大鼠体内药物动力学参数检测将10只SD大鼠随机分为RAPA溶液组和RAPA-MSN-LN 溶液组,每组5只。禁食12 h后(饮水充足),RAPA溶液组大鼠经尾静脉注射2.50 mg·kg-1RAPA溶液,RAPA-MSN-LN 溶液组大鼠经尾静脉注射RAPA-MSN-LN 溶液。RAPA溶液配制方法为:将 50 g·L-1葡萄糖溶液、乙醇、氢化蓖麻油按照体积比为911的比例混合,超声至完全溶解,然后将5 mg RAPA加入到该混合溶剂中,超声溶解后即可使用。完成给药后,分别于10 min和0.5、1.0、2.0、4.0、6.0、8.0、12.0、24.0 h时取大鼠眼眶后静脉丛血,取出的血样置于肝素化EP管中,5 000 r·min-1离心10 min,收集上清即为血浆样品。取100 μL大鼠血浆样品,加入2 mL破乳液,充分混匀后,12 000 r·min-1离心 20 min,取上清液,室温条件下通氮气挥干,向所得沉淀中加入1 mL甲醇,超声溶解后,12 000 r·min-1离心 20 min,取上清液,再按照“1.5”项中色谱条件,采用高效液相色谱法对上清液进行检测,计算血浆中RAPA浓度。然后以时间点为横坐标,以血浆中RAPA浓度为纵坐标,绘制血药浓度-时间曲线。采用非房室模型、PK Solver 2.0软件计算2组大鼠体内药物动力学参数,包括血药浓度-时间曲线下面积(area under the curve,AUC)、半衰期(half-life,t1/2)。
1.7 RAPA-MSN-LN的体内抗肿瘤实验
1.7.1 荷瘤裸鼠模型的建立取MCF-7细胞置于含体积分数5% CO2、37 ℃的恒温培养箱中培养,细胞培养液为含有体积分数10%血清的RPMI-1640培养基(含100 U·mL-1青霉素、100 mg·L-1链霉素)。取生长状态良好的MCF-7细胞,胰蛋白酶消化后,磷酸盐缓冲液重悬,调整细胞密度为1×1010L-1,皮下接种于30只BALB/c裸鼠右前腋窝,每只200 μL。每日观察注射部位肿瘤生长情况,使用电子游标卡尺测量肿瘤的长径(a)和短径(b),计算肿瘤体积,肿瘤体积=0.5×a×b2。
1.7.2 荷瘤裸鼠分组及给药取肿瘤体积为100~150 mm3荷瘤小鼠20只,随机分为生理盐水组、MSN-LN组、RAPA组和RAPA-MSN-LN组,每组5只。生理盐水组、MSN-LN组、RAPA组和RAPA-MSN-LN组小鼠分别经尾静脉注射生理盐水、MSN-LN、RAPA和RAPA-MSN-LN溶液,隔日给药1次,共给药6次,各组小鼠给药剂量均为2.50 mg·kg-1。每次给药前,测定各组小鼠的体质量,并使用电子游标卡尺测量肿瘤的长径(a)和短径(b),计算小鼠肿瘤体积,绘制动物体质量随时间变化曲线图以及肿瘤体积变化曲线图。
1.7.3 病理学观察给药结束后,采用颈椎脱臼的方式处死荷瘤小鼠,取心、肝、脾、肺、肾、肿瘤等组织,体积分数10%甲醛溶液固定后,苏木精-伊红(hematoxylin-eosin,HE)染色制成组织切片,在显微镜下观察各组织结构及细胞形态,并拍照记录。使用TUNEL凋亡检测试剂盒对肿瘤组织进行染色,将制好的组织切片置于显微镜下观察肿瘤细胞的细胞核形态及染色情况,并拍照记录。
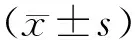
2 结果
2.1 RAPA-MSN-LN的质量评价结果见图1。制备的RAPA-MSN-LN形状规则,呈圆形,MSN表面包裹了一层脂质薄膜,分散状态良好。RAPA-MSN-LN的平均粒径为(91.27±2.26) nm,多分散性指数(polymey disperse index,PDI)为0.165 ± 0.024,电位为(-21.60±2.21)mV,包封率为(42.1±2.1)%。
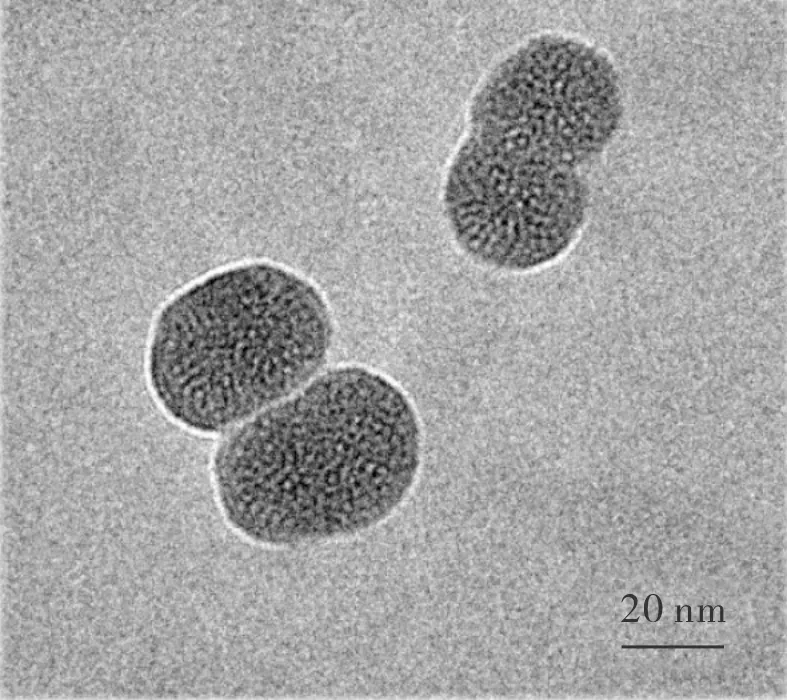
图1 RAPA-MSN-LN的透射电镜图Fig.1 Transmission electron micrograph of RAPA-MSN-LN
2.2 RAPA-MSN-LN在大鼠体内药物代谢动力学
2.2.1 血浆中RAPA的标准曲线与线性范围结果见图2。所得回归方程为:y=8 477.7x+71 791,R2=0.997 6,表明建立的标准曲线在RAPA浓度为0.167~33.333 mg·L-1范围内线性关系良好。
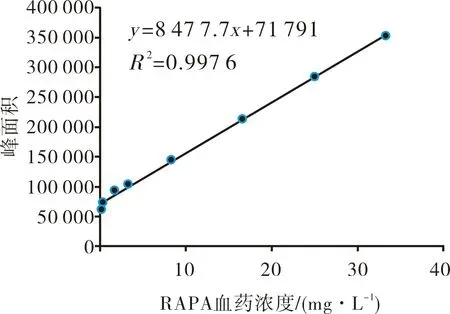
图2 血浆中RAPA的标准曲线Fig.2 Standard curve of RAPA in plasma
2.2.2 2组大鼠RAPA血药浓度比较结果见图3。0~5 h内,RAPA溶液组大鼠血药浓度下降较快,6 h时血药浓度接近于零;RAPA-MSN-LN溶液组大鼠血药浓度缓慢降低,血浆中RAPA浓度维持时间较长。
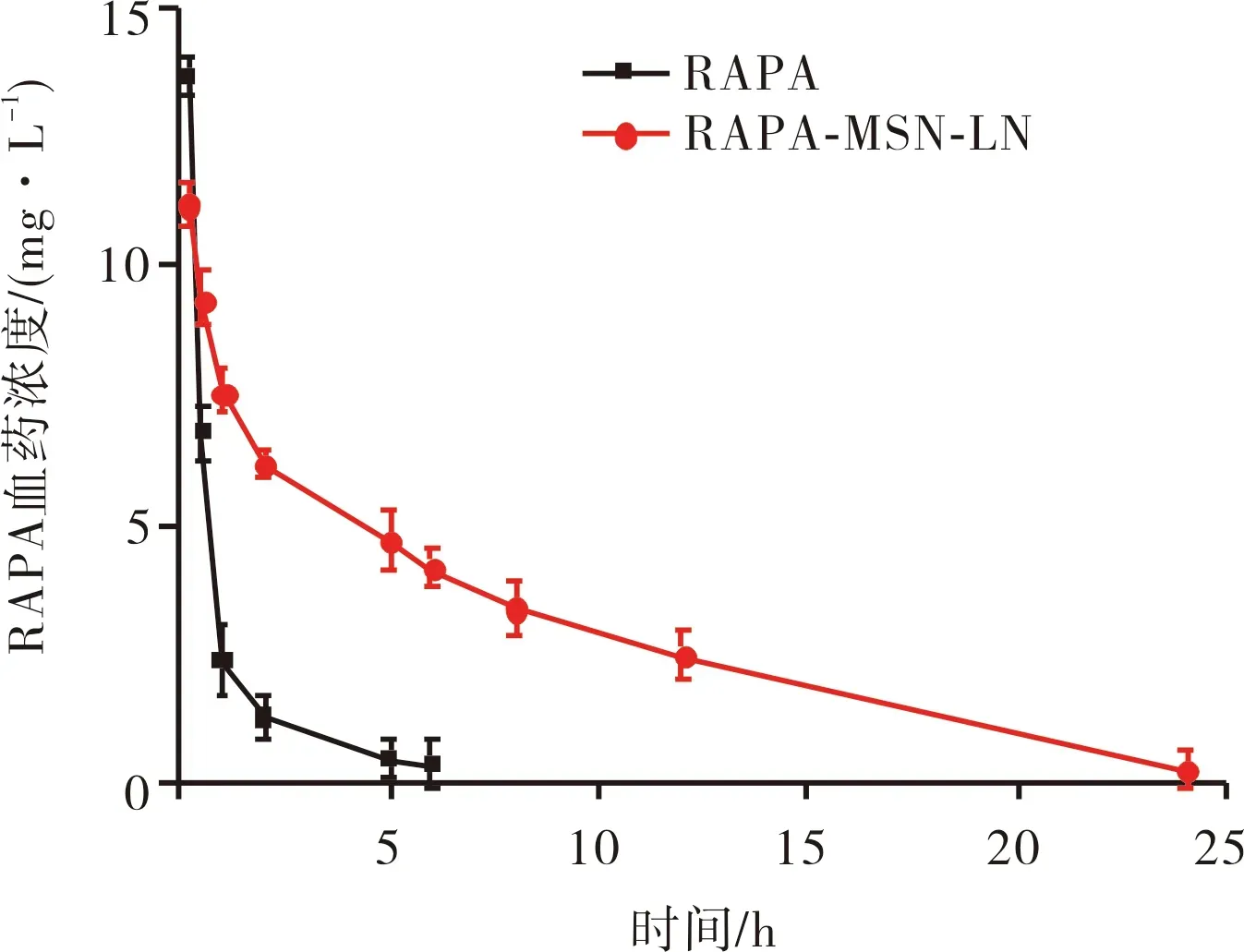
图3 2组大鼠RAPA血药浓度-时间曲线Fig.3 Plasma concentration-time curve of RAPA of rats in the two groups
2.2.3 2组大鼠药代动力学相关参数比较结果见表1。RAPA溶液组大鼠血浆中RAPA的t1/2为(2.31±0.02) h ,AUC为(13.48±0.56) μg·mL-1·h-1;RAPA-MSN-LN溶液组大鼠血浆中RAPA的t1/2为(4.94 ± 0.13) h ,AUC为(73.53±1.24) μg·mL-1·h-1。RAPA-MSN-LN溶液组大鼠血浆中RAPA的t1/2和AUC均高于RAPA溶液组,差异有统计学意义(P<0.01)。
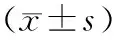
表1 2组大鼠药物代谢动力学相关参数比较Tab.1 Comparison of pharmacokinetic parameters of rats between the two groups
2.3 RAPA-MSN-LN的体内抗肿瘤实验结果
2.3.1 4组荷瘤小鼠的体质量变化结果见图4。4组小鼠体质量均缓慢增长,无下降现象。
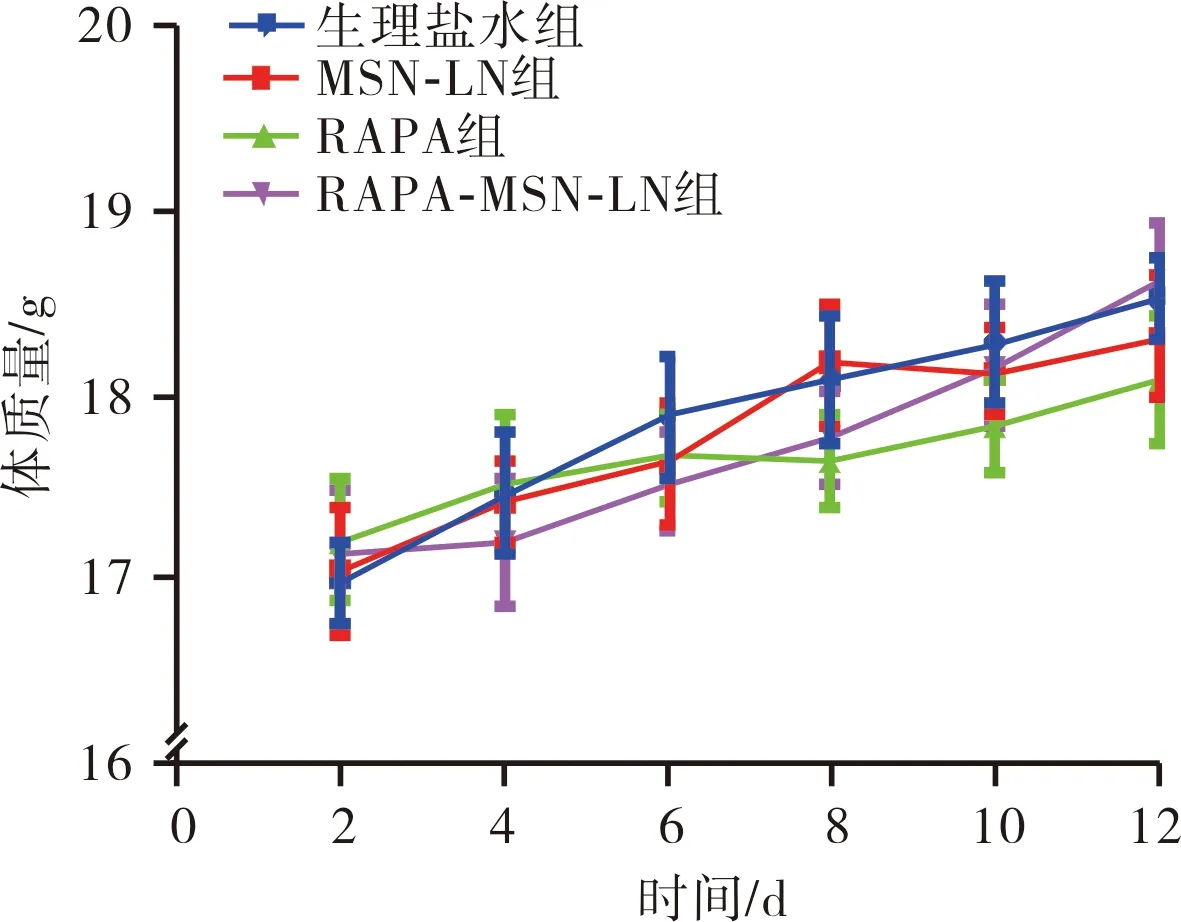
图4 4组荷瘤小鼠体质量变化 Fig.4 Changes of body weight of tumor bearing mice in the four groups
2.3.2 4组荷瘤小鼠肿瘤体积变化结果见图5。随着时间的延长,生理盐水组和MSN-LN组小鼠肿瘤生长迅速,肿瘤体积增长较快;RAPA组和RAPA-MSN-LN组小鼠肿瘤生长速度明显延缓,RAPA-MSN-LN对小鼠肿瘤的抑制作用最好,从第8天开始,肿瘤增长趋于平缓,最终的肿瘤体积明显小于其他组。
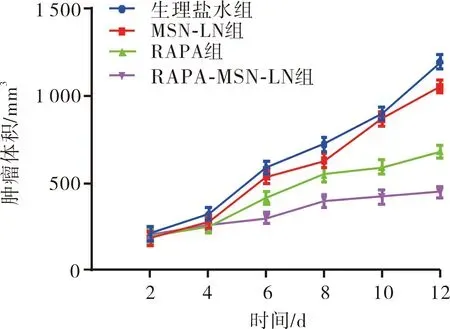
图5 4组荷瘤小鼠肿瘤体积变化Fig.5 Changes of tumor volume of tumor bearing mice in the four groups
2.3.3 4组荷瘤小鼠主要器官及肿瘤的组织形态学变化结果见图6和图7。HE染色结果显示,4组小鼠的主要器官组织结构清晰且无坏死现象。生理盐水组和MSN-LN组小鼠肿瘤组织中肿瘤细胞排列紧密,形态完整;RAPA组小鼠肿瘤组织出现部分坏死,肿瘤细胞数量减少;RAPA-MSN-LN组小鼠肿瘤组织中坏死区域最多,核固缩、核溶解现象较明显。 TUNEL染色结果显示,小鼠肿瘤组织中正常细胞的细胞核被染为蓝色,凋亡细胞的细胞核被染成棕褐色。生理盐水组和MSN-LN组小鼠肿瘤组织中几乎无凋亡细胞,细胞形态完整;RAPA组小鼠肿瘤组织中出现小范围的细胞凋亡;RAPA-MSN-LN组小鼠肿瘤组织中凋亡细胞数较多,细胞核出现消融和萎缩。
A:生理盐水组;B:MSN-LN组;C:RAPA组;D:RAPA-MSN-LN组。图6 4组荷瘤小鼠主要器官组织形态学变化(HE染色,×200) Fig.6 Histomorphological changes of main organs of tumor bearing mice in the four groups (HE staining,×200)

A:HE染色;B:TUNEL染色。图7 4组小鼠肿瘤组织形态学变化(×200) Fig.7 Histomorphological changes of tumor tissue of mice in the four groups (×200)
3 讨论
本研究采用薄膜分散法制备pH敏感脂质薄膜,在薄膜水合过程中加入RAPA/MSN纳米粒溶液,通过自组装制备RAPA-MSN-LN。质量评价结果显示,制备的RAPA-MSN-LN形状规则,大小均一,粒径为(91.27±2.26) nm(PDI= 0.165±0.024),电位为(-21.6±2.21) mV,包封率为(42.1±2.1)%;这样的纳米粒有利于实现体内药物递送[11]。体内药代动力学研究结果表明,RAPA-MSN-LN的半衰期较RAPA长,表明在一定程度上该纳米粒能够延缓RAPA的释放。同时,RAPA-MSN-LN的AUC是RAPA的5.4倍,证明RAPA-MSN-LN的生物利用度较高,能够使药物发挥最大的治疗作用。
众所周知,治疗药物的全身毒性可能导致患者体质量减轻[12]。本研究通过观察治疗过程中小鼠体质量变化初步评估不同纳米粒的生物安全性,结果显示,MSN-LN组、RAPA组和RAPA-MSN-LN组小鼠体质量均无下降现象,表明制备的给药系统对小鼠无明显的毒副作用。在12 d的给药过程中,RAPA-MSN-LN对小鼠肿瘤的抑制作用最好,这是因为将RAPA载入MSN-LN后,通过实体瘤的高通透性和滞留效应,纳米粒增加了药物在肿瘤部位的聚集,从而使纳米粒的抗乳腺癌作用增强。MSN-LN组、RAPA组和RAPA-MSN-LN组小鼠的主要器官组织HE染色结果进一步证明了制备的给药系统生物相容性好[13],对小鼠的器官组织未产生任何损伤。肿瘤组织的HE染色及TUNEL凋亡结果显示RAPA-MSN-LN能够引起肿瘤组织坏死并通过诱导凋亡达到抑制肿瘤生长的目的。
乳腺癌是我国女性发病率最高的肿瘤,乳腺癌的防治仍是肿瘤学的一大难题[14-15]。本研究选择RAPA作为抗肿瘤药物,以脂质纳米粒作为载体,制备了RAPA-MSN-LN,并对其进行质量评价、体内药代动力学研究和体内抗乳腺癌作用探究,结果表明制备的RAPA-MSN-LN符合体内药物递送系统的要求,能够延缓抗肿瘤药物的释放,无明显毒副作用,对小鼠乳腺癌细胞的生长具有抑制作用。本研究为RAPA的临床应用提供了研究基础,为扩大化学治疗药物在乳腺癌治疗中的应用提供了一个良好的策略。
