猪圆环病毒2型灭活疫苗安全性及免疫效力的评价
2022-07-01何锡忠赵本进朱永军李嘉皓丁卫星彭丽英
何锡忠,赵本进,林 鸷,朱永军,李嘉皓,丁卫星,彭丽英*
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海佳牧生物制品有限公司,上海 201403)
猪圆环病毒病是由猪圆环病毒2型(porcine circovirus type 2,PCV2)引 起的传染性疾病,已给全世界养猪业造成了巨大的经济损失,其临床表现主要是以断奶仔猪多系统衰竭综合征为主[1-2]。该病主要发生在7~15周龄的断奶仔猪,发病率4%~30%,死亡率可达50%~90%[3-4],PCV2感染猪后可对机体的免疫系统产生免疫抑制作用[5]。目前对于PCV2引起的猪圆环病毒病尚无有效的治疗方法,且该病毒对外界抵抗力强,造成猪场净化难度高。猪圆环病毒病防控的主要手段是对猪接种疫苗。灭活疫苗的安全性高,所以灭活疫苗仍然是当前主要的疫苗研发类型,但其免疫效果却不十分理想[4]。
本试验是将所制备的猪圆环病毒2型灭活疫苗接种猪后对其安全性及免疫效力进行评价。
1 材料
1.1 疫苗
猪圆环病毒2型疫苗,批号分别为20200401、20200409和20201001,由上海佳牧生物制品有限公司制备。
1.2 试验动物
21日龄的健康易感仔猪(用猪圆环病毒2型特异性PCR方法检测PCV2基因、PCV2抗体均为阴性),购自江苏省茅山镇某家实验动物养殖场。
1.3 猪圆环病毒2型
猪圆环病毒2型SN07-12株(滴毒,TCID50107.33/mL),由上海市农业科学院畜牧兽医研究所制备、鉴定和保存。
1.4 主要试剂和仪器
DNA提取试剂盒(天根生化科技有限公司)、PCV2间接免疫荧光试剂盒(韩国JBT生物技术公司)、Retiga 2000R高敏感度冷CDD荧光数码显微镜(日本OLYMPUS)、GeneAmp9700-PCR扩增仪(美国AppliedBiosytems公司)、紫外凝胶成像系统(法国 Vilber Lourmat)、DYY-6C型电泳仪(北京市六一仪器厂)。
1.5 PCR方法
PCR引物P1:5'-AAGAGAAATGGCATCTTCAACACC-3',P2:5'-CAGGGTTAAGTGGGGGGTC-3',条带大小为580 bp。反应条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 40 s,72 ℃ 40 s,30个循环,72 ℃ 7 min。
2 方法
2.1 安全性试验
将21日龄健康易感仔猪(PCV2抗原和抗体检测均为阴性)20头分为4组,每组5头,3组为免疫组,1组为对照组。免疫组仔猪颈部肌内注射疫苗,2.0 mL/头,随后观察14 d内的采食、饮水、精神是否正常,有无不良临床反应,注射部位有无异常反应。免疫前3 d和免疫后10 d内,测量体温。免疫后14 d,从免疫组和对照组各选择2头仔猪进行剖检,观察各脏器有无病理变化。
2.2 免疫效力试验
取21日龄健康易感仔猪(PCV2抗原和抗体检测均为阴性)25头,分为5组,每组5头,第1~3组为免疫组,第4组接种安慰剂,为攻毒对照组,第5组不免疫不攻毒,为空白对照组,各组分别隔离饲养。免疫组仔猪颈部肌内注射疫苗 1.0 mL/头,首免后隔14 d用相同剂量加强免疫一次,二免后18 d分别在每头仔猪的两侧腋下和臀部注射1.0 mL弗氏不完全佐剂乳化的钥孔血蓝蛋白(KLH/ICFA、0.5 mg/mL),同时腹腔接种巯基乙酸培养基,10 mL/头。
2.2.1 PCV2抗体水平检测
二免后第21天对所有仔猪采血,分离血清,用无血清培养基将PCV2稀释为103.5TCID50/mL,接种于单层PK-15细胞,置培养箱中培养48 h,80%冷丙酮固定细胞30 min。采用免疫荧光方法检测待检血清的PCV2抗体水平,荧光显微镜下见绿色特异性荧光为阳性,无绿色特异性荧光为阴性,出现特异性荧光的血清最高稀释倍数为抗体效价。根据抗体效价检查结果进行判定,免疫组至少4头仔猪的PCV2抗体效价不低于1∶ 1 600,攻毒对照组及空白对照组仔猪的检测结果均阴性(不高于1∶400)。
2.2.2 免疫攻毒
二免后第21天,用PCV2 SN07-12强毒株(病毒含量为TCID50107.33/mL)对各免疫组和对照组仔猪进行攻毒,滴鼻1.0 mL、颈部肌内注射8.0 mL,逐日测量体温并观察25 d。攻毒后第4天分别在每头仔猪的两侧腋下及臀部注射1.0 mL弗氏不完全佐剂乳化的钥孔血蓝蛋白(合计4.0 mL/头),同时腹腔接种巯基乙酸培养基10 mL/头;攻毒后第11、19天再次腹腔接种巯基乙酸培养基10 mL/头。观察期结束时,将试验仔猪称重后扑杀,采集每头仔猪的腹股沟淋巴结,通过免疫组化法对PCV2抗原进行检测[4]。根据体温、平均日增重和病毒抗原检查结果进行判定,免疫组应至少4头仔猪受到保护,攻毒对照组应至少4头仔猪发病。
2.2.3 PCV2病毒检测
PCR法按照中国动物卫生与流行病学中心提供的猪圆环病毒聚合酶链式反应检测试剂盒说明书进行。
免疫组化法是将各组仔猪的腹股沟淋巴结浸泡于2.5%戊二醛-多聚甲醛混合液中固定,8 h~12 h后将固定好的组织修剪成适当大小的块,按免疫组化法[6]进行PCV2检测。
2.3 仔猪发病的判定标准
2.3.1 体温
仔猪体温升高(≥40℃)(每日上午9点左右测定仔猪体温一次),至少持续3 d。
2.3.2 平均日增重
攻毒当日和攻毒结束日,分别对各组仔猪进行称重,计算攻毒后各组仔猪的平均日增重,若攻毒仔猪的平均日增重低于空白对照组仔猪的,且差异显著(P<0.05),判该组仔猪生长发育不良,均有临床症状。
2.3.3 病毒抗原检测
用常规免疫组化法检测仔猪腹股沟淋巴结的PCV2抗原。
符合2.3.1、2.3.2、2.3.3中的任何2项,即可判为发病。
3 结果
3.1 安全性试验结果
3.1.1 体温测定
3批次疫苗免疫后,免疫组仔猪每日每头测得的体温均低于40 ℃,与对照组仔猪的相似,体温处于正常范围内(表1)。
3.1.2 临床观察
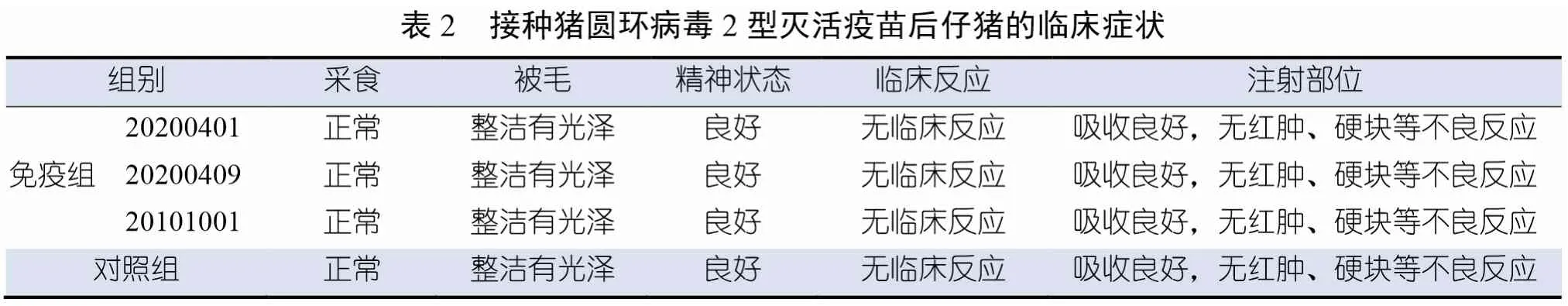
由表2可知,3批次疫苗免疫后观察14 d,仔猪采食、精神状态均正常,被毛整洁有光泽,均无不良临床反应,疫苗吸收良好,注射部位均无红肿、硬块等局部异常反应,与对照组仔猪相比无明显差异。

3.1.3 剖检
免疫后14 d各组随机选1头仔猪剖检,观察仔猪各脏器病理变化。结果显示,免疫组及对照组仔猪各脏器均无病理变化(表3)。
3.2 效力试验结果
3.2.1 抗体测定
由表4可知,猪圆环病毒2型灭活疫苗二免后3周,各批次疫苗免疫仔猪的抗体效价均不低于1∶1 600,攻毒对照组及空白对照组每头仔猪的抗体效价不高于1∶400。
3.2.2 临床观察



如表5所示,攻毒后14 d内逐日测量各组仔猪的体温,并进行临床观察,各批次疫苗免疫仔猪后均无不良临床反应,每日每头仔猪的体温均不高于40 ℃,与空白对照组仔猪的差异不显著(P>0.05);攻毒对照组有部分仔猪在攻毒后3 d~5 d体温略有升高,其中体温高于40 ℃持续3 d。
3.2.3 平均日增重、剖检以及PCR方法和免疫组化法检测结果
攻毒后25 d对各组仔猪称重,并计算仔猪的平均日增重。结果表明,3批次疫苗免疫组、攻毒对照组及空白对照组仔猪攻毒后的平均的日增重分别为(0.533±0.012)kg、(0.534±0.014)kg、(0.537±0.011)kg、(0.492±0.009)kg、(0.532±0.018)kg,免疫组与空白对照组之间差异不显著(P>0.05)。攻毒后25 d剖检所有试验仔猪,3批次疫苗免疫组、攻毒对照组及空白对照组仔猪各脏器均未发现病理变化,通过PCR方法及免疫组化法对腹股沟淋巴结检测PCV2时发现,3批次疫苗免疫组和空白对照组仔猪的检测结果均为阴性,攻毒对照组仔猪也均为阳性(表6)。

4 讨论
安全性试验表明,仔猪以2倍剂量接种3批次疫苗后,体温、采食量、毛色、精神状态均正常,生长发育良好,无异常临床反应,符合疫苗安全要求。
潘杰等发现,在二免2周后,该疫苗不仅能提高仔猪体液免疫水平,诱导高效特异性抗体产生,而且能够有效抵抗强毒株的攻击,保护率可达100%[6]。本研究从攻毒后试验仔猪的体温变化、平均日增重、抗体水平、PCR方法及免疫组化法等方面对疫苗免疫保护效果进行了评价。结果表明:免疫组及空白对照组仔猪体温正常,毛色整洁有光泽;攻毒对照组仔猪体温升高(高于40 ℃)持续3 d,毛色紊乱无光泽。攻毒后25 d剖检,各组仔猪均无特征性的猪圆环病毒病的病理变化;但是免疫组及空白对照组仔猪的平均日增重大于攻毒对照组仔猪的;免疫组每头仔猪的抗体效价均不低于1∶1 600,攻毒对照组及空白对照组每头仔猪的抗体不高于1∶400;在用PCR方法和免疫组化法检测PCV2上,免疫组均为阴性,而攻毒对照组均为阳性。依据仔猪的发病标准判定免疫组保护率为100%,攻毒对照组保护率为0。由此可见,猪圆环病毒2型灭活疫苗能够有效预防猪圆环病毒2型强毒株对猪的侵入。
