miRNA-652在血管平滑肌细胞增殖中的作用及可能机制
2022-06-29谭娟娟姚庆苹党琳严志强
谭娟娟,姚庆苹,党琳,严志强
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是血管壁中膜的主要细胞成分,在维持血管结构、血压平稳及调节血管张力等方面起重要作用,其收缩、舒张、增殖、迁移及钙化等改变与心血管疾病的发生发展密切相关[1-2]。因此,抑制VSMCs异常增殖可望成为治疗心血管疾病的有效途径。近年研究发现,miRNAs在VSMCs的表型转换、增殖、迁移及凋亡等方面起重要作用[3],其是一类小片段的内源性非编码单链RNA分子,由21~25个核苷酸组成,成熟miRNA可与RNA诱导沉默复合物结合,并通过与靶基因信使RNA 3'非翻译区(3'-untranslated region,3'UTR)完全或部分碱基互补配对,导致靶基因mRNA降解或转录后抑制[4]。近年随着临床对miRNA功能的深入研究,其在心血管疾病生理和病理方面的研究日益受到重视[5]。早期研究发现,急性冠脉综合征患者血浆miRNA-652表达升高[6]。HUANG等[7]研究发现,在人脐静脉内皮细胞中,miRNA-652通过靶向cyclinD2而抑制内皮细胞增殖,进而促进动脉硬化斑块形成。然而,miRNA-652对VSMCs的影响尚未见报道。本研究主要探讨了miRNA-652在VSMCs增殖中的作用及可能机制,以期为miRNA-652防治血管重构提供理论依据。
1 材料与方法
1.1 主要试剂与仪器 DMEM培养基(Gibco公司,11965084),胎牛血清(Gibco公司,GB-0500A),胰蛋白酶消化液(北京索莱宝科技有限公司,T1300),青/链霉素(Gibco公司,15070063),miRNA-652 agomir/antagomir(上海吉玛制药技术有限公司,定制),agomir/antagomir NC(上海吉玛制药技术有限公司,定制),siRNA-MateTM转染试剂(上海吉玛制药技术有限公司),Opti-MEM培养基(Gibco公司,11058021),Trizol试剂(Invitrogen),实时荧光定量PCR试剂盒(Takara,R500A),All-in-OneTMmiRNA first-strand cDNA synthesis kit(Clontech公司,638315),CCK8细胞增殖试剂盒(武汉博士德生物工程有限公司,AR1165),荧光显微镜(Leica,BX-61),7500型快速实时荧光定量PCR仪(Applied Biosystem公司)。
1.2 实验方法
1.2.1 实验时间 本实验时间为2019年1月至2020年7月。
1.2.2 VSMCs培养及计数方法 大鼠VSMCs的培养参照文献[8]。待细胞生长至90%~95%汇合度时,弃去原培养液,用37 ℃水浴温热的PBS洗2~3遍,加入0.125%胰酶消化液,室温消化1~2 min;在显微镜下观察细胞形态,若发现细胞间隙开始变大、细胞形态变圆时,迅速弃去消化液,加入新鲜培养液并用移液器轻轻吹散细胞。待细胞计数后,以1∶3或1∶4比例稀释传代。细胞计数方法:取10 μl细胞液,滴加到细胞计数板和盖玻片之间的边缘处,依靠二者之间的虹吸作用将细胞悬液吸附到细胞计数板上;计数低倍镜下细胞计数板上4个象限中的细胞总数,并计算细胞密度,细胞密度(个/ml)=(4个象限中的细胞总数/4)×104。
1.2.3 确定血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)最佳刺激浓度、时间 本实验采用Ang Ⅱ刺激VSMCs以建立体外VSMCs增殖模型。首先,采用不同浓度(0、1、10、100 nmol/L)的Ang Ⅱ刺激VSMCs 24 h后,采用qRT-PCR检测miRNA-652表达情况。确定10 nmol/L AngⅡ为最佳刺激浓度,然后采用10 nmol/L Ang Ⅱ分别刺激VSMCs 0、6、12、24 h,采用qRT-PCR检测miRNA-652表达情况,确定AngⅡ最佳刺激时间为24 h。
1.2.4 分组及细胞转染 将细胞随机分为miRNA-652模拟物组、模拟物对照组、miRNA-652抑制剂组、抑制剂对照组。按照siRNA-MateTM转染试剂说明书进行操作,具体步骤如下:(1)准备预转染细胞:在转染前24 h,将生长状态良好的VSMCs以每孔2×104个均匀接种在24孔板中,常规培养至转染当天,待细胞汇合度达到30%~50%时开始转染。(2)准备miRNA oligo转染复合物:①miRNA-652模拟物组、模拟物对照组分别在100 μl Opti-MEM培养基中加入3 μl 20 μmol/L miRNA-652 agomir、3 μl 20 μmol/L agomir NC(终浓度为100 nmol/L),轻微混匀后,室温孵育5 min;然后取2 μl siRNA-Mate加入到miRNA oligo转染复合物混合液中,立即用加样器吹吸10次以上,使其混合均匀,室温孵育10 min,便于miRNA oligo转染复合物形成;②miRNA-652抑制剂组、抑制剂对照组分别在100 μl Opti-MEM培养基中加入 6 μl 20 μmol/L miRNA-652 antagomir、6 μl 20 μmol/L antagomir NC(终浓度为200 nmol/L),轻微混匀后,室温孵育5 min;然后取4 μl siRNA-Mate加入到Opti-MEM转染复合物混合液中,立即用加样器吹吸10次以上,使其混合均匀,室温孵育10 min,便于siRNA-Mate转染复合物的形成。(3)细胞换液:在miRNA oligo/siRNA-Mate转染复合物孵育期间,去除细胞培养板中原有培养基,然后每孔加入500 μl新鲜的完全培养基。(4)转染细胞:将上一步孵育好的转染复合物逐滴添加到对应的分组细胞中。轻轻地左右晃动培养板,使转染复合物在培养液中混合均匀。转染6 h后改换完全培养基。(5)将转染细胞放于37 ℃、5% CO2培养箱中,孵育24 h/48 h后收集细胞,抽提细胞总RNA,检测miRNA-652/NPTN mRNA表达情况。
1.2.5 采用qRT-PCR检测VSMCs中NPTN mRNA相对表达量 使用Trizol试剂提取转染后的RNA样品,按照All-in-OneTMmiRNA first-strand cDNA synthesis kit说明书将RNA反转录为cDNA,采用无核酸酶水稀释10倍备用。qRT-PCR反应体系如下:2×SYBR qPCR mix 10 μl,10 μmol/L上游引物0.4 μl,10 μmol/L下游引物 0.4 μl,cDNA 1 μl,双蒸水20 μl。反应条件:95 ℃10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环,72 ℃10 min。qRT-PCR在7500型快速实时荧光定量PCR仪上进行,检测各模板Ct值,所有样品重复3次,以未加cDNA作为阴性对照。以2-ΔΔCt表示目的基因相对表达量。
1.2.6 采用CCK8试剂盒检测细胞增殖能力 按照CCK8试剂盒说明书进行操作:将细胞按2×103个/孔的密度接种于96孔板中,每孔100 μl,每组设置4个复孔,同时将仅加培养基的孔设置为空白对照,次日转染。转染48 h后,每孔加入10 μl CCK8,混匀后(避免产生气泡),放入细胞培养箱中继续培养1 h,采用酶标仪测定各孔在450 nm处的吸光度,以相对吸光度表示细胞增殖能力,每组取4孔并计算其平均值。
1.2.7 生物信息学分析及双荧光素酶报告基因检测通过miRNA靶基因预测数据库miRDB(http://mirdb.org/)、TargetScan(http://www.targetscan.org/)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/)在线进行生物信息学分析。为了验证NPTN是miRNA-652的靶基因,将含有miRNA-652结合位点的NPTN 3'UTR克隆到报告基因载体pmirGLO中,构建野生型pmirGLO-NPTN 3'UTR-WT和突变型pmirGLO-NPTN 3'UTR-MUT,并分别与寡核苷酸miRNA-652 agomir、miRNA-652 antagomir、agomir NC及antagomir NC共转染293 T细胞。转染48 h后收集细胞,采用发光检测仪GloMaxTM 96 Microplate Luminometer测定荧光素酶活性。按照Promega公司Dual-Luciferase® Reporter Assay System说明书进行,并计算荧光素酶相对活性,荧光素酶相对活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.2.8 采用qRT-PCR检测VSMCs中NPTN mRNA相对表达量 方法同1.2.5。
1.3 统计学方法 采用GraphPad Prism 9.0统计学软件进行统计分析。本实验结果以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 确定Ang Ⅱ最佳刺激浓度、时间 分别采用0、1、10、100 nmol/L Ang Ⅱ刺激VSMCs 24 h后,miRNA-652相对表达量分别为(1.009±0.115)、(0.722±0.189)、(0.439±0.060)、(0.456±0.111)。不同浓度Ang Ⅱ刺激VSMCs 24 h后miRNA-652相对表达量比较,差异有统计学意义(F=13.290,P=0.001)。与采用0 nmol/L Ang Ⅱ刺激VSMCs 24 h后相比,采用10、100 nmol/L Ang Ⅱ刺激VSMCs 24 h后miRNA-652相对表达量降低,差异有统计学意义(P<0.05)。
采用10 nmol/L Ang Ⅱ分别刺激VSMCs 0、6、12、24h后,miRNA-652相对表达量分别为(1.005±0.098)、(0.855±0.023)、(0.640±0.036)、(0.463±0.101)。采用10 nmol/L Ang Ⅱ刺激VSMCs不同时间后miRNA-652相对表达量比较,差异有统计学意义(F=31.720,P<0.001)。与刺激0 h相比,刺激6、12、24 h后miRNA-652相对表达量降低,差异有统计学意义(P<0.05);与刺激6 h相比,刺激12、24 h后miRNA-652相对表达量降低,差异有统计学意义(P<0.05);与刺激12 h相比,刺激24 h后miRNA-652相对表达量降低,差异有统计学意义(P<0.05)。
综上,本实验确定Ang Ⅱ最佳刺激浓度为10 nmol/L,最佳刺激时间为24 h。
2.2 miRNA-652相对表达量和相对吸光度 转染24 h后,miRNA-652模拟物组miRNA-652相对表达量高于模拟物对照组,相对吸光度低于模拟物对照组,差异有统计学意义(P<0.05),见表1。转染24 h后,miRNA-652抑制剂组miRNA-652相对表达量低于抑制剂对照组,相对吸光度高于抑制剂对照组,差异有统计学意义(P<0.05),见表2。
表1 miRNA-652模拟物组和模拟物对照组VSMCs中miRNA-652相对表达量、相对吸光度比较(±s,n=4)Table 1 Comparison of relative expression of miRNA-652 and relative absorbance in VSMCs between miRNA-652 agomir group and agomir NC group
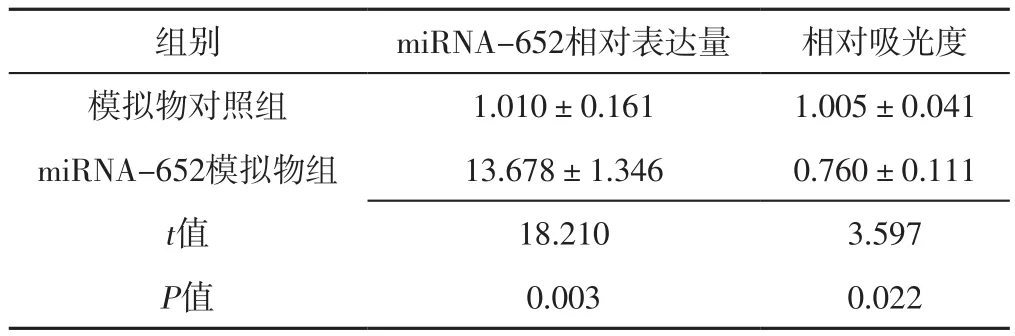
表1 miRNA-652模拟物组和模拟物对照组VSMCs中miRNA-652相对表达量、相对吸光度比较(±s,n=4)Table 1 Comparison of relative expression of miRNA-652 and relative absorbance in VSMCs between miRNA-652 agomir group and agomir NC group
组别 miRNA-652相对表达量 相对吸光度模拟物对照组 1.010±0.161 1.005±0.041 miRNA-652模拟物组 13.678±1.346 0.760±0.111 t值 18.210 3.597 P值 0.003 0.022
表2 miRNA-652抑制剂组和抑制剂对照组VSMCs中miRNA-652相对表达量及相对吸光度比较(±s,n=4)Table 2 Comparison of relative expression of miRNA-652 and relative absorbance in VSMCs between miRNA-652 antagomir group and antagomir NC group
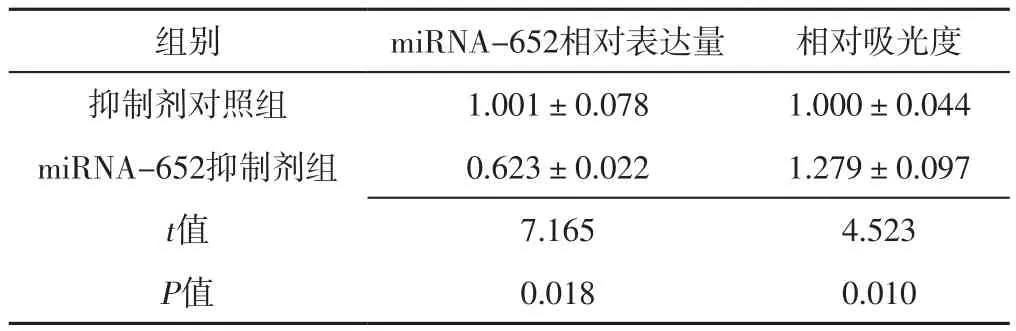
表2 miRNA-652抑制剂组和抑制剂对照组VSMCs中miRNA-652相对表达量及相对吸光度比较(±s,n=4)Table 2 Comparison of relative expression of miRNA-652 and relative absorbance in VSMCs between miRNA-652 antagomir group and antagomir NC group
组别 miRNA-652相对表达量 相对吸光度抑制剂对照组 1.001±0.078 1.000±0.044 miRNA-652抑制剂组 0.623±0.022 1.279±0.097 t值 7.165 4.523 P值 0.018 0.010
2.3 生物信息学分析结果及荧光素酶相对活性 生物信息学分析结果显示,3个数据库均检测到NPTN是miRNA-652的靶基因,见图1。双荧光素酶报告基因检测结果显示,转染48 h后,miRNA-652模拟物组pmirGLO-NPTN 3'UTR-WT荧光素酶相对活性低于模拟物对照组,差异有统计学意义(t=4.413,P=0.012)。miRNA-652模拟物组和模拟物对照组pmirGLO-NPTN 3'UTR-MUT荧光素酶相对活性比较,差异无统计学意义(t=0.041,P=0.969)。miRNA-652抑制物组和抑制物对照组pmirGLO-NPTN 3'UTR-WT、pmirGLONPTN 3'UTR-MUT荧光素酶相对活性比较,差异无统计学意义(t值分别为0.251、1.259,P值分别为0.814、0.277),见图2。

图1 生物信息学分析结果Figure 1 Bioinformatics analysis results
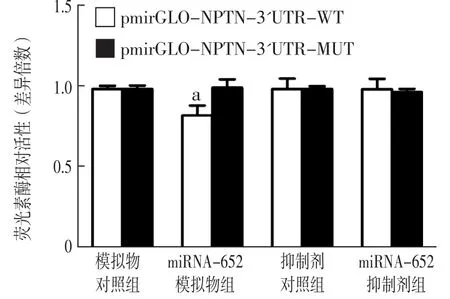
图2 各组NPTN 3'UTR重组质粒相对荧光素酶活性比较的条形图Figure 2 Bar chart of comparison of relative luciferase activity among NPTN 3'UTR recombinant plasmids in each group
2.4 miRNA-652调控NPTN mRNA的表达 转染48 h后,miRNA-652模拟物组NPTN mRNA相对表达量为(0.551±0.071),低于模拟物对照组的(1.002±0.067),差异有统计学意义(t=5.686,P=0.030);转染48 h后,miRNA-652抑制剂组NPTN mRNA相对表达量为(3.339±0.304),高于抑制剂对照组的(1.000±0.073),差异有统计学意义(t=15.420,P=0.004)。
3 讨论
VSMCs是一种高度特化的细胞类型,其存在于血管的内膜。与其他终末分化的细胞不同,VSMCs在整个成年时期均保持着较高的可塑性。正常生理状态下,VSMCs保持沉默,以收缩型为主,增殖、迁移发生率较低,可表达收缩表型分子如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SM-MHC)、calponin及sm22-α等;在血管受到损伤等病理状态下,VSMCs由收缩型转变为合成型,其增殖、迁移能力增强,可大量合成细胞外基质(extracellular matrix,ECM),减少收缩蛋白表达,这种表型的改变会导致内膜增厚和血管硬化,进而引发多种血管疾病的发生和发展[1]。miRNAs是一类非常保守的单链小RNA分子,其表达具有明显的组织和细胞特异性,在不同疾病阶段及组织中表达水平不同,且可通过多种靶基因发挥不同的调控作用[9]。近年研究揭示,miRNAs在动脉粥样硬化、新生内膜增生的VSMCs表型转换、增殖、迁移及凋亡等方面具有重要作用[10-11]。研究表明,miRNA-21在大鼠颈总动脉球囊损伤后新生内膜中表达上调,其通过PTEN、PDCD4等靶基因调节VSMCs增殖和凋亡[12]。LIU等[13]研究发现,miRNA-221/222可通过调控p27(kip1)和p57(kip2)而影响VSMCs的增殖和迁移。miRNA-143/145在动脉壁的VSMCs中选择性表达,在正常血管壁中呈高表达,其对VSMCs的增殖具有抑制作用[14]。笔者所在课题组前期研究发现,miRNA-26a在血小板源性生长因子-BB(platelet derivedgrowth factor-BB,PDGF-BB)刺激的VSMCs中表达明显下调,其通过靶基因MAPK6而调控VSMCs增殖和迁移,进而参与自体静脉移植术后新生内膜的增生[8]。本研究结果表明,miRNA-652在AngⅡ刺激的VSMCs中表达下调,且呈现一定程度的浓度和时间依赖性。
人类基因miRNA-652位于X染色体上,在基因TMEM164的一个内含子内,可编码跨膜蛋白164[15],可参与心血管疾病(包括动脉粥样硬化和心肌梗死)的发生发展过程。既往研究发现,miRNA-652表达下调与动脉粥样硬化病变发生率增加相关[16]。近期研究表明,miRNA-652可作为心力衰竭患者发生急性肾损伤的生物标志物,患者血清和尿液中miRNA-652表达上调及中性粒细胞明胶酶相关脂质钙蛋白增加可预测急性肾损伤的发生[17]。HUANG等[7]研究发现,miRNA-652可通过靶向Cyclin D2而抑制人脐静脉内皮细胞增殖,促进斑块形成。本研究结果显示,转染24 h后,miRNA-652模拟物组miRNA-652相对表达量高于模拟物对照组,相对吸光度低于模拟物对照组;miRNA-652抑制剂组miRNA-652相对表达量低于抑制剂对照组,相对吸光度高于抑制剂对照组。提示过表达miRNA-652可抑制VSMCs增殖,而干扰miRNA-652可促进VSMCs增殖。
miRNA以完全互补配对和不完全互补配对两种方式与靶基因mRNA结合,降解靶基因或抑制其翻译,进而发挥生物学功能。既往研究证实,miRNA-652的靶基因包括小鼠基因ISL1、KLF9、ZEB1、JAG1及人类基因LLGL1、ENPP1等[18]。本研究生物信息学分析结果显示,3个数据库均检测到NPTN是miRNA-652的靶基因,丰富了miRNA-652的靶基因范畴。NPTN属于细胞黏附分子免疫球蛋白超家族成员,由同一基因经不同剪切方式形成两种相对分子质量(65、55 kD),分别被命名为neuroplastin-65(np65)和neuroplastin-55(np55)[19]。本研究主要检测了NPTN mRNA在VSMCs中的表达情况,结果显示,转染48 h后,miRNA-652模拟物组NPTN mRNA相对表达量低于模拟物对照组,miRNA-652抑制剂组NPTN mRNA相对表达量高于抑制剂对照组,提示miRNA-652对NPTN具有负调控作用。
综上所述,过表达miRNA-652可以抑制VSMCs增殖,而抑制miRNA-652可以促进VSMCs增殖;miRNA-652对NPTN具有负调控作用,其可能通过调控靶基因NPTN而影响VSMCs增殖。提示miRNA-652可作为抑制VSMCs增殖的潜在靶点,这为防治由VSMCs增殖引起的血管重构提供了新的理论依据。但本研究未进一步研究miRNA-652通过调控NPTN而影响VSMCs增殖的具体过程,且未进一步确认NPTN是np55还是np65,这些均有待进一步研究探讨。
作者贡献:谭娟娟、严志强进行文章的构思与设计;谭娟娟进行研究的实施与可行性分析,撰写、修订论文;姚庆苹进行数据收集、整理、分析;姚庆苹、党琳进行结果分析与解释;严志强负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
