血液炎症相关指标在晚期胰腺癌中的预后价值
2022-06-29史幼梧孙志伟肖艳洁张晓东
孙 婧 史幼梧 贾 军 杨 颖 孙志伟 杜 丰 余 靖 肖艳洁 张晓东
(北京大学肿瘤医院暨北京市肿瘤防治研究所VIP-Ⅱ病区 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
胰腺癌是恶性程度最高的肿瘤之一,超过50%的患者在初始诊断时已发生远处转移,5年生存率不足3%[1]。准确预测患者预后有助于制定合理的治疗计划,有效与患者及家属沟通治疗预期。既往基于临床特征的预后指标客观性不足,基于病理特征的预后指标受限于有创活检组织量少及肿瘤异质性高。外周血炎症相关指标具有客观、简便、无创的优势,有望成为良好的预后指标。
炎症应答影响肿瘤的发生、发展,在包括胰腺癌在内的多种实体瘤中,血液炎症相关指标中性粒细胞-淋巴细胞比值(neutrophil-lymphocyte ratio,NLR),血小板-淋巴细胞比值(platelet-lymphocyte ratio,PLR),淋巴细胞-单核细胞比值(lymphocyte-monocyte ratio,LMR)被证明与预后有关[2-7];系统性炎症状态下血管通透性提高,同时肝脏合成白蛋白(albumin,ALB)抑制,导致低ALB血症,既往研究[8-9]提示,低ALB为胰腺癌预后的危险因素。近年来,联合炎症指标建立的预后指标如预后营养指数(prognostic nutritional index,PNI)[10]、纪念斯隆-凯瑟琳癌症中心首次提出的纪念斯隆-凯瑟琳预后评分(Memorial Sloan Kettering Prognostic Score,MPS)显示出良好的预后价值[11],但目前尚缺乏公认的炎症相关预后指标指导晚期胰腺癌的临床实践。本研究旨在评估血液炎症相关指标,并探索联合炎症指标在晚期胰腺癌中的预后价值。
1 资料与方法
1.1 临床资料
2012年7月至2020年10月北京大学肿瘤医院消化道肿瘤VIP-Ⅱ病区收治的50例晚期胰腺癌患者入选本研究。其中男性34例,女性16例。患者年龄35~78岁,中位年龄60岁。通过电子病历系统收集患者基线临床、病理信息资料及外周血炎症相关指标数值。
1.2 血液炎症相关指标及计算
记录病理或细胞学诊断晚期胰腺癌1个月以内,且在接受全身治疗前的中性粒细胞绝对值(neutrophil,NEU)、淋巴细胞绝对值(lymphocyte,LYM)、单核细胞绝对值(monocyte,MON)、血小板绝对值(platelet,PLT)及ALB值。NLR=中性粒细胞绝对值/淋巴细胞绝对值,PLR=血小板绝对值/淋巴细胞绝对值,LMR=淋巴细胞绝对值/单核细胞绝对值,PNI=血白蛋白(g/L)+淋巴细胞绝对值(×109/L)×5[10]。
1.3 统计学方法
总生存时间(overall survival,OS)定义为病理诊断晚期胰腺癌至死亡或末次随访删失时间。依据中位生存时间绘制受试者工作特征(receiver operating characteristic, ROC)曲线确定NLR、PLR、LMR、ALB、PNI界值,根据曲线下面积(area under curve, AUC)估计预后因素的准确性。采用Kaplan-Meier法绘制生存曲线,采用Log-rank检验进行生存分析。采用Cox比例风险模型进行多因素分析。以P<0.05为差异有统计学意义。使用SPSS 21.0软件包进行统计分析,使用GraphPad 7.00绘图。
2 结果
2.1 临床特征及生存分析
截至末次随访时间2021年9月30日,50例患者中48例出现肿瘤相关死亡,2例失访,中位OS为7.2个月(95%CI:3.568~10.699)。
高龄患者(年龄≥65岁)与其他年龄的患者预后比较差异无统计学意义。患者平均体质量指数(body mass index,BMI)为(21.11±6.46)kg/m2。近半数患者(24例,48%)为胰头癌,其中一半患者(12例)诊断时伴有黄疸症状;肝转移常见,达70%。性别、原发灶部位、黄疸情况、肝转移对预后影响无统计学意义。绝大多数患者(42例,84%)在诊断时体力状态较好,东部肿瘤协作组体力状况评分(Eastern Cooperative Oncology Group Performance Status,ECOG-PS)0~1分较ECOG-PS≥2分的患者中位OS显著延长(8.5个月vs1.4个月,P<0.001)。病理信息显示,5例患者为组织学高分化,23例为中分化,15例为低分化,7例为分化情况不明,中位生存时间分别为13.0、9.5、3.1 和 4.1个月(P=0.003)。绝大多数(42例,84%)患者CA19-9高于正常值上限,CA19-9高于正常值上限者与在正常范围内患者的预后差异无统计学意义。详见表1。

表1 患者基线临床特征及生存分析
2.2 血液炎症相关指标及临界值确定
诊断晚期胰腺癌时患者平均NEU、LYM、MON、PLT均在正常范围内:NEU(5.39±3.28)×109/L[(2~8)×109/L],LYM(1.51±0.77)×109/L[(1~5)×109/L],MON(0.49±0.27)×109/L[(0.2~0.8)×109/L],PLT(240.08±122.14)×109/L[(100~350)×109/L]。绝大多数(46例,92%)晚期胰腺癌患者诊断时ALB尚在正常范围。
依据中位生存时间绘制ROC曲线(图1),选取约登指数最高值获得NLR、PLR、LMR、ALB、PNI临界值,分别为:NLR=4.5(AUC=0.840,95%CI:0.732~0.948,P<0.001),PLR=138(AUC=0.671,95%CI:0.517~0.826,P=0.038),LMR=4.0(AUC=0.873,95%CI:0.770~0.975,P<0.001),ALB=41.5(AUC=0.726,95%CI:0.582~0.870,P=0.006),PNI=51.0(AUC=0.764,95%CI:0.626~0.903,P=0.001)。

图1 血液炎症相关指标ROC曲线
2.3 血液炎症相关指标生存分析及多因素分析
血液炎症相关指标中,NLR≥4.5(P<0.001)、PLR≥138(P=0.009)、LMR<4(P<0.001)、ALB<41.5 g/L(P=0.037)提示预后不良。PNI<51显示出预后不良趋势,但结果差异无统计学意义(P=0.076)。NLR≥4.5、PLR≥138、LMR<4、ALB<41.5 g/L各计1分,联合炎症指标NLR_ALB、PLR_ALB、LMR_ALB评分越高,提示预后越差(P≤0.01)。详见表2。
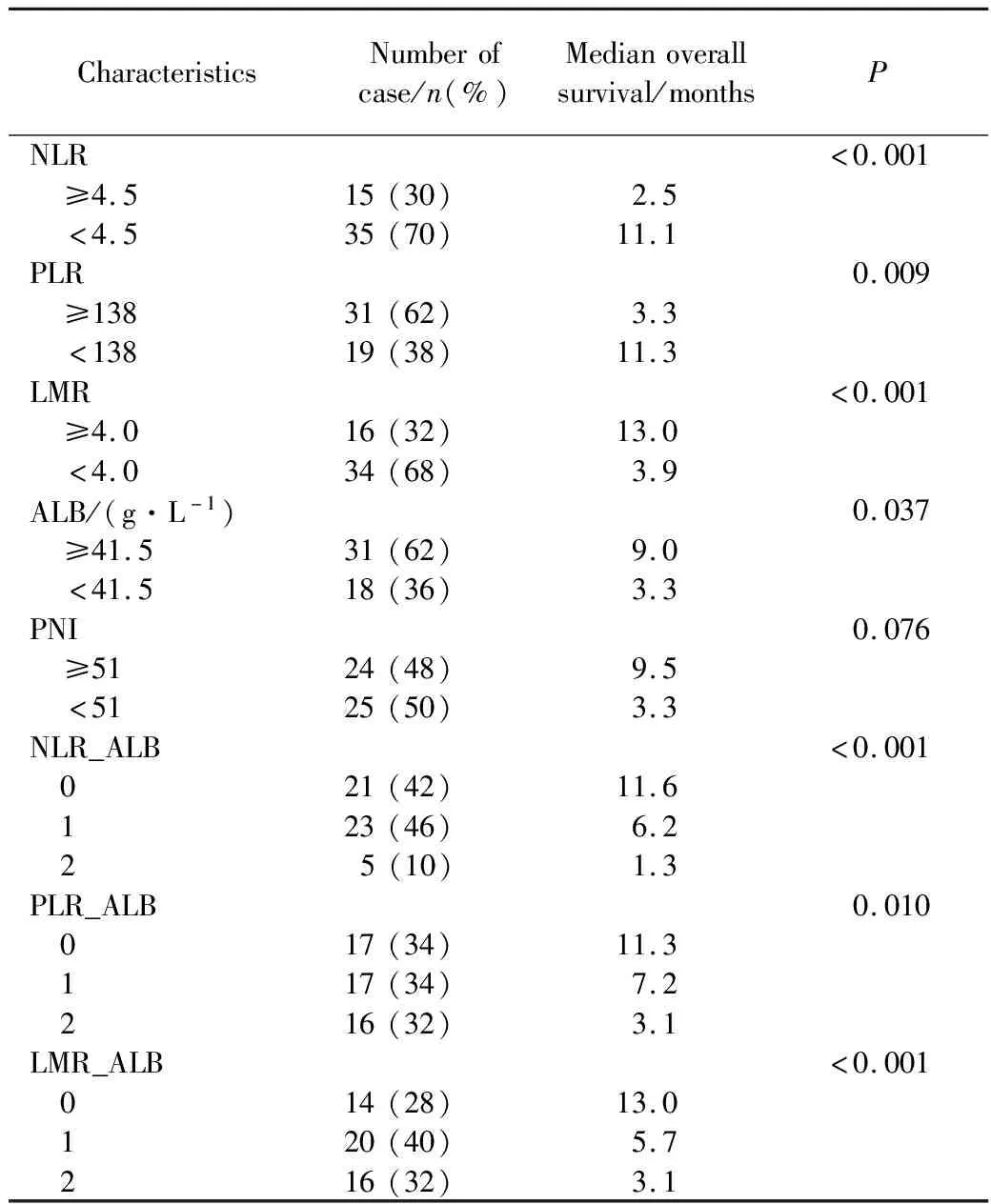
表2 晚期胰腺癌血液炎症相关指标生存分析
进一步,分别将上述血液炎症指标与单因素分析中差异具有统计学意义的临床特征ECOG-PS评分、病理分化程度,以及对血液炎症指标在生物学上具有潜在影响的年龄、性别纳入多因素分析模型,结果显示:临床指标中,ECOS-PS评分≥2为晚期胰腺癌预后的独立危险因素(P<0.05);血液炎症指标NLR、PLR、LMR、ALB是晚期胰腺癌预后的独立影响因素,其中NLR≥4.5、PLR≥138、ALB<41.5 g/L为独立危险因素;LMR≥4为独立保护因素。详见表3。
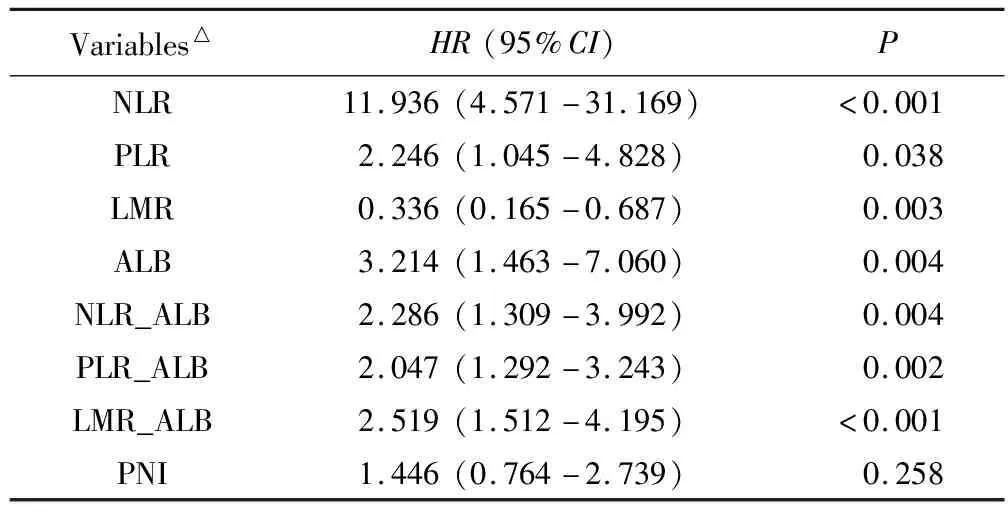
表3 血液炎症相关指标多因素Cox回归分析结果
联合炎症指标NLR_ALB、PLR_ALB、LMR_ALB评分为独立危险因素,评分越高,死亡风险越高。PNI不是独立危险因素。
3 讨论
本研究系统评估了血液炎症相关指标在晚期胰腺癌中的预后价值,结果显示,NLR、LMR、PLR、ALB为晚期胰腺癌的独立预后指标,联合炎症指标可能进一步指导临床实践。
既往基于临床特征的预后指标中,ECOG-PS 评分和CA19-9是胰腺癌的主要预后因素[12]。胰腺癌恶性程度高,患者容易短期内出现恶病质,体力状态不佳的患者难以耐受高强度的抗肿瘤治疗,即使接受手术或化学药物治疗亦预后欠佳。本研究证实临床指标ECOG-PS 评分为晚期胰腺癌的独立预后因素,与既往研究[13-14]一致,但ECOG-PS 评分标准主观性较强,作为预后指标准确性不足。既往文献[15-16]报道CA19-9高于正常值上限为胰腺癌的不良预后因素,由于绝大多数晚期胰腺癌患者基线CA19-9高于正常上限(本研究中为88%),以此作为预后指标缺乏临床指导价值,有待于寻找更为理想的临界值作为预后指标。
炎症在肿瘤发生、发展中具有重要意义。炎症通过诱导基因突变,增加基因组的不稳定性,增强表观遗传修饰促进肿瘤发生;肿瘤相关炎症刺激血管生成,招募调节性T细胞和激活趋化因子,抑制抗肿瘤免疫,促进肿瘤免疫微环境形成,促进肿瘤转移[17-18]。中性粒细胞在炎症反应中起关键作用,参与肿瘤增殖、侵袭、转移以及免疫抑制[19-20];相反,淋巴细胞在抗肿瘤免疫中发挥核心作用;血小板则是细胞因子的重要来源,产生转化生长因子-β(transforming growth factor-β,TGF-β)和血管内皮生成因子(vascular endothelial growth factor,VEGF),通过促进血管生成促进肿瘤增殖;单核细胞,特别是肿瘤相关巨噬细胞也参与肿瘤血管生成、肿瘤浸润、转移,抑制抗肿瘤免疫应答。尽管炎症指标作为预后指标的具体机制不明,既往Meta分析[21-23]显示,高NLR与较短的中位无进展生存期(progress-free survival period,PFS)及中位OS相关,类似地,高PLR[4-5]、低LMR[6]为晚期胰腺癌预后的危险因素,在本研究中,NLR、PLR、LMR的预后价值得到验证,预后较好组中位OS在11~13个月,预后较差组中位OS仅为2.5~3.9个月。血液炎症相关指标的临界值存在较大争议[24],目前尚无定论,有待多中心、大样本的研究明确。ALB不仅反映机体营养状态,更主要的是反映系统炎症水平。在肿瘤相关系统炎症状态下,肝脏合成更多的急性期蛋白而ALB合成减少,同时血管通透性增加,出现外周血低蛋白血症,既往有研究[8-9]报道ALB可以作为胰腺癌的独立预后因素,在本研究中得到验证。
由于在胰腺癌中高NLR和低ALB均为预后的独立危险因素,MPS评分同时联合评估二者,显示出良好的预后价值[11],本研究首次对MPS进行了外部数据验证,由于入组人群差异,本研究中NLR_ALB炎症指标的临界值选择有差异,生存分析结果显示,NLR_ALB与单独的NLR、ALB检测相比,可有效将晚期胰腺癌患者预后分为3组,中度危险组生存时间与中位OS接近,有助于指导临床实践,本研究首次探索了LMR_ALB、PLR_ALB作为晚期胰腺癌的预后价值,显示出与NLR_ALB相似的预测能力。这些结果说明联合炎症指标能进一步优化对晚期胰腺癌患者预后的预测,在临床实践中具有良好的应用潜力,但鉴于单一炎症指标已有较好的预测能力,便捷性略逊于单一炎症指标。PNI由联合淋巴细胞和ALB进行运算得到,低PNI说明存在淋巴细胞减少和/或低白蛋白血症,在既往研究[10]中证实为胰腺癌预后的不良因素,但在本研究中未显示出良好的预后价值。
综上所述,血液炎症相关指标NLR、LMR、PLR、ALB可以作为晚期胰腺癌的预后指标,联合炎症指标可以进一步优化预后预测,有助于简便、迅速地评估预后,指导治疗决策,具有较高的临床应用价值。
