乙型肝炎肝硬化患者内皮祖细胞数量、功能变化及与Child-Pugh评分的相关性
2022-06-29刘汉雄杨小安熊潭玮
刘汉雄, 杨小安, 熊潭玮
(1.郴州市第一人民医院消化内科,湖南省郴州市 423001;2.中山大学附属第三医院感染科,广东省广州市 510630)
内皮祖细胞(endothelial progenitor cell,EPC)主要来源于骨髓,并存在于肝脏、脾脏、心肌等多个组织器官中,可直接分化为血管内皮细胞促进血管再生[1]。肝损伤时,骨髓来源的EPC能顺利归巢到受损肝组织[2],而体外扩增的EPC[3]经肝门静脉或外周静脉输入,也能到达受损肝组织。EPC到达受损肝组织后可分泌多种细胞因子促进肝细胞增殖和肝脏修复[4]。EPC还可以通过血管生成作用修复受损肝组织。Child-Pugh分级为目前临床使用最广泛的肝硬化及肝功能评分标准。但肝硬化患者循环EPC功能及与Child-Pugh评分关系的报道少见,本文对此进行了研究,现报道如下。
1 资料和方法
1.1 研究对象
选择中山大学附属第三医院2019年1月—2020年1月住院或门诊确诊乙型肝炎肝硬化患者60例为肝硬化组,其中Child-Pugh A、B、C级[5]各20例;另选同期20例健康体检者为对照组。乙型肝炎病毒感染诊断标准:HBsAg阳性或HBV-DNA阳性。对照组研究对象排除乙型肝炎病毒感染(HBsAg阴性且HBV-DNA阴性)。两组基线资料见表1。本研究由本院伦理委员会批准,研究对象均知情同意。
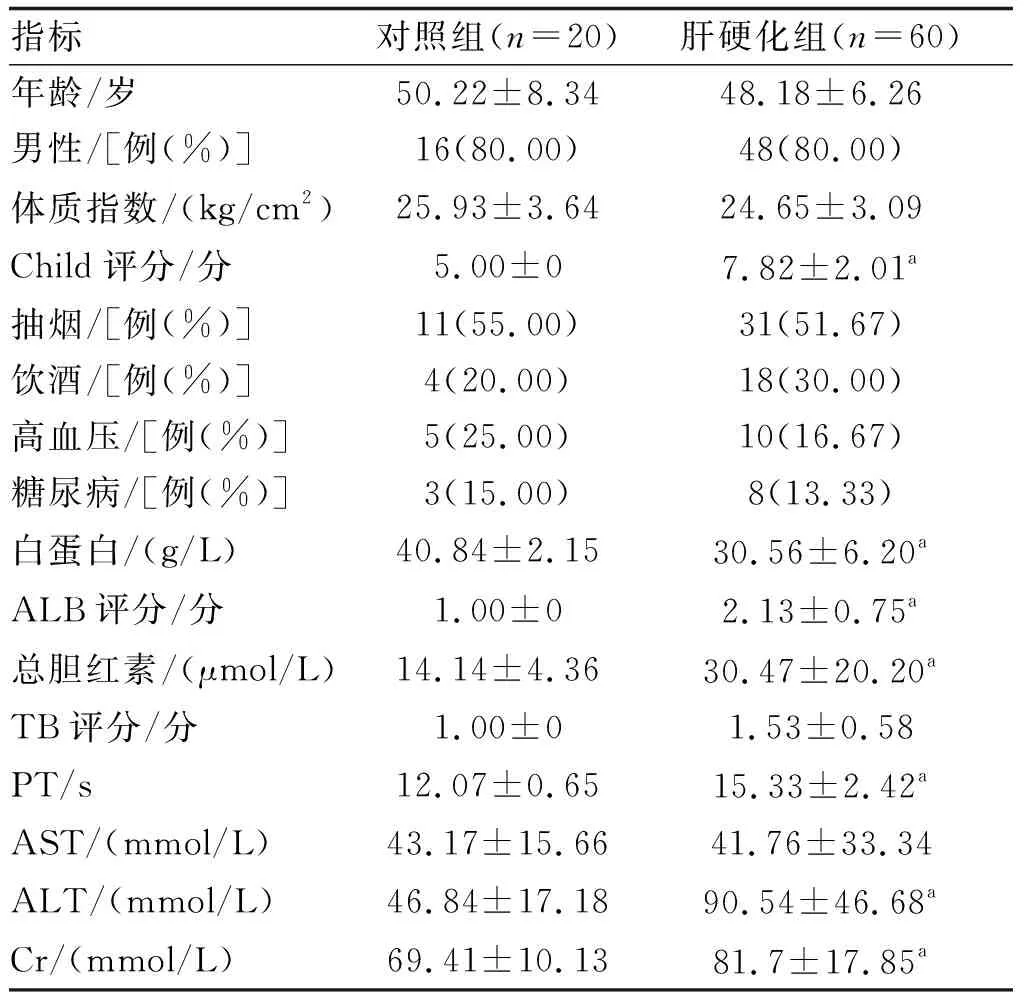
表1 各组临床资料的比较
1.2 循环EPC的分离、培养和计数
抽取静脉外周血加入含Ficoll-Paque人淋巴细胞分离液的离心管上层,4 ℃ 2 200 r/min离心25 min,吸取第二层云雾状单核细胞层,将分离所得单个核细胞重悬于含有20%胎牛血清、50 μg/L血管内皮生长因子的EGM-2培养基中,接种至预先包被好人纤维连接蛋白(1 ng/L)的6孔板中,置于5% CO2、饱和湿度、37 ℃培养箱中培养,每3天换液除去未贴壁细胞,培养至7天后的贴壁细胞即为实验所用EPC。本研究使用DiI标记的乙酰化低密度脂蛋白(Dil-ac-LDL)和FITC标记的荆豆凝集素-l(FITC-BS-l)双重染色免疫荧光鉴定EPC,Dil-ac-LDL(红色)和FITC-BS-Lectin(绿色)双染色阳性细胞数量即为EPC,计数EPC。
1.3 EPC增殖、迁移能力的测定
原代内皮祖细胞培养7天后,用0.25%胰酶消化贴壁细胞,重悬于DMEM培养液中。将相同数量内皮祖细胞接种到包被有人纤维连接蛋白的96孔培养板,每孔加入10 μL MTT(5 g/L),培养4 h后弃去上清液,在酶标仪下于波长490 nm处测OD值。调整细胞至2×105个/mL;置入Transwell小室,24 h后取出小室,弃去上层液体,刮去滤膜上的未迁移细胞,4%多聚甲醇溶液固定10 min,以DAPI染色,置于荧光显微镜下观察,选择3个随机视野计数迁移入下室的细胞。
1.4 统计分析
2 结 果
2.1 乙型肝炎肝硬化患者EPC数量的变化
内皮祖细胞的荧光染色鉴定见图1。循环EPC数量乙型肝炎肝硬化早期患者(Child-Pugh A、B级)较对照组增加,且高于Child-Pugh C级患者(P<0.05);Child-Pugh C级患者较对照组高但差异无显著性(P>0.05;图1)。
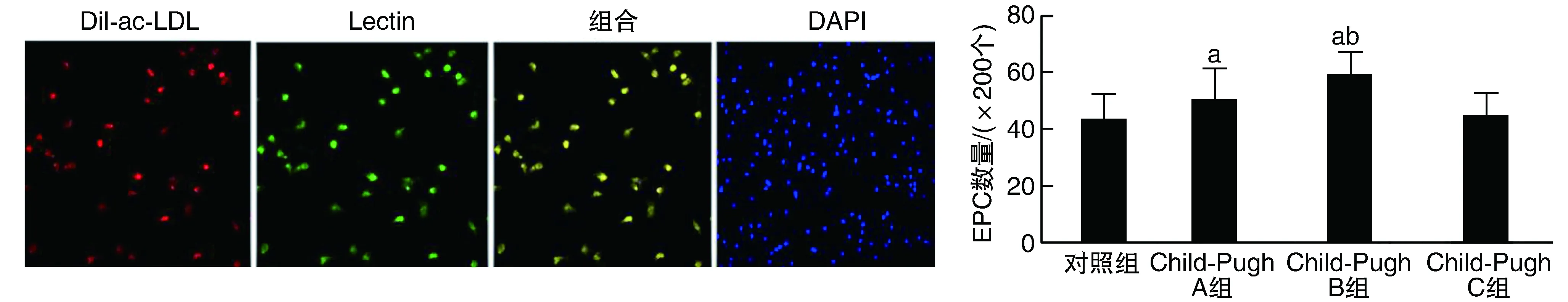
图1 乙型肝炎肝硬化患者EPC鉴定和数量的变化荧光染色鉴定Dil-ac-LDL为红色,Lectin为绿色,双染色细胞即为EPC(200×)。a为P<0.05,与对照组和Child-Pugh C组比较;b为P<0.05,与Child-Pugh A组比较。
2.2 乙型肝炎肝硬化患者内皮祖细胞功能变化
Child-Pugh A级、B级、C级患者循环EPC的体外迁移、增殖能力随Child-Pugh分级升高而降低(P<0.05;表2)。

表2 乙型肝炎肝硬化患者内皮祖细胞功能的变化
2.3 循环EPC功能与Chhild评分的相关性
Spearman相关分析发现,循环EPC迁移和增殖能力与Child-Pugh评分均呈明显负相关(P<0.05;图2)。
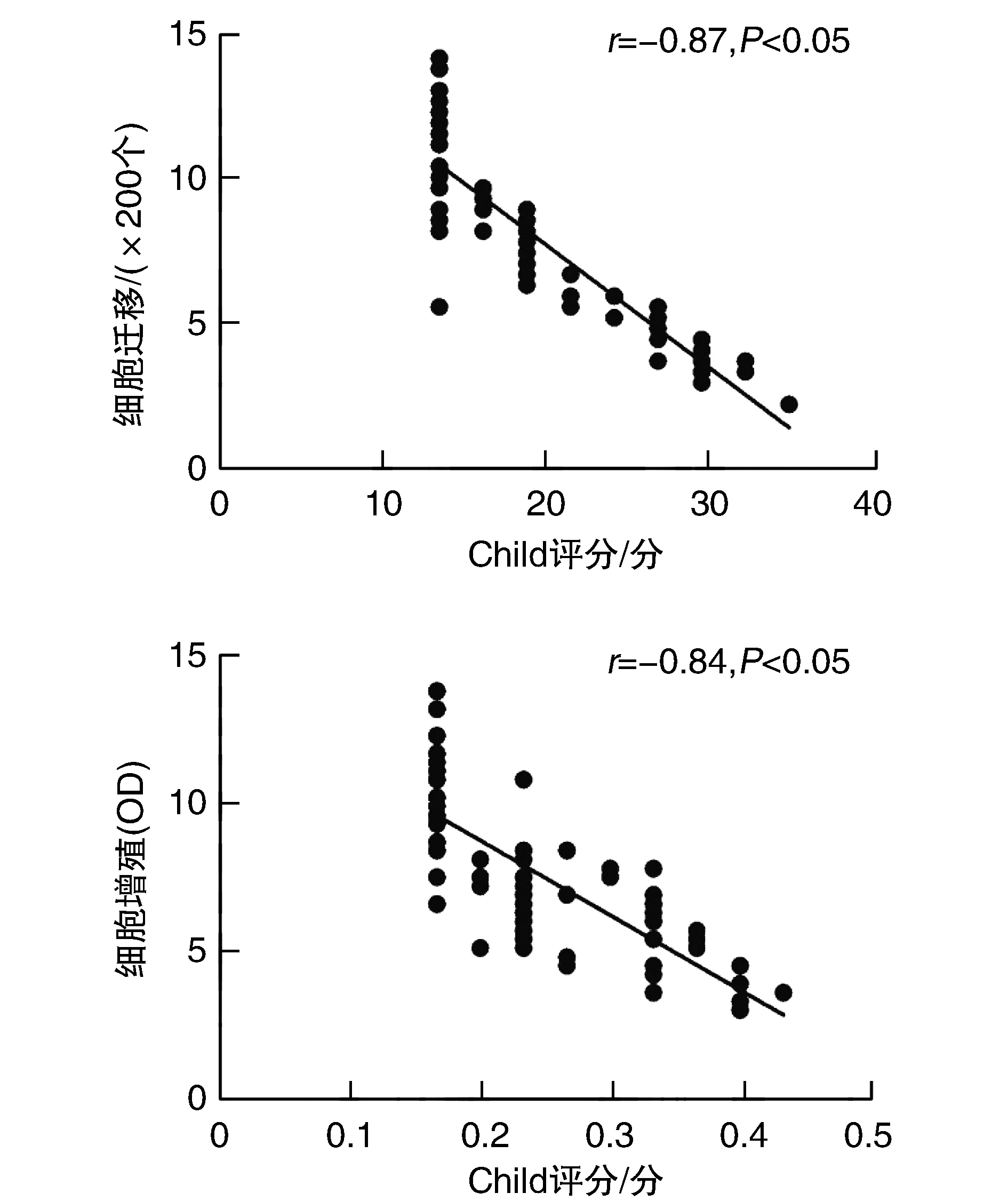
图2 乙型肝炎肝硬化患者循环EPC功能与Child-Pugh评分的相关性
3 讨 论
本研究发现,乙型肝炎肝硬化早期(Child-Pugh A、B级)患者循环EPC数量较对照组上升,而晚期(Child-Pugh C级)患者EPC数量较对照组轻微上升,较早期却下降;EPC数量与Child-Pugh评分之间没有相关性,而EPC迁移、增殖能力与Child-Pugh评分呈负相关。因此推论,在肝硬化形成以后,随着肝硬化结节的产生,肝小叶正常结构破坏,肝脏微循环系统也受到损伤。这些变化都可能导致门脉高压产生,引起血管内皮损伤和微循环障碍。机体为修复受损的血管内皮,加强从骨髓募集、动员EPC,从而使循环EPC数量增加。该过程可能是机体修复肝损伤及肝纤维化的一种代偿机制。而乙型肝炎肝硬化晚期患者已处于严重耗竭状态,并发腹水、黄疸、肝性脑病等多种并发症,骨髓功能亦受到影响,无法动员足够EPC修复肝脏,导致EPC水平较早期出现下降。这种下降趋势,可能导致微循环障碍难以修复,与肝硬化的进展相互促进。
本结果还显示,乙型肝炎肝硬化患者循环EPC功能呈下降趋势,且随着Child-Pugh评分上升EPC功能下降更为明显。乙型肝炎肝硬化发生后,肝脏功能受到损伤,肝脏代谢功能和合成功能紊乱,导致胆红素升高,脂质代谢异常及各种有毒物质蓄积,导致EPC功能出现障碍。同时,也可能是乙型肝炎肝硬化晚期EPC数量减少,EPC功能障碍,对肝脏血管内皮修复及血管新生造成影响,从而进一步促进了肝硬化的进展。
有研究与本研究结果一致,认为肝硬化患者循环EPC功能降低[6],EPC数量上升[7]。然而,也有研究认为,肝硬化患者循环EPC数量下降[8-9],EPC功能增强[10]。本研究认为,不同结果可能与入组病例肝硬化的病因不一致,或者其他研究未对肝硬化严重程度进行分级有关。不同原因肝硬化有不同发病机制,不同肝硬化严重程度患者的肝功能水平不同,并发症不同,导致EPC募集、动员能力及功能必定也会出现改变。本研究入组患者均为乙型肝炎肝硬化患者,且按照国际公认的Child-Pugh分级进行研究,从而减少了研究偏倚。
总之,本研究发现,肝硬化患者循环EPC数量上升,EPC功能降低。以EPC为治疗靶点,提高其数量及功能,有可能达到修复肝损伤及阻止肝硬化恶化的目的。以EPC为靶点的乙型肝炎肝硬化治疗策略,如EPC移植,应该得到重视及进一步的研究。
