微小核糖核酸-1256抑制后的钙结合蛋白39上调激活腺苷酸活化蛋白激酶信号传导保护人成骨细胞免受地塞米松诱导的氧化损伤
2022-06-29陈维杨郝跃东王守国季峰
陈维杨,郝跃东,王守国,季峰
长期或持续使用地塞米松(dexamethasone,Dex)可对人成骨细胞产生直接的细胞毒性,是人类骨质疏松甚至骨坏死的主要因素之一,了解Dex诱导成骨细胞损伤的病理机制有助于制定新的干预策略[1-4]。早期研究表明,激活腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)级联反应可以使细胞在应激条件下存活[5]。AMPK诱导的细胞保护机制不同,活化的AMPK能够通过抑制消耗并促进合成来增加烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的含量,从而保护人体细胞免受氧化损伤[6]。此外,AMPK 可以激活其下游核因子E2 相关因子2(NFE2-related factor 2,Nrf2)在不同细胞中的级联反应,并抑制活性氧(reactive oxygen species,ROS)的积累和氧化损伤[4,7-9]。
微小核糖核酸(microRNA,miRNA)是保守的小非编码RNA(non-coding RNA,ncRNA),长约22个核苷酸。miRNA 能够通过与靶向miRNA 的3'非翻译区(3′-untranslated region,3'-UTR)结合来调节基因表达,从而导致靶向miRNA翻译抑制或降解[10,11]。改变miRNA 可以激活AMPK 信号级联,从而保护成骨细胞免受Dex 的侵害。miRNA-429 诱导的蛋白磷酸酶2A 催化亚基(AMPK 的磷酸酶)沉默激活了AMPK并保护成骨细胞免受Dex的侵害[2]。此外,miR-1256使Ppm1e 沉默,激活AMPK,从而起到对Dex 诱导的成骨细胞保护作用[12]。
钙结合蛋白39(calcium binding protein,CAB39)是三聚体LKB1-STRAD-CAB39蛋白复合物的关键成分,该复合物对于STRAD 稳定和LKB1 激活(一个AMPK 激酶)是必不可少的[13]。LKB1-STRADCAB39结合能够促进LKB1从细胞核转移到细胞质,使Thr-172处的AMPKα1磷酸化[13]。沉默靶向CAB39的miRNA(miRNA-451)能够诱导CAB39 积累并激活下游的AMPK[13-15]。miRNA-1256作为一种新型的CAB39靶向miRNA,相反,抑制miRNA-1256可诱导CAB39 上调和AMPK 信号激活,从而为Dex 诱导的成骨细胞提供显著的细胞保护作用。
1 材料与方法
1.1 试剂、化学药品和抗体
Dex(Sigma-Aldrich,密苏里州圣路易斯),FBS、DMEM 和其他细胞培养试剂(Gibco,马萨诸塞州沃尔瑟姆),抗体(Cell Signaling Tech,中国北京),所有序列、病毒构建体、引物和质粒(上海基因化学有限公司,中国上海)。
1.2 细胞培养
hFOB1.19成骨细胞和原代人成骨细胞被分化和培养[16,17]。本实验方案已获得南京医科大学附属淮安第一医院伦理委员会的批准。
1.3 实时荧光定量PCR(quantitative real-time PCR,qPCR)
提取总细胞RNA,并通过反转录获得cDNA。使用描述的方案进行qPCR。
1.4 异位miR-1256过表达或抑制
将编码miR-1256前体(premiR-1256)或miR-1256反义(antagomiR-1256)的序列亚克隆到GV-369慢病毒构建体中,然后将构建体与慢病毒包膜蛋白(psPAX2 和pMD2.G)一起转染到HEK-293T 细胞中,浓缩培养上清液中的病毒lv-premiR-1256 和lv-antagomiR-1256。用慢病毒处理hFOB1.19细胞或人成骨细胞,对稳定的细胞进行嘌呤霉素筛选10~12 d,通过qPCR测试稳转细胞中成熟miR-1256的表达,对照细胞用miRNA 对照慢病毒(“miR-C”)或miRNA反义对照慢病毒(“antaC”)转染[2,7]。
1.5 RNA下拉
首先用生物素化的miR-1256模拟物或对照模拟物转染hFOB1.19细胞24 h,然后将细胞裂解物与抗生蛋白链菌素包被的磁珠一起孵育(使用Pierce Magnetic RNA下拉试剂盒[18,19])以下拉生物素捕获的RNA复合物[18],并通过qPCR检测与miR-1256结合的CAB39 mRNA,最后将其水平归一化为“输入”对照。
1.6 CAB39 3'-UTR荧光素酶报告基因活性测定
早期描述了包含CAB39 3'-UTR 的pGL4.13(luc2/SV40)构建[7]。通过脂质转染胺3000 与海肾荧光素酶载体和pRL-SV40 将构建体转染到hFOB1.19细胞,然后对hFOB1.19细胞进行所应用的遗传修饰,通过Promega试剂盒检查CAB39 3'-UTR荧光素酶报告基因的活性[20]。
1.7 细胞功能和蛋白质测定
细胞功能研究,包括通过Cell Counting Kit-8(CCK-8)进行细胞活力检测,通过台盼蓝染色进行细胞死亡检测及细胞凋亡检测,包括单链DNA(ssDNA)ELISA、核TUNEL 染色和caspase-3/-9 活性测定、NADPH活性测定[21,22]、Western blot法检测、JC-1线粒体去极化测定[2,7]。
1.8 miR模拟物的转染
将hFOB1.19细胞以50%融合度接种到六孔板中,然后用Lipofectamine 3000用500 nmol/L的miR-1256模拟物(野生型和突变体)转染48 h。
1.9 AMPKα1短发夹RNA(short hairpin RNA,shRNA)
向培养的hFOB1.19细胞中加入AMPKα1 shRNA慢病毒颗粒[2],然后加入嘌呤霉素以选择稳定的细胞,Western blot法检测到稳定细胞中AMPKα1的敲除。
1.10 AMPKα1突变
先前的报道中所描述的显性负性AMPKα1(dn-AMPK-α1,T172A)构建体[1,2]转染至hFOB1.19细胞,通过嘌呤霉素(1μg/ml)筛选稳转细胞。
1.11 ROS测定
将细胞接种到六孔板,细胞用5μmol/L CellROX染色30 min,使用全自动荧光化学发光分析仪测试CellROX红色荧光强度。
1.12 统计学方法
采用SPSS 21.0 软件进行统计学分析,数据以均数±标准差表示,采用方差分析[2,7]。
2 结果
2.1 miR-1256使人成骨细胞中的CAB39沉默并抑制AMPK级联激活
TargetScan 数据库显示,miR-1256 可能在位置2265-2272(图1A)上靶向CAB39 3'-UTR,来自数据库的上下文分数百分比为98%,context++分数为-0.43,表明两者之间直接结合的百分比很高(图1A)。对miR-1256亚细胞分布的qPCR分析表明,约90%的内源性miR-1256位于hFOB1.19人成骨细胞的细胞质中(图1B),细胞核中只有约10%(图1B)。RNA下拉测定结果(图1C)证实,生物素化的miR-1256可以直接与hFOB1.19细胞中的CAB39 mRNA结合(图1C)。
为了检测miR-1256是否可以影响CAB39表达,建立了编码miR-1256前体序列(lv-premiR-1256)的慢病毒构建体,并将其转导至hFOB1.19细胞,然后在含嘌呤霉素的完全培养基中培养细胞,并建立了两个稳定的细胞系lv-premiR-1256-L1 和lv-premiR-1256-L2。在表达lv-premiR-1256的稳定hFOB1.19细胞中,成熟的miR-1256水平增加了15~20倍(图1D)。值得注意的是,miR-1256 的过表达导致hFOB1.19 细胞中CAB39 3'-UTR 荧光素酶报告基因活性急剧降低(图1E)。此外,CAB39 mRNA 水平大幅降低(图1F),CAB39蛋白表达在lv-premiR-1256表达的hFOB1.19细胞中也下调(图1G)。Western blot 结果显示,AMPKα1(Thr-172)及其下游ACC(Ser-79)的磷酸化也降低了;总AMPKα1 和ACC 的表达未改变(图1H)。miR-1256过表达后,hFOB1.19细胞中的AMPK活性也降低(图1I)。因此,miR-1256 过表达使hFOB1.19细胞中的CAB39沉默并抑制AMPK信号激活。
为了确认miR-1256 对CAB39 mRNA 的直接作用,生成了两个突变miR-1256模拟物,序列在图1J中列出。这两个突变体(即“mu1”和“mu2”),在与CAB39 3'-UTR的结合位点处具有突变(图1J)。将野生型(WT)和突变体分别转染至hFOB1.19细胞,结果显示只有WT miR-1256模拟物抑制CAB39 3'-UTR荧光素酶报告基因活性(图1K)和mRNA 表达(图1L)。这两个突变体完全无效(图1K、1L)。
在人成骨细胞中,lv-premiR-1256 感染同样可以诱导成熟的miR-1256 过表达(图1M)。结果显示,CAB39 3'-UTR 荧光素酶报告基因活性(图1N)和mRNA 表达(图1O)显著下调。miR-1256 过表达下调了CAB39 蛋白表达(图1P)和AMPKα1-ACC 磷酸化(图1Q)。这些结果表明,miR-1256直接沉默人成骨细胞中的CAB39并抑制AMPK活化。

图1 miR-1256使人成骨细胞中的CAB39沉默并抑制AMPK级联激活
2.2 抑制miR-1256诱导人成骨细胞中CAB39升高和AMPK级联激活
根据图1的结果,假设miR-1256抑制能够诱导人成骨细胞中CAB39升高和AMPK信号激活。为了检验该假设建立编码miR-1256反义序列的慢病毒构建体或lv-antagomiR-1256,并将其转导至hFOB1.19成骨细胞。按照嘌呤霉素选择程序,建立两个稳转的细胞系lv-antagomiR-1256-L1 和lv-antagomiR-1256-L2。如图2 所示,与“antaC”对照组的细胞相比,在表达lv-antagomiR-1256 的稳转hFOB1.19 细胞中成熟miR-1256表达显著降低(图2A)。相反,CAB39 3'-UTR荧光素酶报告基因活性(图2B)和mRNA表达(图2C)得到增强。此外,CAB39 蛋白在miR-1256 抑制的hFOB1.19细胞中升高(图2D)。重要的是,miR-1256抑制后,AMPKα1-ACC磷酸化(图2E)和AMPK活性(图2F)显著增加。
在人成骨细胞中,用lv-antagomiR-1256转染可显著抑制miR-1256(图2G),导致CAB39 mRNA和蛋白质表达上调(图2H、2I)以及AMPKα1-ACC 磷酸化和AMPK活性增加(图2J、2K)。结果表明,miR-1256抑制可诱导人成骨细胞中CAB39升高和AMPK级联激活。

图2 miR-1256抑制诱导人成骨细胞中CAB39升高和AMPK级联激活
2.3 miR-1256 抑制可保护人成骨细胞免受Dex 诱导的细胞毒性和细胞凋亡的影响
由于miR-1256抑制可诱导CAB39升高和AMPK级联激活,检测其潜在的对成骨细胞的保护作用。-在“antaC”对照组的hFOB1.19细胞中,通过CCK-8分析及台盼蓝染色法发现Dex(1 μmol/L,48 h)处理诱导了细胞活性的显著降低(图3A)和细胞死亡(图3B),而在lv-antagomiR-1256表达的hFOB1.19细胞中细胞毒性有明显减轻(图3A、3B)。结果表明,miR-1256抑制减弱了hFOB1.19细胞中Dex诱导的细胞毒性。
此外,在“antaC”对照组的OB-6细胞中,加入Dex干预可以发生明显的细胞凋亡:caspase-3/caspase-9活性升高(图3C、3D),TUNEL 阳性细胞核比例升高(图3E)。值得注意的是,在lv-antagomiR-1256 转染的hFOB1.19 细胞中Dex 诱导的细胞凋亡有所减少(图3C~3E)。在原代人成骨细胞中可以获得相似的结果,其中lv-antagomiR-1256 组改善了Dex 对于细胞活性的抑制(图3F)并降低了细胞死亡(图3G)。此外,在lv-antagomiR-1256 组中,caspase-3/-9 活性(图3H、3I)和TUNEL 阳性核比(图3J)均比“antaC”组降低,表示Dex诱导的细胞凋亡也受到抑制。miR-1256抑制作用保护了人成骨细胞免受Dex 诱导的细胞毒性和细胞凋亡的影响
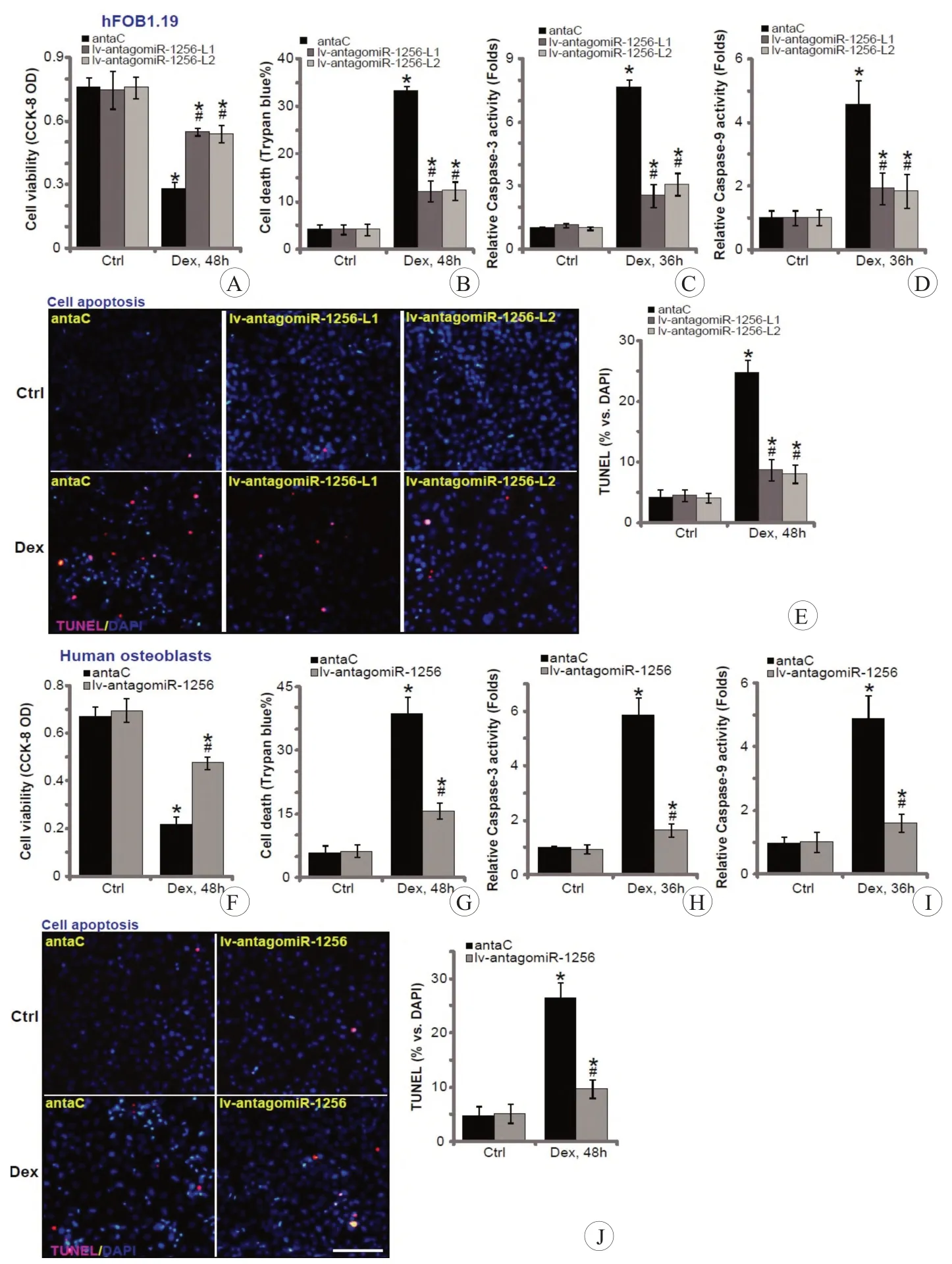
图3 miR-1256抑制作用可保护人类成骨细胞免受Dex诱导的细胞毒性和细胞凋亡的影响
2.4 miR-1256 抑制可减轻Dex 诱导的人成骨细胞氧化损伤
通过激活AMPK清除ROS可以保护成骨细胞免受Dex诱导的氧化损伤的影响。本研究结果显示,在表达lv-antagomiR-1256 的hFOB1.19 成骨细胞中,NADPH 活性显着提高(图4A)。此外,在miR-1256抑制后诱导了Nrf2 级联基因的mRNA 表达,包括HO1,NQO1和GCLC[4,7,23](图4B)。
通过使用CellROX染料分析,发现Dex处理增加了“antaC”组hFOB1.19细胞的细胞ROS含量(CellROX荧光)(图4C、4D)。此外,通过增强的TBAR 活性测试,在Dex 处理的对照hFOB1.19 细胞中检测到明显的脂质过氧化作用(图4E)。为了进一步确认氧化损伤,在hFOB1.19细胞中进行了Dex处理后,检测到了明显的线粒体去极化作用(图4F、4G)。线粒体去极化已通过JC-1 绿色单体积累进行了检测(图4F、4G)。另外,Dex处理在对照hFOB1.19成骨细胞中诱导了显著的DNA 断裂(ssDNA 积累)(图4H)。重要的是,lv-antagomiR-1256 对miR-1256 的抑制作用减弱了hFOB1.19 成骨细胞中Dex 诱导的氧化损伤(图4C~4H)。在表达lv-antagomiR-1256 的hFOB1.19 细胞中,Dex 诱导的ROS 产生(图4C、4D),脂质过氧化(图4E),线粒体去极化(图4F、4G)和ssDNA 的积累(图4H)被极大抑制。
在原代人成骨细胞中,lv-antagomiR-1256诱导的miR-1256抑制作用类似地减弱了Dex诱导的ROS产生(图4I、4J)和线粒体去极化(图4K、4L)。这些结果表明,miR-1256 抑制可减轻Dex 诱导的人成骨细胞氧化损伤。

图4 miR-1256抑制作用减轻了Dex诱导的人类成骨细胞的氧化损伤
3 讨论
Fan 等[12]的研究表明,miRNA-135b 诱导蛋白磷酸酶1E(protein phosphatase,Mg2+/Mn2+dependent 1E,PPM1E)沉默,可激活AMPK 信号传导并发挥对Dex 的成骨细胞保护作用。较长的非编码RNA MALAT1 使PPM1E 沉默并激活AMPK 级联,从而为成骨细胞提供细胞保护作用[23]。先前的研究已经表明,miR-429 使PP2A(PP2A-c)的催化亚基沉默并激活了AMPK信号传导,miR-429过表达的成骨细胞免受Dex 诱导的氧化损伤和细胞死亡的影响[2]。抑制miR-107激活AMPK依赖性Nrf2信号级联反应,从而抑制Dex诱导的hFOB1.19细胞和人成骨细胞的氧化损伤和细胞凋亡[7]。
研究发现miR-1256是人成骨细胞中靶向CAB39的新型miRNA。miR-1256 主要位于hFOB1.19 成骨细胞的胞浆中,并与CAB39 mRNA 直接相关。在hFOB1.19 成骨细胞和人成骨细胞中,异位miR-1256过表达后,CAB39 3'-UTR荧光素酶报告基因的活性以及CAB39 mRNA 和蛋白质的表达显著降低,但抑制miR-1256 能够使上述分子的活性或表达作用增强。重要的是,两个突变体miR-1256 模拟物在与CAB39 3'-UTR 的结合位点处含有突变,未能抑制hFOB1.19细胞中CAB39 3'-UTR 荧光素酶报告基因的活性和mRNA表达。因此,miR-1256直接与人成骨细胞中的CAB39结合并使其沉默。在hFOB1.19细胞和人成骨细胞中,lv-antagomiR-1256对miR-1256的抑制作用很大程度上抑制了Dex诱导的细胞死亡和细胞凋亡。
先前研究表明,化合物991(苯并咪唑衍生物的小分子AMPK激活剂)可以抑制Dex诱导的MC3T3-E1成骨细胞和原代鼠成骨细胞的氧化损伤[4]。化合物991 对AMPK 的激活增强了NADPH 的活性,并激活了Nrf2信号传导,从而抑制Dex诱导的成骨细胞氧化损伤[4]。同样,由α1 选择性激活剂化合物13 进行的AMPK 激活在很大程度上抑制了Dex 诱导的成骨细胞凋亡[1]。C13 诱导的成骨细胞的细胞保护作用与AMPK依赖的NADPH产生和ROS清除有关[1]。
lv-antagomiR-1256 诱导的miR-1256 抑制作用增加了NADPH 活性并诱导了Nrf2 级联基因的表达,从而抑制了Dex 诱导的hFOB1.19 细胞和人成骨细胞的氧化损伤。另外,在lv-antagomiR-1256 转染的hFOB1.19 细胞和人成骨细胞中,均可看到在miR-1256 被抑制后,CAB39 基因及蛋白表达上调及AMPKα1-ACC 磷酸化和AMPK 活性增加。因此,抑制miR-1256 可能是通过激活CAB39-AMPK 信号通路,发生ROS 清除和氧化应激抑制,从而起到对Dex诱导的成骨损伤的保护作用。对于Dex 诱导的成骨细胞保护的机制还有待进一步的研究。
4 结论
miR-1256抑制可以保护成骨细胞免受Dex诱导的氧化损伤,其机制可能与激活CAB39-AMPK 信号通路有关。本研究为治疗Dex 所致的成骨损伤相关疾病提供了治疗的新方向,为今后的临床应用奠定了基础。
【利益冲突】所有作者均声明不存在利益冲突
