NMRAL1对流感病毒复制的调控机制
2022-06-28严娅王广文孔凡迪王旭远王一涵李俊平赵玉辉李呈军陈化兰姜丽
严娅,王广文,孔凡迪,王旭远,王一涵,李俊平,赵玉辉,李呈军,陈化兰,姜丽
NMRAL1对流感病毒复制的调控机制

中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室,哈尔滨 150069
【目的】流感病毒是一种人兽共患病原,常引起大流行,给人类健康造成巨大威胁,且流感病毒易发生变异,能不断逃逸宿主细胞的免疫反应,对现有抗流感药物产生耐药性,因此寻找抵抗流感的新方法迫在眉睫。研究通过探索NMRAL1(NmrA-like family domain-containing protein 1)对流感病毒复制的影响,并揭示其发挥作用的分子机制,为抗流感药物研发提供潜在靶点。【方法】采用siRNA干扰技术在A549细胞中下调表达NMRAL1,并通过Western Blot检测siRNA干扰后NMRAL1的表达水平;在下调表达NMRAL1的细胞中,分别感染A/Anhui/2/2005 (AH05) (H5N1)和A/WSN/33 (H1N1) 两株不同亚型流感病毒,利用蚀斑试验检测感染病毒后24和48 h细胞上清中的病毒滴度。为确定NMRAL1影响流感病毒复制的具体阶段,在HEK293T细胞中瞬时转染NMRAL1-Myc-pCAGGS质粒过表达NMRAL1,通过双荧光素酶报告系统检测过表达NMRAL1对流感病毒聚合酶活性的影响;使用免疫荧光技术对流感病毒NP蛋白进行染色,通过激光共聚焦试验观察下调表达NMRAL1对感染病毒后3、4、5、6和8 h NP蛋白在被感染细胞中的定位情况的影响,判断下调表达NMRAL1是否影响流感病毒的入核和出核过程;利用Western Blot检测下调表达NMRAL1对流感病毒各病毒蛋白表达的影响和对流感病毒激活I型干扰素通路下游IFN刺激基因(ISGs)表达的影响,利用间接免疫荧光试验进一步研究NMRAL1对流感病毒复制的影响。【结果】Western Blot检测发现NMRAL1 siRNA能显著下调NMRAL1表达,在下调表达NMRAL1的A549细胞中分别感染H5N1和H1N1病毒,并通过蚀斑试验检测感染病毒后细胞上清中的病毒滴度,结果显示在下调表达NMRAL1的细胞中,感染流感病毒后24和48 h收取的细胞上清中病毒滴度显著下降,表明NMRAL1能促进不同亚型流感病毒的复制;为进一步探索NMRAL1调控流感病毒复制的具体机制,利用双荧光素酶报告系统检测流感病毒聚合酶活性,发现过表达NMRAL1对流感病毒聚合酶活性无明显影响;激光共聚焦试验结果显示下调NMRAL1表达不影响NP蛋白的入核和出核过程,同时Western Blot检测表明下调NMRAL1表达不影响各病毒蛋白的表达;但荧光定量PCR试验结果显示下调NMRAL1表达能够促进流感病毒感染诱导的IFN-β mRNA水平上升,且Western Blot检测发现下调表达NMRAL1促进I型干扰素通路下游的MxA和IFITM3抗病毒蛋白的表达,与此同时,间接免疫荧光试验结果显示下调NMRAL1表达可显著抑制流感病毒复制。【结论】在流感病毒感染过程中,NMRAL1不影响流感病毒的入侵以及转录翻译过程,而是通过抑制I型干扰素通路激活从而抑制MxA、IFITM3等抗病毒因子的表达,最终促进流感病毒复制。研究证实宿主因子NMRAL1正调控流感病毒的复制,丰富了参与流感病毒复制的宿主因子网络。
NMRAL1; 流感病毒; 病毒复制; IFN-β; 抗病毒基因
0 引言
【研究意义】A型流感病毒属于正黏病毒科流感病毒属,其基因组由8个单股负链RNA组成,依次编码PB2、PB1、PA、HA、NP、NA、M1、M2、NS1和NS2这10种必需蛋白,除此之外,还编码多种非必需的附件蛋白[1-2]。根据流感病毒表面的血凝素(HA)和神经氨酸酶(NA)的抗原性不同,可分为18种HA亚型和11种NA亚型[3-4]。由于HA和NA易发生抗原漂移和抗原转变,流感病毒常发生变异[5],而快速变化的流感病毒给流感的防控带来了巨大挑战。流感病毒感染细胞需要依次经过吸附、内吞、膜融合、vRNP复合体入核、转录翻译、组装和释放过程,而这一系列过程的顺利完成离不开众多宿主因子的作用[6-7]。因此,从宿主因子的角度出发,探索宿主因子在流感病毒复制过程中发挥的作用,能够为寻找抗流感药物提供潜在靶点,为流感的防控提供理论基础。【前人研究进展】宿主因子NMRAL1是一种氧化还原传感器蛋白,主要定位于细胞核。目前已有文献报道NMRAL1可以负调控TNFα(tumour necrosis factor alpha)和IL-1(Interleukin 1)引发的NF-κB信号通路[8-10],此外,NMRAL1还可负调控细胞抗病毒RIG-I(retinoic acid inducible gene I)样受体信号通路[11],但NMRAL1对IFN-β的负调控作用主要依赖于其对RIG-I样受体信号通路的影响[12]。在病毒感染机体后,NMRAL1可与TRAF3相互作用,并与OTUB1协同作用,从TRAF3中去除Lys63连接的聚泛素链,从而减少IKKε的募集,导致IKKε和IRF3磷酸化水平降低,最终降低IFN-β产生[13-14],NMRAL1正是通过此途径减弱仙台病毒(SeV)刺激引起的IFN-β的分泌和细胞的抗病毒反应。Ⅰ型干扰素在抗病毒天然免疫中发挥重要作用,是宿主对抗病毒感染强大的工具,不仅能诱导大量下游抗病毒基因的表达、直接抑制病毒复制、清除病毒感染的细胞,也能促进树突状细胞的成熟,从而促进抗病毒适应性免疫的产生[15]。(MX dynamin like GTPase 1)和(interferon-induced transmembrane protein 3)属于干扰素诱导基因,可以被干扰素和病毒诱导表达,发挥抗病毒作用[16]。MxA蛋白由编码,通过在受感染的呼吸道上皮细胞中触发快速的炎症反应来抑制流感病毒的复制[17], 此外,有研究表明MxA可能抑制病毒RNP的核输入和病毒RNA的合成[18-20];IFITM3可抑制多种囊膜病毒的入侵,包括抑制流感病毒入侵的膜融合阶段[21]。由于MxA和IFITM3是被干扰素诱导表达的抗病毒蛋白,因此检测两种蛋白的表达水平也是验证干扰素通路是否被激活的一个指标。【本研究切入点】NMRAL1可减弱SeV刺激引起的IFN-β的分泌和细胞的抗病毒反应,此外,还有文献报道过表达NMRAL1的HEK293T细胞可削弱MAVS、TBK1、TRAF3和IKKε介导的抗病毒反应,降低细胞对水疱性口炎病毒(VSV)感染的抵抗力,导致VSV传播增加[13];但目前尚无NMRAL1影响流感病毒复制的相关报道。【拟解决的关键问题】探究NMRAL1对流感病毒复制的影响,阐明NMRAL1影响流感病毒复制的分子机制,丰富流感病毒复制相关的宿主因子网络,为防控流感提供新思路。
1 材料与方法
1.1 细胞、菌株、病毒株及质粒
A549、HEK293T、MDCK细胞均购自ATCC公司;DH5α感受态细胞由兽医生物技术国家重点实验室制备;A/Anhui/2/2005 (AH05) (H5N1)和A/WSN/33 (H1N1)毒株由该实验室保存;NMRAL1-Myc-pCAGGS、WSNPB2-pCAGGS、WSNPB1-pCAGGS、WSNPA- pCAGGS和WSNNP-pCAGGS质粒为兽医生物技术国家重点实验室构建保存。本研究于2019—2021年在中国农业科学院哈尔滨兽医研究所生物安全二级和三级实验室进行。
1.2 抗体及试剂
鼠抗PB2、PB1、PA、NP单克隆抗体均由兽医生物技术国家重点实验室制备,兔抗NMRAL1多克隆抗体、兔抗MxA多克隆抗体购自Proteintech公司,兔抗IFITM3多克隆抗体购自GeneTex公司,Alexa FluorTM488 goat anti- mouse IgG(H+L)、Alexa Fluor 633TMgoat anti-mouse IgG(H+L)购至Thermo Fisher 公司;siRNA由吉玛公司合成;Lipofectamine ® LTX and Plus Reagent、RNAiMax Transfection Reagent转染试剂购自Invitrogen 公司,2×ChamQ Universal SYBR qPCR Master Mix、HiScript® RII Q RT SuperMix for qPCR (+gDNA wiper)均购自Vazyme公司,Opti-MEM培养基、10×MEM 培养基、Sodium Bicarbonate(7.5%)、MEM Amino Acids、MEM Vitamin、L-Glutamin、PenStrep购自Gibco公司,F-12K 培养基购自WISENT公司,DMEM 培养基购自Sigma公司;质粒小量提取试剂盒购自Axygen公司,质粒中提试剂盒购自QIAGEN公司,RNA提取试剂盒购自TIANGEN公司,激光共聚焦培养皿购自NEST公司。
1.3 引物及siRNA序列
引物及siRNA序列详情见表1。
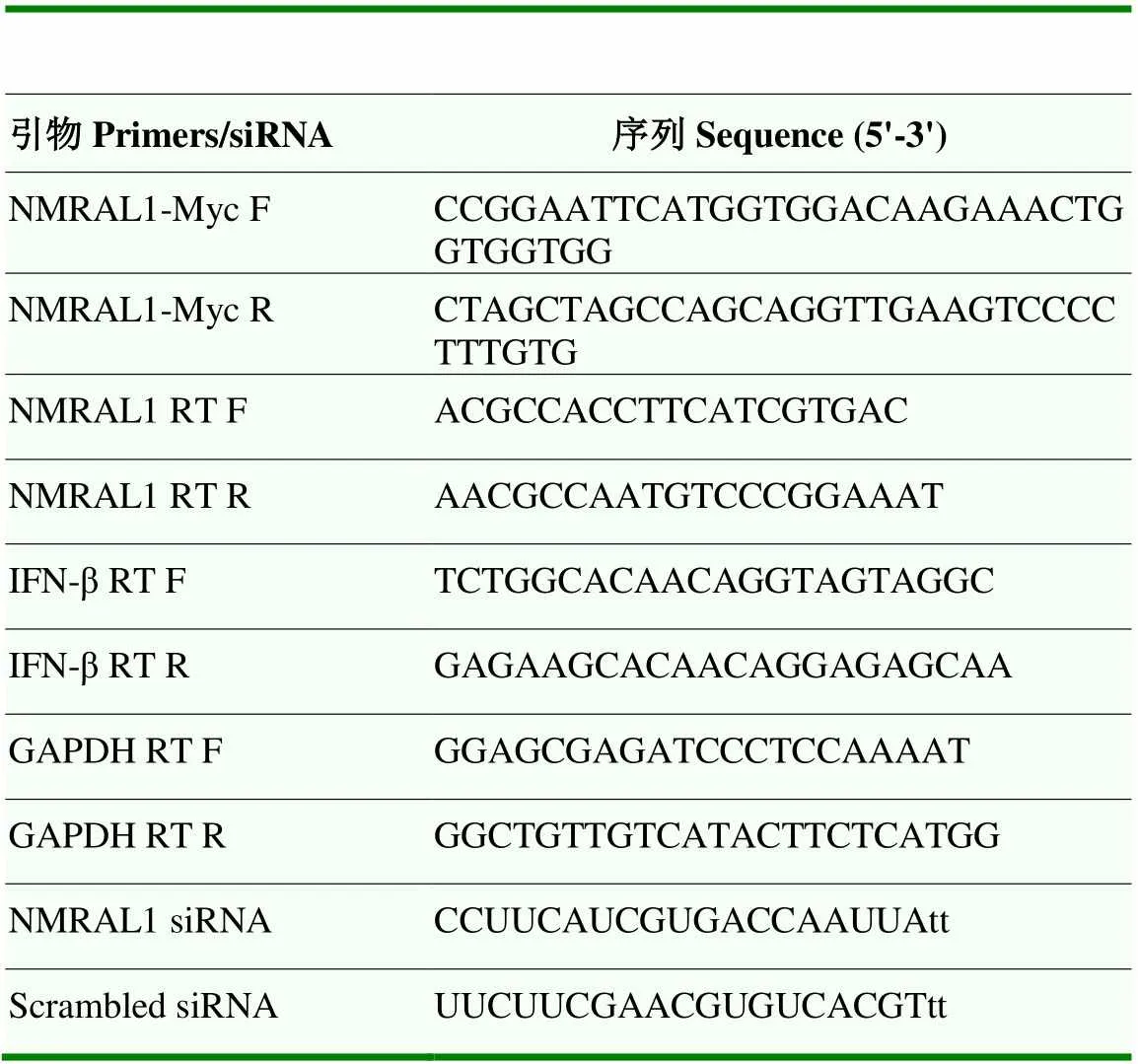
表1 引物及siRNA序列
1.4 Western Blot检测siRNA干扰效率
在A549细胞中进行siRNA干扰试验,将1.5 μL 20 μmol·L-1的Scrambled siRNA或NMRAL1 siRNA与3 μL RNAiMax Transfection Reagent转染试剂在50 μL Opti-MEM中混匀,室温孵育15 min。将胰酶消化后的A549细胞均匀铺于12孔细胞培养板中,将孵育的混合物均匀滴在细胞中,置于5% CO2、37℃培养箱中培养。36 h后,用1×蛋白上样缓冲液裂解细胞,收取的样品用95℃金属浴处理10 min。将变性后的蛋白样品进行Western Blot检测,使用GenScript快速湿转仪将蛋白转印至NC膜,5%脱脂乳室温封闭1 h,兔抗NMRAL1多克隆抗体(按1﹕500稀释)4℃过夜孵育,PBST洗涤3次,再使用DyLight 800-labeled Antibody to Rabbit IgG (H+L)(按1﹕5 000稀释)二抗室温孵育1 h,PBST洗涤3次,最后用近红外扫描系统扫描成像。
1.5 蚀斑滴定
在A549细胞中分别转染Scrambled siRNA、NMRAL1 siRNA,36 h后分别感染A/Anhui/2/2005 (AH05)(H5N1)(MOI=0.1)和A/WSN/33(H1N1)(MOI=0.01)病毒,在24 h和48 h收取上清,于-80℃保存。将MDCK细胞按合适比例铺于12孔细胞培养板,待细胞密度达90%—100%时,将上清液用1×MEM/BSA按10倍倍比稀释至合适浓度,然后加入MDCK细胞中感染1 h,弃掉病毒液后换成1 mL 1%琼脂糖/1×MEM/BSA,48 h后用4%多聚甲醛固定,统计蚀斑数量。
1.6 聚合酶活性检测
在HEK293T细胞中瞬时转染NMRAL1-Myc- pCAGGS质粒24 h后,再转染WSNPB2-pCAGGS、WSNPB1-pCAGGS、WSNPA-pCAGGS、WSNNP-pCAGGS、pHH21-SC09NS F-Luciferase和pRL-TK质粒,48 h后用1×Passive lysis buffer裂解细胞,然后将裂解液加入96孔板,先后加入Luciferase Assay Reagent和Stop&Glo Reagent试剂检测双荧光素酶活性。
1.7 激光共聚焦
在A549细胞中分别转染Scrambled siRNA和NMRAL1 siRNA,36 h后分别以MOI=5感染WSN病毒,在3、4、5、6和8 h用4%多聚甲醛进行固定。用PBS清洗两次共聚焦小皿,每次10 min;用0.5% TritonX-100通透15 min,PBS清洗两次,每次10 min;用5% BSA封闭1 h,PBS清洗两次,每次10 min;然后室温孵育鼠源NP蛋白单克隆抗体(1﹕500稀释)2 h,PBS清洗两次,每次10 min;室温避光孵育Alexa FluorTM633 goat anti-mouse IgG(H+L)(按1﹕400稀释),1 h后用PBS清洗两次,每次10 min;使用DAPI染核30 min,PBS清洗两次后用激光共聚焦显微镜观察样品,并拍照记录。
1.8 qPCR试验
在A549细胞中用Scrambled siRNA、NMRAL1 siRNA进行干扰,36 h后分别以MOI=5感染WSN病毒,在2、4、6和8 h用RZ裂解液裂解细胞,按照细胞总RNA提取试剂盒说明书提取RNA。用HiScript® RII Q RT SuperMix for qPCR(+gDNA wiper)将RNA反转录为cDNA,再以该cDNA为模板,NMRAL1 RT F、NMRAL1 RT R、IFN-β RT F、IFN-β RT R、GAPDH RT F和GAPDH RT R为引物,按照2×ChamQ Universal SYBR qPCR Master Mix试剂盒说明书进行PCR反应,检测下调表达NMRAL1对流感病毒感染后IFN-β mRNA水平的影响。
1.9 Western Blot检测抗病毒基因的表达
在A549细胞中分别转染Scrambled siRNA和NMRAL1 siRNA,36 h后以MOI=0.01感染WSN病毒,分别在12和24 h用1×蛋白上样缓冲液裂解细胞,将收取的蛋白样品95℃变性处理10 min,Western Blot检测MxA和IFITM3蛋白表达水平(兔抗MxA多克隆抗体、兔抗IFITM3多克隆抗体均按1﹕1 000稀释)。
1.10 间接免疫荧光试验
在A549细胞中用Scrambled siRNA、NMRAL1 siRNA进行干扰,36 h后分别以MOI=0.01感染WSN病毒,分别在12和24 h用4%多聚甲醛室温固定样品30 min,PBS清洗两次,每次10 min;用0.5% TritonX- 100通透15 min,用PBS清洗两次,每次10 min;5% BSA封闭1 h,PBS清洗两次,每次10 min;然后4℃过夜孵育鼠源NP蛋白单克隆抗体,PBS清洗两次,每次10 min;室温避光孵育Alexa FluorTM488 goat anti-mouse IgG(H+L)(按1﹕400稀释),1 h后用PBS清洗两次,每次10 min;用DAPI染核30 min,PBS清洗两次后用倒置荧光显微镜观察样品,并拍照记录。
2 结果
2.1 NMRAL1促进流感病毒复制
在A549细胞中进行siRNA干扰试验,将Scrambled siRNA、NMRAL1 siRNA转染36 h后,裂解细胞进行Western Blot,结果发现NMRAL1 siRNA能够下调NMRAL1表达(图1-A)。将Scrambled siRNA、NMRAL1 siRNA转染至A549细胞,36 h后分别感染A/Anhui/2/2005(AH05)(H5N1)和A/WSN/33(H1N1)流感病毒,并通过蚀斑试验检测感染病毒后24和48 h的病毒复制滴度,结果显示,在24和48 h,与空白对照组相比,NMRAL1下调表达能够使H5N1病毒的复制滴度分别降低4.1倍和12.3倍,WSN病毒的复制滴度分别降低10.9倍和11.3倍(图1-B、C),表明下调NMRAL1表达抑制流感病毒复制,故NMRAL1发挥促进流感病毒复制的作用。
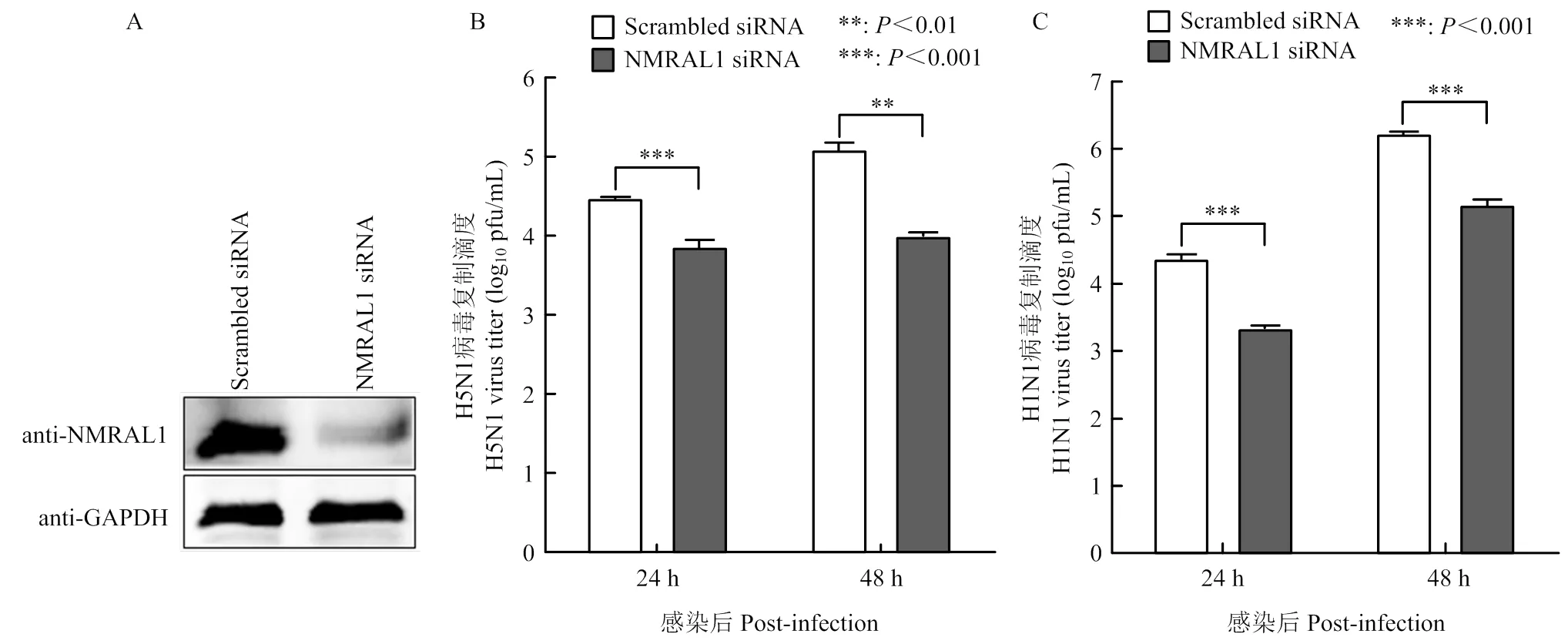
A: Western Blot检测siRNA下调NMRAL1表达效率;B: 下调表达NMRAL1对H5N1流感病毒复制滴度的影响;C: 下调表达NMRAL1对H1N1流感病毒复制滴度的影响
2.2 NMRAL1不影响流感病毒的聚合酶活性
为进一步研究NMRAL1促进流感病毒复制的具体机制,利用双荧光素酶报告系统检测过表达NMRAL1对WSN聚合酶活性的影响。在HEK293T细胞中瞬时转染NMRAL1-Myc-pCAGGS质粒,NMRAL1的表达量显著增加(图2-A)。同时发现,过表达NMRAL1对PB2、PB1、PA和NP蛋白表达量无影响(图2-B)。利用双荧光素酶报告系统检测萤火虫荧光素酶活性,同时以海肾荧光素酶活性为内参,计算流感病毒相对聚合酶活性,结果表明,瞬时转染过表达NMRAL1组的相对聚合酶活性与对照组无明显差异,因此NMRAL1不影响流感病毒的聚合酶活性。
2.3 NMRAL1不影响流感病毒NP蛋白的入核和出核
在A549细胞中用siRNA下调表达NMRAL1,36 h后将WSN以MOI=5感染细胞,分别在感染病毒后的3、4、5、6和8 h用4%多聚甲醛固定,进行激光共聚焦试验,结果显示,下调表达NMRAL1后,NP蛋白的入核及出核情况与对照组相比无明显差异(图3),故NMRAL1不影响流感病毒NP蛋白的入核和出核过程。
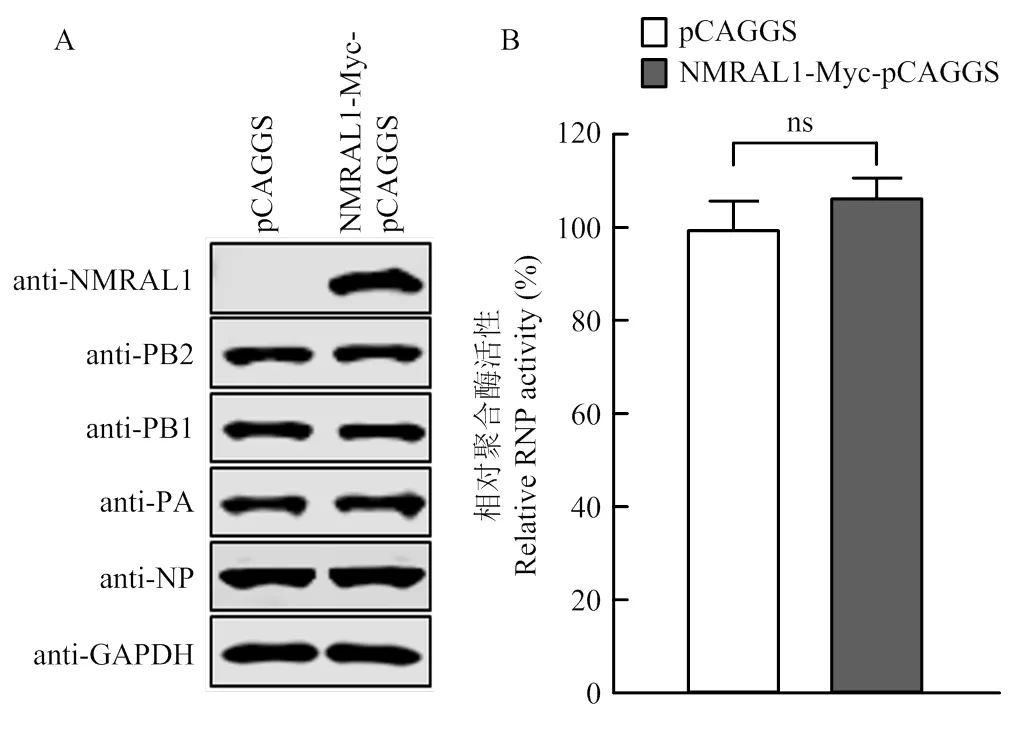
图2 HEK293T细胞中过表达NMRAL1对流感病毒聚合酶活性的影响
2.4 NMRAL1不影响流感病毒各病毒蛋白的表达
为进一步研究NMRAL1对流感病毒各个病毒蛋白的影响情况,利用siRNA下调表达NMRAL1,36 h后用WSN以MOI=5感染细胞,分别在感染病毒后的3、6和9 h用1×蛋白上样缓冲液裂解细胞,通过Western Blot检测各个病毒蛋白的表达水平,结果显示,下调表达NMRAL1的试验组中PB2、PB1、PA、HA、NP、NA、M1、M2和NS1的表达量与对照组无明显差异(图4)。以上结果表明NMRAL1对流感病毒各个病毒蛋白的表达水平无影响。
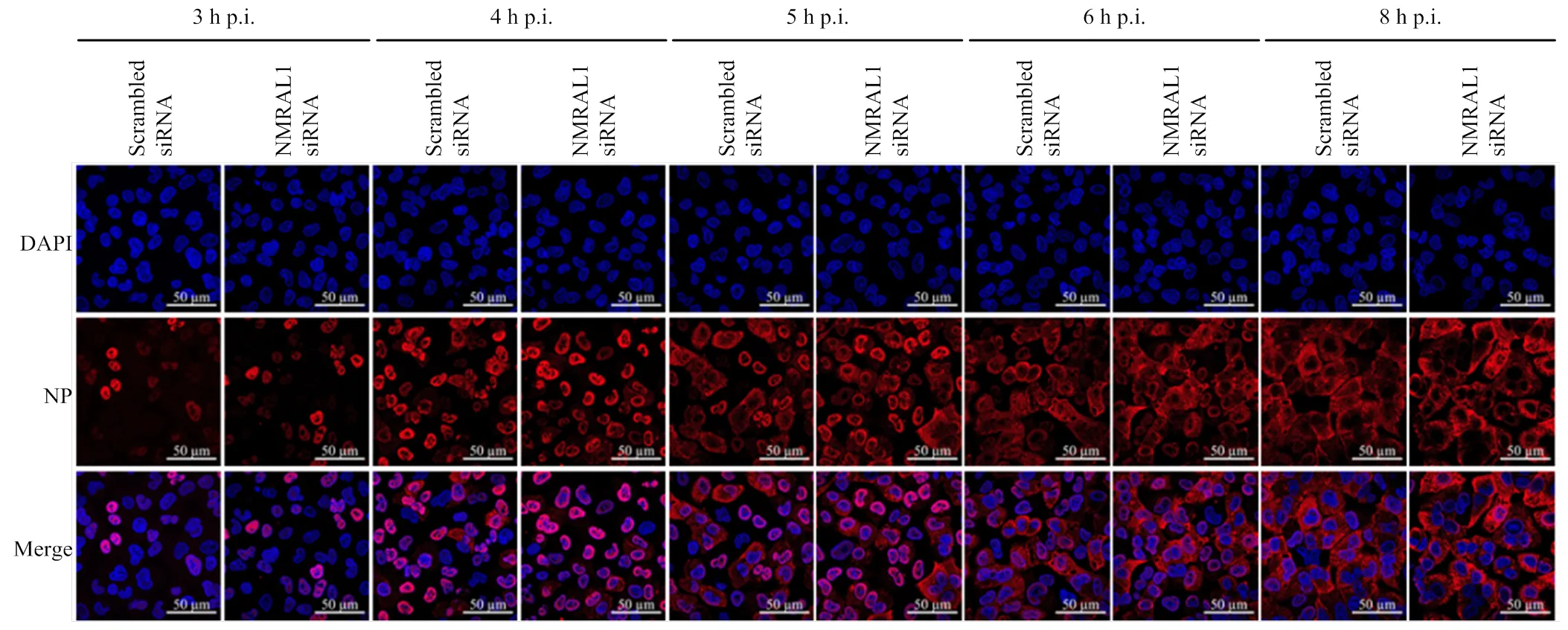
图3 A549细胞中下调表达NMRAL1对NP蛋白的入核和出核过程的影响(标尺:50 μm)
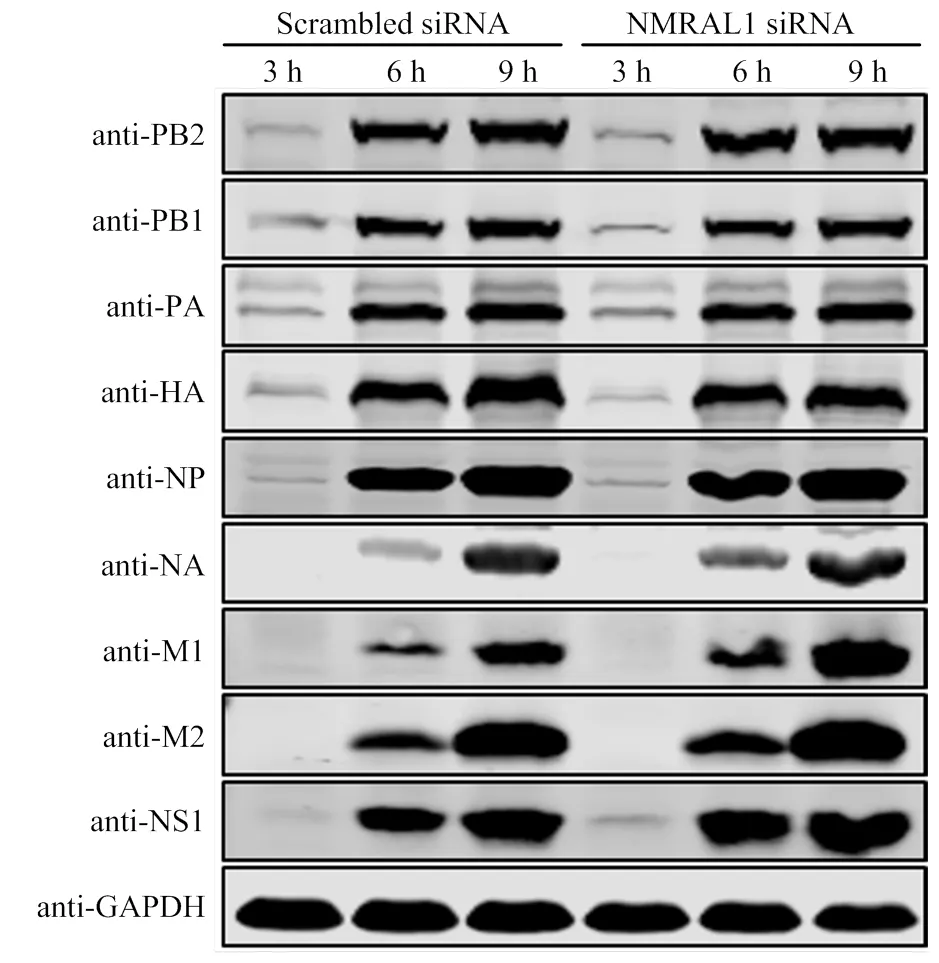
图4 A549细胞中下调表达NMRAL1对病毒蛋白表达的影响
2.5 下调表达NMRAL1显著促进流感病毒感染后IFN-β mRNA表达
已有文献报道NMRAL1可与TRAF3相互作用从而抑制IFN-β的产生[5],因此本研究利用qPCR试验检测下调表达NMRAL1对流感病毒感染后IFN-β mRNA水平的影响,荧光定量结果显示,在下调表达NMRAL1的A549细胞中感染WSN后,IFN-β mRNA表达量较对照组显著增加(图5),表明下调NMRAL1表达促进IFN-β mRNA产生。
2.6 NMRAL1通过抑制干扰素通路的激活来促进病毒复制
在下调NMRAL1表达时,以低剂量MOI=0.01感染WSN病毒,12和24 h 样品中MxA蛋白和IFITM3较对照组明显增加,而NP蛋白较对照组明显减少(图6-A);为了进一步验证下调表达NMRAL1抑制病毒复制的现象,利用间接免疫荧光观察感染低剂量WSN病毒后病毒感染率。结果发现,无论在12或24 h, 下调表达NMRAL1后病毒感染率显著低于对照组(图6-B),说明流感病毒复制受到显著抑制。以上结果表明下调表达NMRAL1刺激IFN-β mRNA表达,进而诱导MxA、IFITM3等蛋白的表达量增强以发挥抗病毒作用,从而抑制流感病毒复制。
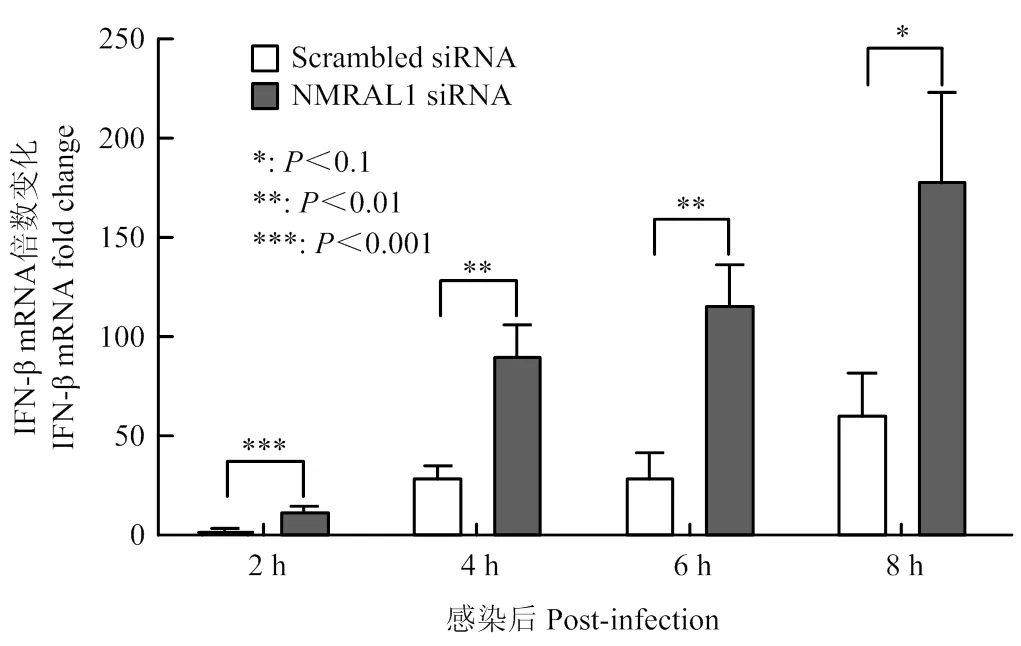
图5 A549细胞中下调表达NMRAL1对感染病毒后IFN-β表达的影响
3 讨论
流感给畜禽养殖业发展造成严重损失,同时也给人类健康带来巨大威胁,加之流感病毒容易发生变异,现有的防控手段均存在一定的缺陷,因此需要不断寻找防控流感的新方法。宿主因子在流感病毒的入侵和复制过程中至关重要[22],通过研究宿主因子与流感病毒复制的关联,有利于寻找新的抗流感药物靶点,为防控不断变异的流感病毒提供新思路。
本研究首先在A549细胞中使用siRNA干扰技术下调表达NMRAL1,再感染Anhui/2/2005(AH05)(H5N1)和A/WSN/33(H1N1)两株不同亚型的流感病毒,通过蚀斑滴定试验检测病毒感染24和48 h的病毒复制滴度,发现NMRAL1可显著促进这两种亚型流感病毒的复制。由于不同的宿主因子在流感病毒复制周期中的不同阶段发挥作用,如宿主因子SLC35A1(solute carrier family 35 member A1)是流感病毒入侵宿主细胞所必需的唾液酸转运蛋白,在流感病毒的吸附阶段发挥重要作用[23],G蛋白偶联受体FFAR2(free fatty acid receptor 2)促进流感病毒的内化[24];PLSCR1(phospholipid scramblase 1)与流感病毒NP互作,抑制流感病毒入核[25];CD151是流感病毒核输出过程中的关键宿主因子[26],为探索宿主因子NMRAL1是否也在流感病毒的某一复制阶段发挥作用,本研究首先通过双荧光素酶报告系统验证NMRAL1不影响流感病毒的聚合酶活性,表明NMRAL1不影响流感病毒的转录与翻译阶段;通过在感染病毒后不同时间点检测NP蛋白的定位情况证明NMRAL1不影响流感病毒NP蛋白的入核和出核过程;在感染病毒后3、6和9 h检测流感病毒的各病毒蛋白表达是否会受NMRAL1 表达水平影响,Western Blot结果显示,PB2、PB1、PA、HA、NP、NA、M1、M2和NS1的表达水平不受NMRAL1表达调控,以上结果表明NMRAL1不影响流感病毒复制的早期和中期阶段。由于NMRAL1可以负调节细胞抗病毒RIG-I样受体信号通路,因此本研究通过qRCR检测感染流感病毒后2、4、6和8 h IFN-β mRNA水平,发现下调NMRAL1会促进IFN-β mRNA表达。众所周知,I型干扰素和III型干扰素在宿主抵抗病毒感染的先天性免疫反应中发挥重要作用[27],IFN-α和IFN-β与IFN-α/β受体(IFNAR)相互作用,而IFN-λs与IFNL受体(IFNLR)以自分泌或旁分泌方式相互作用,从而激活Janus激酶信号转导子和激活子(JAK-STAT)信号传导途径的改变[28]。磷酸化的STAT1和STAT2与IRF9结合形成复杂的ISG因子3(ISGF3)[29]。ISGF3易位进入细胞核并与IFN刺激的反应元件结合,从而触发众多ISG的转录[30],这些基因包括、、、和等[31]。在本研究中,下调表达NMRAL1促进IFN-β mRNA表达,进而导致IFN-β分泌增加,IFN-β通过与细胞表面的干扰素受体结合向细胞内传递信号,激活ISG,通过Western Blot检测到MxA、IFITM3的表达量随着NMRAL1的下调而升高,于是这些抗病毒蛋白发挥抑制病毒复制的作用,进而导致流感病毒感染率显著减少。此外,NMRAL1被报道可通过多种途径抑制NF-κB信号通路的激活,包括通过与USP7相互作用以及抑制IKKγ泛素化来抑制NF-κB信号通路的激活[32],通过增强RelA的泛素化和降解来终止NF-κB激活[33],通过与IKKβ相互作用并且抑制其磷酸化来抑制TNF和IL-1激活NF-κB信号通路[8],因此,NMRAL1也可能通过抑制NF-κB信号通路的激活从而促进流感病毒复制,但该猜想还需要进一步试验证实。
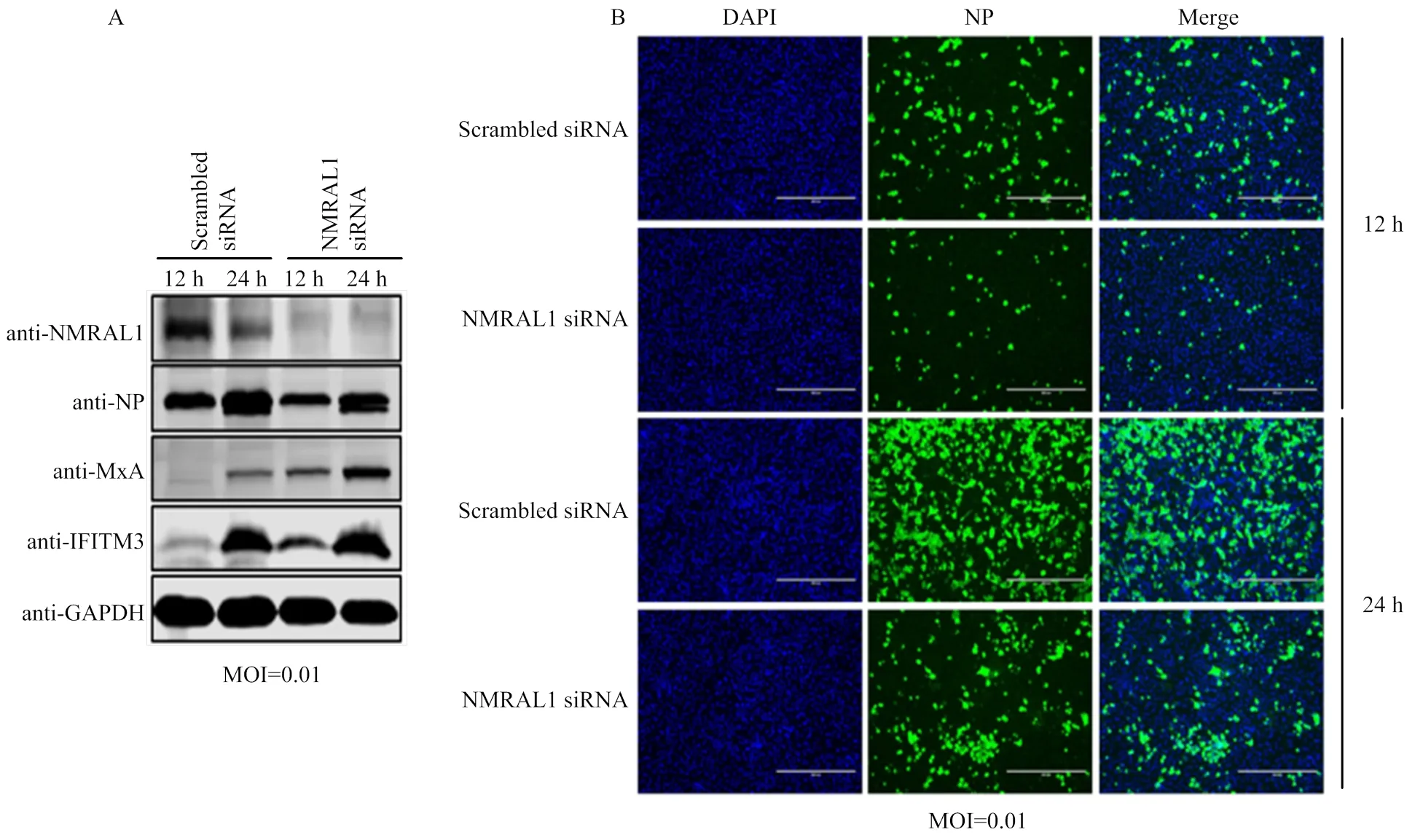
A:A549细胞中下调表达NMRAL1对感染病毒后抗病毒蛋白表达的影响;B:间接免疫荧光实验验证下调表达NMRAL1对流感病毒感染率的影响(标尺:400 μm)
4 结论
本研究阐明宿主因子NMRAL1通过抑制I型干扰素通路的激活从而抑制MxA、IFITM3等抗病毒蛋白的表达,最终促进流感病毒复制;进一步完善了对流感病毒复制相关的宿主因子的了解,为抗流感药物研究提供参考,为流感病毒的防控提供理论基础。
[1] 司振书, 王守山, 胡冬民. 禽流感病毒基因组及其编码蛋白的结构与功能. 广东农业科学, 2012, 39(1): 126-129. doi:10.16768/j.issn. 1004-874x.2012.01.003.
SI Z S, WANG S S, HU D M. Structure and function of genome and its encoding protein of avian influenza virus. Guangdong Agricultural Sciences, 2012, 39(1): 126-129. doi:10.16768/j.issn.1004-874x.2012. 01.003. (in Chinese)
[2] 罗维玉, 朱鹏阳, 张杰, 胡永浩, 孔晖晖, 梁立滨, 周圆, 李呈军, 姜丽, 陈化兰. 人源肺细胞cDNA文库构建及与流感病毒NP互作宿主蛋白的筛选. 中国农业科学, 2016, 49(22): 4451-4459. doi:10. 3864/j.issn.0578-1752.2016.22.017.
LUO W Y, ZHU P Y, ZHANG J, HU Y H, KONG H H, LIANG L B, ZHOU Y, LI C J, JIANG L, CHEN H L. Construction of cDNA library derived from human lung epithelial cell lines and screening for host cellular proteins interacting with influenza virus nucleoprotein. Scientia Agricultura Sinica, 2016, 49(22): 4451-4459. doi:10.3864/ j.issn.0578-1752.2016.22.017. (in Chinese)
[3] KOSIK I, YEWDELL J W. Influenza hemagglutinin and neuraminidase: Yin⁻Yang proteins coevolving to thwart immunity. Viruses, 2019, 11(4): 346. doi:10.3390/v11040346.
[4] WU Y, WU Y, TEFSEN B, SHI Y, GAO G F. Bat-derived influenza-like viruses H17N10 and H18N11. Trends in Microbiology, 2014, 22(4): 183-191. doi:10.1016/j.tim.2014.01.010.
[5] WU N C, WILSON I A. Influenza hemagglutinin structures and antibody recognition. Cold Spring Harbor Perspectives in Medicine, 2020, 10(8): a038778. doi:10.1101/cshperspect.a038778.
[6] EDINGER T O, POHL M O, STERTZ S. Entry of influenza A virus: Host factors and antiviral targets. The Journal of General Virology, 2014, 95(Pt 2): 263-277. doi:10.1099/vir.0.059477-0.
[7] 赵青青, 李俊平, 梁立滨, 黄山雨, 周陈陈, 赵玉辉, 王倩, 周圆, 姜丽, 陈化兰, 李呈军. 流感病毒PA蛋白与宿主蛋白PCBP1的相互作用. 中国农业科学, 2018, 51(17): 3389-3396. doi:10.3864/j.issn. 0578-1752.2018.17.013.
ZHAO Q Q, LI J P, LIANG L B, HUANG S Y, ZHOU C C, ZHAO Y H, WANG Q, ZHOU Y, JIANG L, CHEN H L, LI C J. Interaction between influenza virus PA protein and host protein PCBP1. Scientia Agricultura Sinica, 2018, 51(17): 3389-3396. doi:10.3864/j.issn.0578- 1752.2018.17.013. (in Chinese)
[8] GAN Q N, LI T T, HU B, LIAN M, ZHENG X F. HSCARG inhibits activation of NF-kappaB by interacting with IkappaB kinase-beta. Journal of Cell Science, 2009, 122(Pt 22): 4081-4088. doi:10.1242/jcs. 054007.
[9] WU Y H, CHIU D T Y, LIN H R, TANG H Y, CHENG M L, HO H Y. Glucose-6-phosphate dehydrogenase enhances antiviral response through downregulation of NADPH sensor HSCARG and upregulation of NF-κB signaling. Viruses, 2015, 7(12): 6689-6706. doi:10.3390/v7122966.
[10] ZHANG M, HU B, LI T T, PENG Y Y, GUAN J H, LAI S S, ZHENG X F. A CRM1-dependent nuclear export signal controls nucleocytoplasmic translocation of HSCARG, which regulates NF-κB activity. Traffic, 2012, 13(6): 790-799. doi:10.1111/j.1600-0854.2012. 01346.x.
[11] ZANG W C, ZHENG X F. Structure and functions of cellular redox sensor HSCARG/NMRAL1, a linkage among redox status, innate immunity, DNA damage response, and cancer. Free Radical Biology and Medicine, 2020, 160: 768-774. doi:10.1016/j.freeradbiomed.2020. 09.016.
[12] LEVY D E, GARCı́A-SASTRE A. The virus battles: IFN induction of the antiviral state and mechanisms of viral evasion. Cytokine & Growth Factor Reviews, 2001, 12(2/3): 143-156. doi:10.1016/S1359- 6101(00)00027-7.
[13] PENG Y Y, XU R D, ZHENG X F. HSCARG negatively regulates the cellular antiviral RIG-I like receptor signaling pathway by inhibiting TRAF3ubiquitination via recruiting OTUB1. PLoS Pathogens, 2014, 10(4): e1004041. doi:10.1371/journal.ppat.1004041.
[14] LI S, ZHENG H, MAO A P, ZHONG B, LI Y, LIU Y, GAO Y, RAN Y, PO T E, SHU H B. Regulation of virus-triggered signaling by OTUB1- and OTUB2-mediated deubiquitination of TRAF3and TRAF6. Journal of Biological Chemistry, 2010, 285(7): 4291-4297. doi:10.1074/jbc.M109.074971.
[15] GIBBERT K, SCHLAAK J, YANG D, DITTMER U. IFN-α subtypes: Distinct biological activities in anti-viral therapy. British Journal of Pharmacology, 2013, 168(5): 1048-1058. doi:10.1111/bph.12010.
[16] FAN W H, JIAO P T, ZHANG H, CHEN T, ZHOU X T, QI Y, SUN L, SHANG Y L, ZHU H F, HU R L, LIU W J, LI J. Inhibition of African swine fever virus replication by porcine type I and type II interferons. Frontiers in Microbiology, 2020, 11: 1203. doi:10.3389/fmicb.2020. 01203.
[17] LEE S, ISHITSUKA A, NOGUCHI M, HIROHAMA M, FUJIYASU Y, PETRIC P P, SCHWEMMLE M, STAEHELI P, NAGATA K, KAWAGUCHI A. Influenza restriction factor MxA functions as inflammasome sensor in the respiratory epithelium. Science Immunology, 2019, 4(40): eaau4643. doi:10.1126/sciimmunol. aau4643.
[18] XIAO H, KILLIP M J, STAEHELI P, RANDALL R E, JACKSON D. The human interferon-induced MxA protein inhibits early stages of influenza A virus infection by retaining the incoming viral genome in the cytoplasm. Journal of Virology, 2013, 87(23): 13053-13058. doi:10.1128/JVI.02220-13.
[19] HALLER O, STAEHELI P, SCHWEMMLE M, KOCHS G. Mx GTPases: Dynamin-like antiviral machines of innate immunity. Trends in Microbiology, 2015, 23(3): 154-163. doi:10.1016/j.tim.2014.12. 003.
[20] HALLER O, KOCHS G. Mx genes: Host determinants controlling influenza virus infection and trans-species transmission. Human Genetics, 2020, 139(6/7): 695-705. doi:10.1007/s00439-019-02092-8.
[21] DESAI T M, MARIN M, CHIN C R, SAVIDIS G, BRASS A L, MELIKYAN G B. IFITM3 restricts influenza A virus entry by blocking the formation of fusion pores following virus-endosome hemifusion. PLoS Pathogens, 2014, 10(4): e1004048. doi:10.1371/ journal.ppat.1004048.
[22] MEINEKE R, RIMMELZWAAN G F, ELBAHESH H. Influenza virus infections and cellular kinases. Viruses, 2019, 11(2): 171. doi:10.3390/v11020171.
[23] HAN J, PEREZ J T, CHEN C, LI Y, BENITEZ A, KANDASAMY M, LEE Y, ANDRADE J, TENOEVER B, MANICASSAMY B. Genome-wide CRISPR/Cas9 screen identifies host factors essential for influenza virus replication. Cell Reports, 2018, 23(2): 596-607. doi:10.1016/j.celrep.2018.03.045.
[24] WANG G W, JIANG L, WANG J L, ZHANG J, KONG F D, LI Q B, YAN Y, HUANG S Y, ZHAO Y H, LIANG L B, LI J P, SUN N, HU Y Z, SHI W J, DENG G H, CHEN P C, LIU L L, ZENG X Y, TIAN G B, BU Z G, CHEN H L, LI C J. The G protein-coupled receptor FFAR2 promotes internalization during influenza A virus entry. Journal of Virology, 2020, 94(2): e01707-e01719. doi:10. 1128/JVI.01707-19.
[25] LUO W Y, ZHANG J, LIANG L B, WANG G W, LI Q B, ZHU P Y, ZHOU Y, LI J P, ZHAO Y H, SUN N, HUANG S Y, ZHOU C C, CHANG Y, CUI P F, CHEN P C, JIANG Y P, DENG G H, BU Z G, LI C J, JIANG L, CHEN H L. Phospholipid scramblase 1 interacts with influenza A virus NP, impairing its nuclear import and thereby suppressing virus replication. PLoS Pathogens, 2018, 14(1): e1006851. doi:10.1371/journal.ppat.1006851.
[26] QIAO Y K, YAN Y, TAN K S, TAN S S L, SEET J E, ARUMUGAM T V, CHOW V T K, DE YUN WANG, TRAN T. CD151, a novel host factor of nuclear export signaling in influenza virus infection. Journal of Allergy and Clinical Immunology, 2018, 141(5): 1799-1817. doi:10.1016/j.jaci.2017.11.032.
[27] FELGENHAUER U, SCHOEN A, GAD H H, HARTMANN R, SCHAUBMAR A R, FAILING K, DROSTEN C, WEBER F. Inhibition of SARS-CoV-2 by type I and type III interferons. The Journal of Biological Chemistry, 2020, 295(41): 13958-13964. doi:10.1074/jbc.AC120.013788.
[28] COCCIA E M. IFN regulation and functions in myeloid dendritic cells. Cytokine & Growth Factor Reviews, 2008, 19(1): 21-32. doi:10.1016/ j.cytogfr.2007.10.005.
[29] YAMAGAMI M, OTSUKA M, KISHIKAWA T, SEKIBA K, SEIMIYA T, TANAKA E, SUZUKI T, ISHIBASHI R, OHNO M, KOIKE K. ISGF3with reduced phosphorylation is associated with constitutive expression of interferon-induced genes in aging cells. Npj Aging and Mechanisms of Disease, 2018, 4: 11. doi:10.1038/s41514- 018-0030-6.
[30] CHEN X Y, LIU S S, GORAYA M U, MAAROUF M, HUANG S L, CHEN J L. Host immune response to influenza A virus infection. Frontiers in Immunology, 2018, 9: 320. doi:10.3389/fimmu.2018. 00320.
[31] HOLZINGER D, JORNS C, STERTZ S, BOISSON-DUPUIS S, THIMME R, WEIDMANN M, CASANOVA J L, HALLER O, KOCHS G. Induction of MxA gene expression by influenza A virus requires type I or type III interferon signaling. Journal of Virology, 2007, 81(14): 7776-7785. doi:10.1128/JVI.00546-06.
[32] LI T, GUAN J, LI S, ZHANG X, ZHENG X. HSCARG downregulates NF-κB signaling by interacting with USP7 and inhibitingubiquitination. Cell Death & Disease, 2014, 5(5): e1229. doi:10.1038/cddis.2014.197.
[33] LIAN M, ZHENG X F. HSCARG regulates NF-kappaB activation by promoting the ubiquitination of RelA or COMMD1. The Journal of Biological Chemistry, 2009, 284(27): 17998-18006. doi:10.1074/jbc. M809752200.
Mechanism of NMRAL1 Regulating Influenza Virus Replication

State Key Laboratory Veterinary Biotechology/Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069
【Objective】Influenza virus is a zoonotic pathogen that often causes a pandemic and poses a great threat to human health, and the influenza viruses are prone to variants and can constantly escape the host cell immune response and develop resistance to existing anti-influenza drugs, so the search for new ways to fight influenza is imminent. This study aimed to explore the effect of NMRAL1 (NmrA-like family domain-containing protein 1) on influenza virus replication, and to reveal the molecular mechanism by which it functioned, so as to provide a potential target for anti-influenza drugs development. 【Method】In this study, siRNA interference technology was used to down regulate the expression of NMRAL1 in A549 cells, and the expression levels of NMRAL1 were detected by Western Blot. Virus titers in cell supernatants at 24 h and 48 h after infection with two different subtypes influenza viruses, including a/Anhui/ 2/2005(ah05)(H5N1) and a/WSN/33(H1N1), were detected using the plaque assay. To determine the specific stage at which NMRAL1 affected influenza virus replication, NMRAL1 was overexpressed by transiently transfecting NMRAL1-Myc-pCAGGS plasmid in HEK293T cells, and the effect of overexpressing NMRAL1 on influenza virus polymerase activity was examined by luciferase reporter system. The influenza virus NP protein was stained by using immunofluorescence, and the down-regulated expression of NMRAL1 on the localization of NP protein at 3, 4, 5, 6 and 8 h post infection was assessed respectively by confocal assay to determine whether down-regulated expression of NMRAL1 affected the process of influenza virus vRNP import and export. Western Blot was used to detect the effect of NMRAL1 knockdown on the expression of viral proteins and on the expression of IFN stimulated genes (ISGs) downstream of type I interferon pathway activated by influenza virus. Indirect immunofluorescence assay was utilized to further verify the effect of NMRAL1 on influenza virus replication. 【Result】Western Blot assay showed that NMRAL1 siRNA could significantly down regulate NMRAL1 expression in A549 cells. With the down-regulated expression of NMRAL1, A549 cells were infected with H5N1 and H1N1 viruses, respectively. Then the virus titers in the cell supernatant were measured by plaque assay, which showed that the virus titers in the supernatant of cells at 24 and 48 h after infection with H5N1 or H1N1 were significantly decreased, meaning that NMRAL1 could promote the replication of different subtypes influenza viruses. To further explore the specific mechanism by which NMRAL1 regulated influenza virus replication, a luciferase reporter system was used to detect influenza virus polymerase activity, and it was found that the overexpression of NMRAL1 had no effect on influenza virus polymerase activity. The results of confocal assay showed that the down-regulated expression of NMRAL1 did not affect the process of NP nuclear import and export, meanwhile Western Blot assay indicated that down-regulated expression of NMRAL1 did not affect the expression of each viral protein. However, the results of the fluorescence quantitative PCR assay showed that down-regulated expression of NMRAL1 was able to promote the up-regulation of IFN-β mRNA levels induced by influenza virus infection, and Western Blot assay found that down expression of NMRAL1 promoted the expression of MxA and IFITM3 antiviral proteins downstream of type I interferon pathway. Meanwhile, the indirect immunofluorescence assay showed that the down expression of NMRAL1 could significantly inhibit influenza virus replication. 【Conclusion】 Those results demonstrated that, during influenza virus infection, NMRAL1 did not affect the process of influenza virus invasion as well as transcription translation, but rather inhibited the expression of antiviral factors, such as MxA and IFITM3, by inhibiting type I interferon pathway activation, which ultimately promoted influenza virus replication. This study confirmed that the host factor NMRAL1 positively regulated influenza virus replication and enriched the network of host factors involved in influenza virus replication.
NMRAL1; influenza virus; virus replication; interferon β; antiviral gene
2021-03-09;
2021-05-14
国家自然科学基金创新群体项目(31521005)、中国博士后科学基金(2019M660897)
严娅,Tel:18845097603;E-mail:yanhs2019@163.com。通信作者姜丽,Tel:0451-51051678;E-mail:jiangli@caas.cn
10.3864/j.issn.0578-1752.2022.10.016
(责任编辑 林鉴非)
