miR-221靶向IRS1抑制绵羊乳腺上皮细胞活力和增殖
2022-06-28柯娜郝志云王建清甄慧敏罗玉柱胡江刘秀李少斌赵志东黄兆春梁维炜王继卿
柯娜,郝志云,王建清,甄慧敏,罗玉柱,胡江,刘秀,李少斌,赵志东,黄兆春,梁维炜,王继卿
miR-221靶向抑制绵羊乳腺上皮细胞活力和增殖

甘肃农业大学动物科学技术学院/甘肃省草食动物生物技术重点实验室/甘肃省牛羊基因改良工程实验室,兰州 730070
【背景】MicroRNAs(miRNA)是一类小RNA分子(18—23nt),广泛参与了家畜乳腺发育和泌乳性能的调控。项目组前期在小尾寒羊上应用RNA-Seq研究发现,miR-221在空怀期乳腺组织中的表达量是泌乳期的3.6倍,但是尚不清楚miR-221对绵羊乳腺发育的调控机制。【目的】探讨miR-221是否通过靶向基因抑制绵羊乳腺上皮细胞的活力和增殖数量,为揭示miR-221对绵羊泌乳性能的分子调控机理提供理论参考。【方法】采集小尾寒羊乳腺、心脏、肝脏、肾脏、脾脏、肺脏、背最长肌和卵巢等8个组织样本,采用实时荧光定量PCR(reverse transcription-quantitative PCR, RT-qPCR)技术,构建miR-221在绵羊8个组织中的表达谱。采用细胞转染、CCK-8和Edu等方法,研究miR-221对绵羊乳腺上皮细胞活力和增殖的影响。利用miRDB和miRanda数据库,预测miR-221的靶基因,结合功能富集分析,确定目标靶基因,构建靶基因的野生型和突变型载体,进而用双荧光素酶报告实验,验证miR-221与预测靶基因间的靶向关系。分析过表达和沉默miR-221对靶基因及其信号通路下游功能基因的影响。【结果】RT-qPCR结果表明,miR-221在绵羊乳腺等8个组织中均表达,其中在肺脏和脾脏中的表达量最高,在背最长肌和肾脏中的表达量最低。CCK-8结果表明,miR-221模拟物抑制了绵羊乳腺上皮细胞的活力(<0.01),而miR-221抑制剂提高了乳腺上皮细胞的活力(<0.05)。Edu试验发现,miR-221模拟物减少了Edu标记的阳性乳腺上皮细胞数量(<0.01),而miR-221抑制剂增加了Edu标记的阳性乳腺上皮细胞数量(<0.01)。双荧光素酶报告实验结果表明,miR-221模拟物抑制了胰岛素受体底物1(insulin receptor substrate 1, IRS1)基因3′UTR区域的双荧光素酶活性(<0.01),而miR-221抑制剂提高了该基因的活性(<0.05),表明是miR-221的一个靶基因。RT-qPCR结果进一步发现,过表达miR-221降低了绵羊乳腺上皮细胞中和的表达量(<0.05),沉默miR-221则提高了这2个基因的表达量(<0.05)。过表达或沉默miR-221对乳腺上皮细胞中的表达量没有显著影响(>0.05)。【结论】miR-221通过抑制靶基因的表达量,最终抑制了绵羊乳腺上皮细胞的活力和增殖数量。
绵羊;miR-221;胰岛素受体底物1;乳腺上皮细胞
0 引言
【研究意义】母羊的泌乳性能主要包括泌乳量,以及蛋白、脂肪、乳糖、全乳固体、非全乳固体含量等乳成分在内的多个性状。泌乳性状是一类重要的经济性状,因为它显著影响了羔羊的繁殖成活率、断奶前生长速度和发育程度。腺泡中的乳腺上皮细胞是乳汁合成和分泌的唯一场所,它反复经历了增殖、分化和凋亡这一发育过程。研究表明,乳腺发育程度、乳腺上皮细胞数量及其分泌活性直接决定了母羊的产奶量和乳成分[1-3],它们受到多个功能基因和非编码RNA的调控[4-5]。【前人研究进展】MicroRNAs(miRNA)是一类小RNA分子(18—23nt),它们能通过降解或抑制作用,最终降低靶向mRNA的表达量[6-7]。研究发现,miRNAs通过参与乳腺发育[8]、上皮导管生长[9]、上皮祖细胞维持[10]、乳腺上皮细胞的增殖凋亡[11-12]等过程,最终调控了哺乳动物的泌乳量和乳成分。例如,Chu等[13]在小鼠乳腺上皮细胞中发现,过表达miR-221显著降低了其中的甘油三酯含量。相反,抑制miR-221显著增加了甘油三酯的含量。包黎娟等[14]发现miR-92a促进了奶山羊乳腺上皮细胞的凋亡,抑制了它们的增殖。王褚悦等[15]发现miR-142-3p抑制了研究也表明,在不同的乳腺发育时期或者品种间,绵羊miRNAs的表达丰度也不同。Wang等[16]发现与泌乳高峰期的母羊相比,空怀期乳腺组织中的8个miRNAs呈上调表达,15个miRNAs呈下调表达,这些miRNAs通过靶向PI3K-Akt-mTOR和Wnt等信号通路,最终参与了乳腺发育和调控。在具有不同泌乳性能的绵羊品种之间,乳腺组织中的18个miRNAs呈现出差异表达,它们的靶基因富集在MAPK、mTOR等一些与乳腺发育、乳蛋白和乳脂合成相关的信号通路上[17]。【本研究切入点】项目组前期以空怀期和泌乳期小尾寒羊为研究对象,采集它们的乳腺组织,用small RNA测序发现,miRNA-221是这两个时期乳腺组织中的差异表达miRNAs之一,它在空怀期的表达量是泌乳期的3.6倍[16],但其生物学功能和作用途径还有待深入研究。【拟解决的关键问题】在构建绵羊乳腺等8个组织中miR-221表达谱的基础上,检测其对乳腺上皮细胞活力和增殖的影响,验证miR-221与预测靶基因之间的靶向关系,分析过表达和沉默miR-221对靶基因及信号通路下游重要功能基因的影响,以期为揭示miR-221对绵羊泌乳性能的分子调控机理提供理论参考。
1 材料与方法
1.1 样品采集
2018年9月,在甘肃省天祝县松山镇金子河绵羊繁育公司,选择同一饲养管理条件下、3岁左右、第4胎、处于泌乳高峰期(产后21 d)和空怀期(产后100 d)的小尾寒羊母羊各3只(共6只),采集血液和组织样本。将5 mL颈静脉血液采集至真空抗凝采血管中,用于提取DNA,扩增靶基因的3′UTR区域;屠宰后采集乳腺,以及心脏、肝脏、肾脏、脾脏、肺脏、背最长肌和卵巢等8个组织样本,用于提取各组织的总RNA。小尾寒羊乳腺上皮细胞为项目组前期培养的第4代传代细胞,HEK293T细胞为项目组保存的细胞[3]。以下试验于2019年9月至2020年10月在甘肃农业大学动物科学技术学院甘肃省草食动物生物技术重点实验室(兰州,甘肃)完成。
1.2 RNA提取及反转录
参照王建清[3]建立的方法,提取8个组织中的总RNA,经质检后反转录生成mRNA和miRNA的cDNA。
1.3 引物设计及miR-221表达谱构建
设计miRNA特异性引物(序列见表1),以U6[3]和18sRNA[18]作为管家基因,进行RT-qPCR,用2-△△Ct法计算miR-221在乳腺等8个组织中的表达量。RT- qPCR反应体系和程序参照王建清[3]描述的方法进行。

表1 引物序列
1.4 细胞转染
将冻存的乳腺上皮细胞置于37℃水浴锅中,待其彻底解冻后,立即加入1 mL细胞培养基,然后将混合液移至含有5 mL培养基的离心管中。在1 000 r/min下离心5 min弃去上清液,获取细胞沉淀,再加入适量的新鲜培养基,轻柔混匀,将混合液转移至培养器皿中,之后根据王建清[3]描述的方法在24孔培养板上培养细胞。待这些细胞生长至70%—80%时,用INVI DNA & RNA转染试剂(Invigentech,美国),将50 nmol·L-1的miR-221模拟物(mimic)(Ⅰ组)、相应对照组miR-221 mimic-NC(Ⅱ组),以及100 nmol·L-1的抑制剂(inhibitor)(Ⅲ组)和miR-221 inhibitor- NC(Ⅳ组)分别转染至乳腺上皮细胞中,每组设置6个生物学重复。
1.5 细胞活力及增殖检测
对于其中3个生物学重复,转染46 h后,加入30 μL CCK-8试剂(碧云天, 北京),37°C培养2 h,用酶标仪器在450 nm波长下检测上清液的光密度值。
对于另外3个生物学重复,转染44 h后加入100 μL Edu试剂,37℃培养4 h,用CellLight™ Edu试剂盒(碧云天, 北京)标记增殖细胞,最后用IX73荧光倒置显微镜(Olympus,日本)拍照,并计算Edu阳性细胞的数量。
1.6 miR-221靶基因的功能注释及筛选
用miRDB和miRanda数据库预测miR-221的靶基因,并将预测结果取交集。随后,对靶基因进行GO和KEGG代谢通路分析,在调控乳汁生成、乳蛋白和乳脂合成的重要通路上,选择其中一个靶基因用于后续试验。
1.7 双荧光素酶报告试验
1.7.13′UTR区域双荧光素酶载体构建 用绵羊基因组DNA扩增靶基因-胰岛素受体底物1(Insulin Receptor Substrate 1,)的3′UTR区域(引物见表1),将纯化后的扩增产物连接至pmiR-RB-Report™载体上,构建野生型载体。用Fast mutagenesis Kit V2突变试剂盒(诺唯赞, 南京),将靶基因与miR-221结合的序列突变为其互补序列,以阻止两者的结合,最终构建突变型载体。用Sanger测序验证两种载体的正确性。
1.7.2 miR-221靶基因的验证 在细胞培养板中接种复苏后的HEK293T细胞,待细胞汇聚程度达到培养板面积的70%—80%时,将Ⅰ、Ⅱ、Ⅲ和Ⅳ组分别与100ng野生型和突变型载体质粒共转染至HEK293T细胞中,之后用双荧光素酶报告基因E1960试剂盒(Promega, 美国)和多功能酶标仪Varioskan LUX(Thermo Lifetech, 美国)测定海参酶与萤火虫酶活性。
1.8 过表达/沉默miR-221对靶基因及其通路下游重要功能基因表达量的影响
将Ⅰ、Ⅱ、Ⅲ和Ⅳ组转染至绵羊乳腺上皮细胞中,转染成功后提取细胞中的RNA。选择所在信号通路PI3K-AKT-mTOR和MAPK的下游重要基因-胰岛素样生长因子1受体(Insulin-like Growth Factor 1 Receptor,)和磷酸肌醇-3-激酶调节亚基1(Phosphoinositide-3-Kinase Regulatory Subunit 1,),以作为内参基因,用2-△△Ct法计算它们的表达量。
2 结果
2.1 miR-221的组织表达谱
RT-qPCR结果表明,miR-221在绵羊8个组织中均表达,并表现出明显的组织特异性。其表达量由高到低依次为肺脏>脾脏>卵巢>心脏>肝脏>乳腺>背最长肌>肾脏(图1-A)。
miR-221的表达也表现出明显的时序性。在绵羊乳腺组织中,它在空怀期的相对表达量(3.956 ± 0.14)是泌乳期(2.077 ± 0.12)的1.9倍(<0.01)(图1-B)。
2.2 miR-221显著影响了绵羊乳腺上皮细胞的活力和增殖能力
CCK-8试验发现,miR-221 模拟物抑制了绵羊乳腺上皮细胞的活力(<0.01),而miR-221抑制剂提高了乳腺上皮细胞的活力(<0.05)(图2-A)。
Edu检测发现,与对照组相比,将miR-221模拟物转染进乳腺上皮细胞后,Edu标记的阳性乳腺上皮细胞数量明显减少;在乳腺上皮细胞中转染miR-221抑制剂以后,Edu标记的阳性细胞数量显著增多(图2-B)。
2.3 预测靶基因IRS1的双荧光素酶报告实验验证
2.3.1 双荧光素酶载体的测序验证 构建的双荧光素酶载体经酶切后,用琼脂糖凝胶电泳检测显示,外源基因已成功连接到载体上,并且外源基因的片段大小基本与目的片段一致(图3-A)。测序进一步证实,野生型双荧光素酶载体中存在与miR-221相结合的的种子序列(图3-B),而突变型双荧光素酶载体中不存在与miR-221相结合的序列(图3-C),这表明野生型和突变型双荧光素酶载体已被成功构建。
2.3.2 预测靶基因的双荧光素酶实验验证 双荧光素酶实验结果表明,在野生型双荧光素酶载体中,miR-221模拟物降低了的双荧光素酶活性(<0.01),而miR-221抑制剂提高了该基因的双荧光素酶活性(0.05, 图4-A)。但是在突变型双荧光素酶载体中,miR-221模拟物或抑制剂对基因的双荧光素酶活性均无显著影响(>0.05, 图4-B)。上述结果表明,是miR-221的一个靶基因。
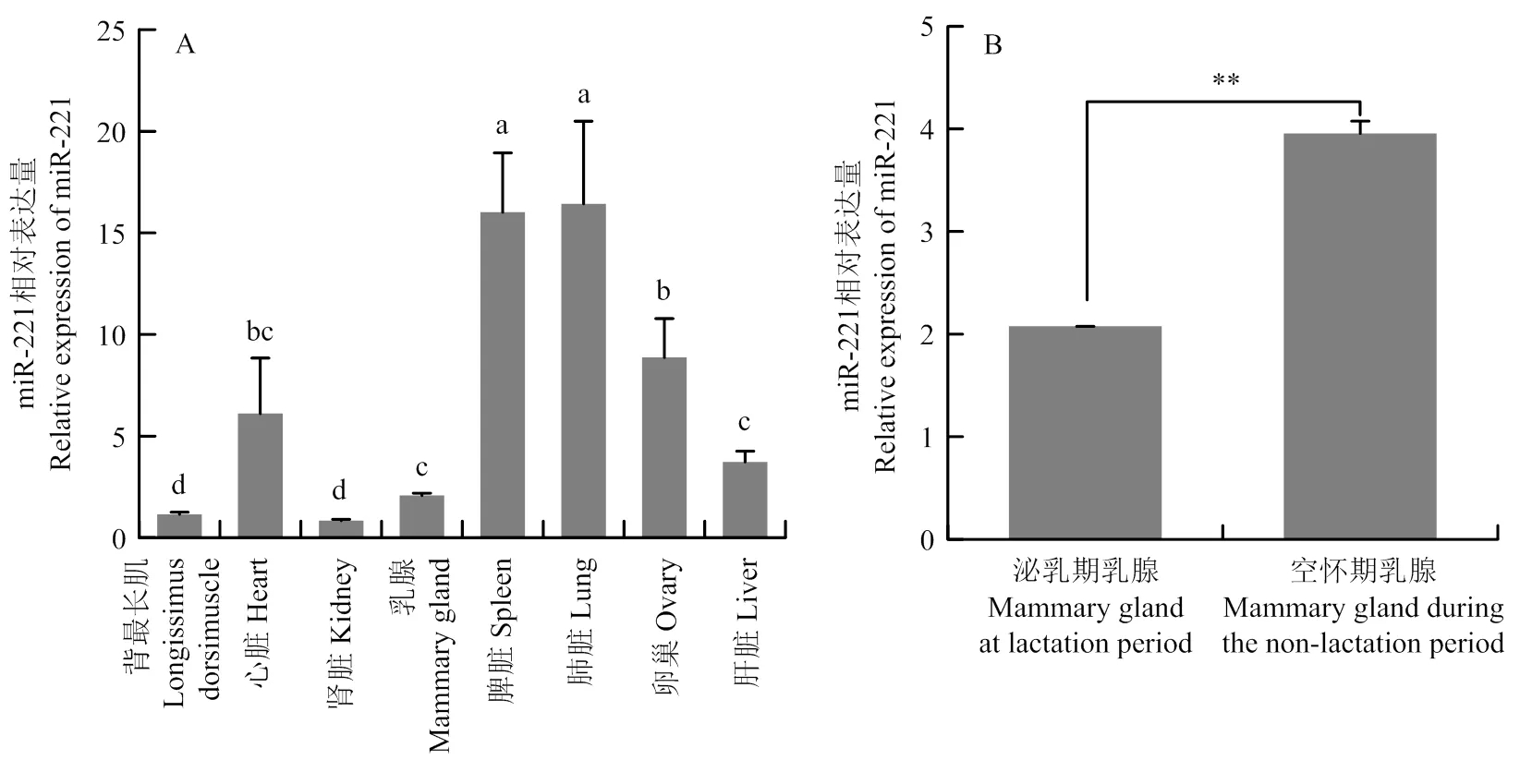
a、b、c和d等字母表示差异显著(P<0.05)。**表示P<0.01,*表示P<0.05。下同
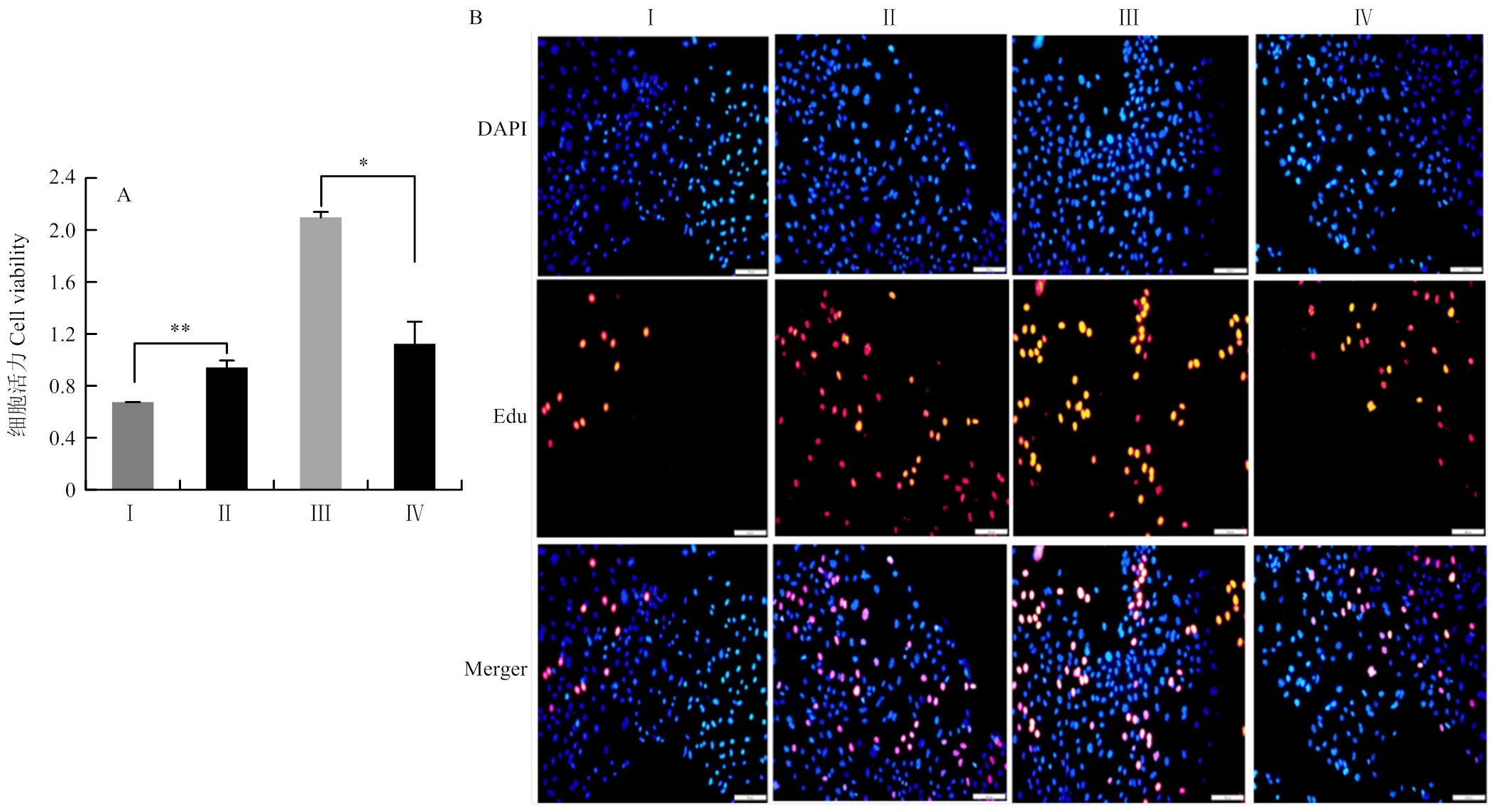
A:miR-221 mimic、mimic-NC、inhibitor和inhibitor-NC转染到乳腺上皮细胞48 h后,用CCK8实验检测细胞活性的结果;B:miR-221 mimic、mimic-NC、inhibitor和inhibitor-NC转染到乳腺上皮细胞48h后,用Edu实验分析细胞增殖的结果
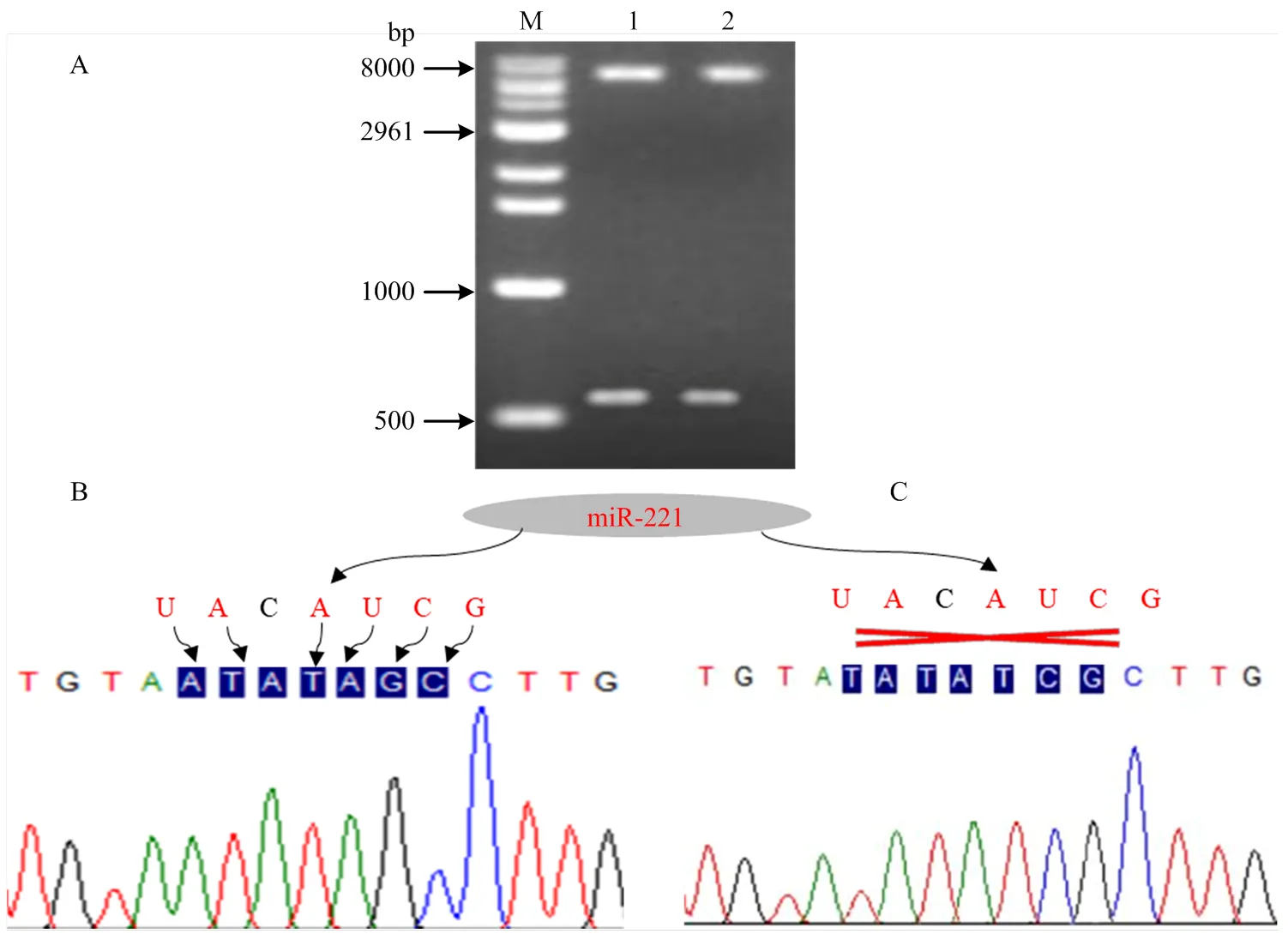
A图中泳道1和B图为野生型双荧光素酶载体的鉴定结果;A图中泳道2和C图为突变型双荧光素酶载体的鉴定结果;M:Marker
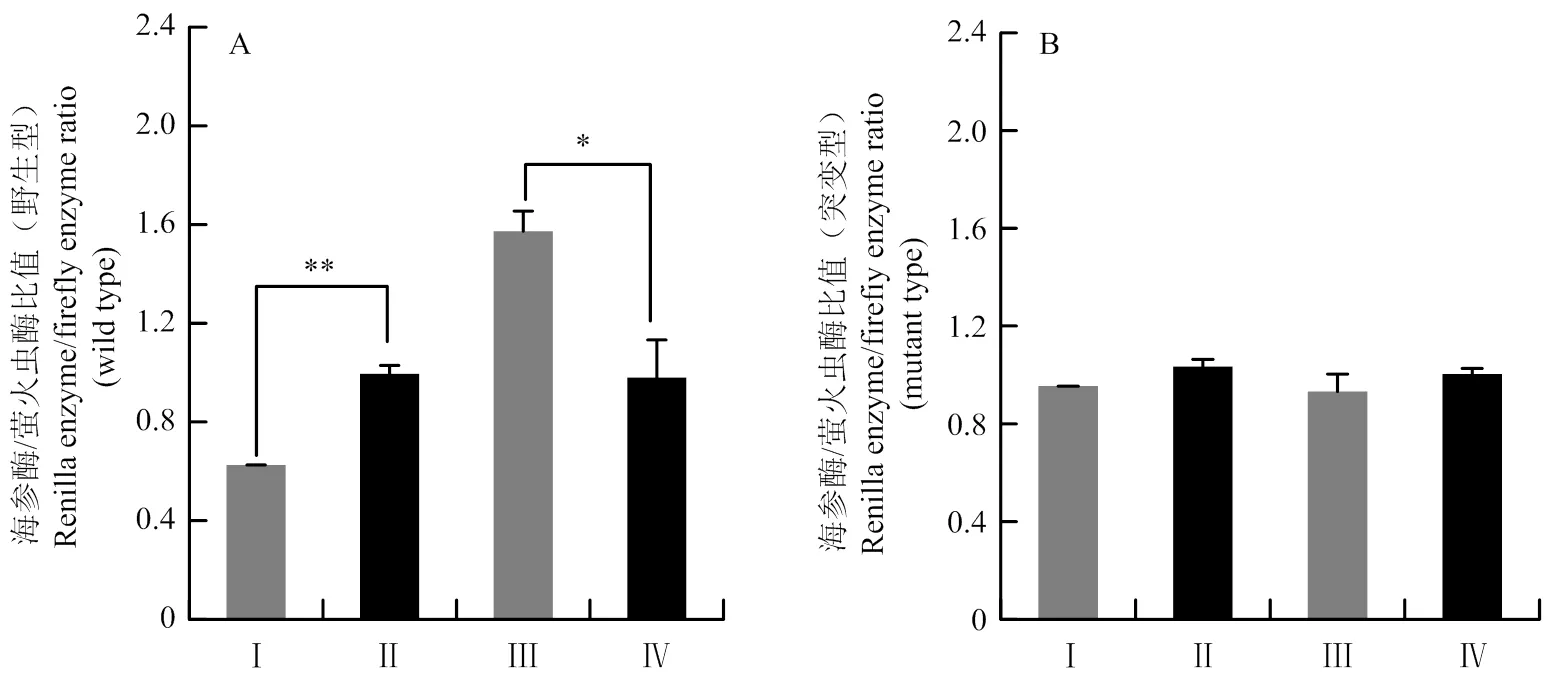
图4 在野生型(A)和突变型(B)双荧光素酶载体中,miR-221对IRS1基因双荧光素酶活性的影响
2.4 miRNA-221对功能基因表达量的影响
在绵羊乳腺上皮细胞中转染miR-221模拟物后,和基因的表达量显著降低(<0.05);转染miR-221抑制剂后,和基因的表达量显著升高(<0.05)(图5)。但是,miR-221模拟物和抑制剂对乳腺上皮细胞中的表达量没有显著影响(>0.05,图5)。
3 讨论
3.1 绵羊miR-221表达的组织特异性和时空特异性
miRNAs是真核生物中保守性较强的一类小分子RNAs,它们不编码蛋白质,但能降低靶基因的表达量。研究发现,这类RNAs在家畜乳腺生长发育、泌乳量和乳成分方面发挥了重要调控作用。项目组前期研究表明,miRNA-221调控了小尾寒羊空怀期和泌乳期的乳腺组织发育[16],但并未深入研究其分子机理。本研究构建了miR-221在绵羊8个组织中的表达谱,通过靶基因验证以及对乳腺上皮细胞的影响,研究了它的分子生物学功能和作用途径。
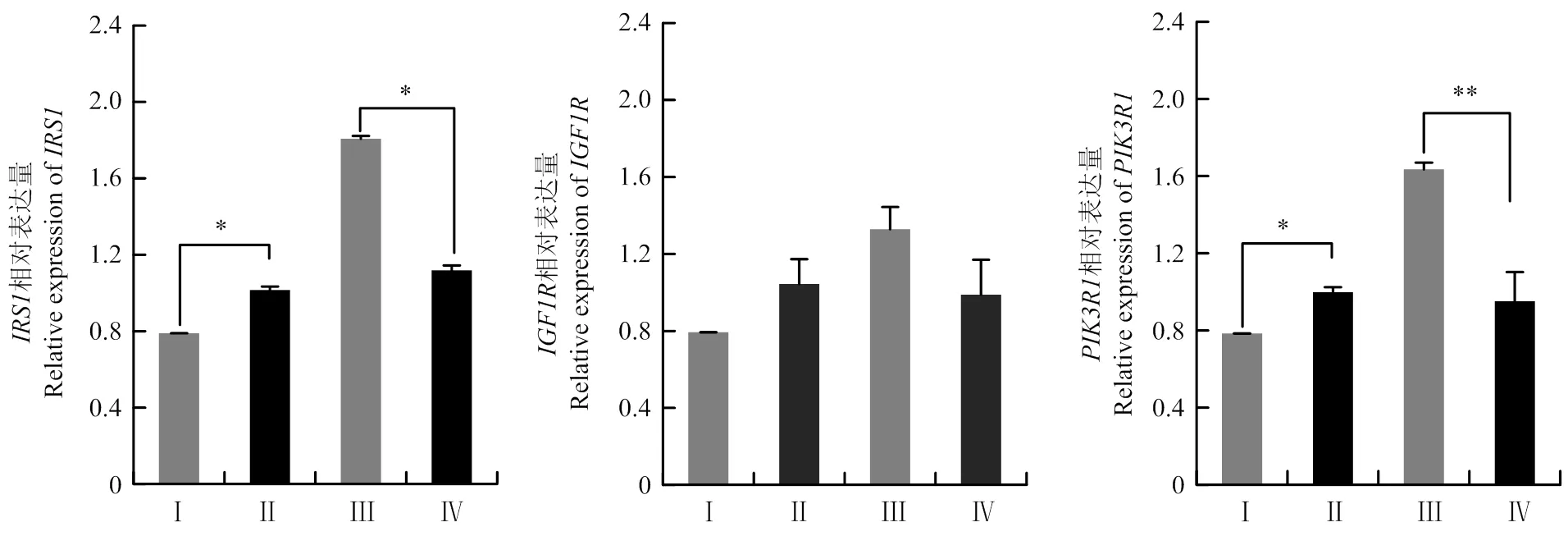
图5 miR-221对重要功能基因表达量的影响
RT-qPCR结果表明,miR-221在绵羊乳腺等8个组织中均表达,在脾脏和肺脏中的表达量最高,在背最长肌和肾脏中的表达量最低(图1-A)。这表明miR-221在上述8个组织的生长发育过程中均发挥了重要作用。目前关于miR-221的研究多集中在人类肿瘤领域,例如,帅维等[19]研究表明,miR-221在人类肺脏组织中高度表达。Ogawa等[20]发现miR-221在人类肝脏组织中表达。但是,它在家畜不同组织中的表达情况未见报道。
项目组前期应用small RNA测序发现,miR-221在空怀期小尾寒羊乳腺组织中的表达量是泌乳期的3.6倍[16],这与本研究用RT-qPCR方法取得的结果相一致(图1-B)。然而,由于small RNA测序和RT-qPCR是衡量RNA表达量的两种不同方法,它们在计算方法和原理等方面截然不同,因此两者间的研究结果存在一定差异。研究表明,乳腺发育时期不同,它的形态结构和功能也不同。在哺乳动物的空怀期,乳腺上皮细胞的数量最少、活力最低。而在泌乳早期,乳腺上皮细胞活力、乳腺肺泡数量和大小都处于持续增加状态[21]。本研究中,miR-221在乳腺不同时期的差异表达说明,它抑制了绵羊乳腺上皮细胞的活力和增殖,后续的CCK-8和Edu试验也印证了这一点。初美强[22]在小鼠乳腺组织中也发现,miR-221在非泌乳期的表达量高于泌乳高峰期,这与本研究结果相一致。另外,本研究发现miR-221在泌乳期乳腺中下调表达,由于该时期是乳腺合成乳蛋白和乳脂、分泌乳汁的重要时期,这也说明miR-221抑制了绵羊乳成分的合成与乳汁的分泌。
3.2 miR-221抑制了绵羊乳腺上皮细胞的活力与增殖
CCK-8和Edu试验表明,miR-221抑制了绵羊乳腺上皮细胞的活力(图2-A),并降低了Edu标记的阳性细胞数量(图2-B)。前人研究表明,乳腺上皮细胞的活力和数量显著影响了哺乳动物的泌乳量和乳成分含量[23],即乳腺上皮细胞活力越大,数量越多,则哺乳动物的泌乳能力越强,乳蛋白和乳脂等成分的含量越高。这进一步表明miR-221能抑制乳汁合成,以及乳中蛋白质、脂肪等成分的含量。陆黎敏等[24]用透射电镜发现,抑制miR-221后,小鼠乳腺上皮细胞上的内质网等细胞器的数目明显增多,腺泡体积也在增大。由于乳汁中蛋白质、脂类等营养成分在内质网上合成[25],因此这也证实了miR-221能抑制小鼠乳蛋白质、乳脂和乳糖的生成过程。Jiao等[26]也发现,miR-221抑制了奶牛乳腺上皮细胞的增殖。除此之外,miR-221还能通过靶向雌激素受体α(estrogen receptor α, ERα)去抑制人类乳腺癌细胞的增殖[27]。
3.3 miR-221对靶基因及其他重要功能基因的影响
双荧光素酶实验表明,miR-221模拟物抑制了的双荧光素酶活性(<0.01),而miR-221抑制剂则提高了它的双荧光素酶活性(图4-A;<0.05),这表明是miR-221的一个靶基因,这种靶向关系在其他家畜的乳腺上皮细胞中已得到了证实。例如,焦蓓蕾[28]在奶牛乳腺上皮细胞中也发现是miR-221的一个靶基因。除了以外,前人在奶牛、奶山羊和小鼠乳腺中发现,[26]、和[22]也是miR-221的靶基因。这些研究也证实了一个miRNA可以同时调节多个靶基因的表达量,从而实现它的转录后调控功能。RT-qPCR试验进一步发现,miR-221模拟物抑制了靶基因的表达量,而miR-221抑制剂提高了靶基因的表达量(图5)。这与焦蓓蕾[28]在奶牛上的研究结果一致,他们用RT-qPCR和Western Blot技术发现,miR-221模拟物抑制了和在mRNA和蛋白质层面的表达量,而miR-221抑制剂提高了它们的表达量。
研究表明,通过两种途径促进乳汁分泌和乳蛋白的合成。首先,IRS1是IGF1R和胰岛素受体(Insulin Receptor, IR)的停泊蛋白,也是IGF1参与乳腺发育和泌乳调控的关键蛋白。IR是一种酪氨酸激酶,当与胰岛素(Insulin, INS)结合时会发生快速的自身磷酸化,并促使IRS1等细胞内蛋白质底物发生磷酸化[29]。磷酸化后的IRS1激活了PI3K-Akt-mTOR信号通路,提高了乳腺上皮细胞的活力和增殖,最终促进了乳汁和乳蛋白的合成[30]。其次,IRS1还可以通过抑制ATP酶的活性来激活蛋白激酶C,最终引起了INS的释放[31]。研究表明,INS能促进牛和小鼠乳腺上皮细胞的增殖,以及叶酸受体(Folate receptor alpha,)和甲基四氢叶酸还原酶(Methylenetetrahydrofolate reductase,)等相关乳汁蛋白基因的表达[32-33],最终促进了乳汁分泌和乳蛋白合成。
本研究发现,除了以外,miR-221也抑制了基因的表达(图5)。研究表明,在小鼠乳腺中敲除后,小鼠泌乳性能显著下降[34]。这表明能促进小鼠泌乳。虽然目前尚未报道在家畜乳腺上皮细胞中的生物学作用,但在人类医学中发现,可以介导胃癌细胞的增殖、迁移和侵袭[35]。因此推测,也可以调节乳腺上皮细胞的增殖能力,从而参与乳汁合成过程,但这还需要进一步研究确认。
4 结论
miR-221在绵羊中的表达具有组织特异性,是它的一个靶基因。miR-221能够抑制绵羊乳腺上皮细胞的活力和增殖,降低和的表达量。研究工作为进一步阐明miR-221调控绵羊泌乳性能的分子机理提供了研究基础。
[1] 孙海云. 外源重组Wnt3a蛋白对体外培养的奶牛乳腺上皮细胞数量及分泌活性影响的研究[D]. 保定: 河北农业大学, 2014.
SUN H Y. Effects of exogenous recombinant Wnt3a protein on cell number and secretion activity in cuitured bovine mammary epithelial cells[D]. Baoding: Hebei Agricultural University, 2014. (in Chinese)
[2] 孟凯. Wnt信号通路激活剂BIO在山羊乳腺上皮细胞形成腺泡样结构中的调控作用[D]. 杨凌: 西北农林科技大学, 2015.
MENG K. The effect of Wnt activator-bio on the formation of acinar-like structure of goat mammary epithelial cells[D]. Yangling: Northwest A&F University, 2015. (in Chinese)
[3] 王建清. 小尾寒羊miR-221和miR-329b-3p功能研究及其与基因的靶向关系验证[D]. 兰州: 甘肃农业大学, 2020.
WANG J Q. Study on the Function of miR-221 and miR-329b-3p and verification of their targeted relationship with
[4] 李学忠. 过表达lncRNA H19对奶牛乳腺上皮细胞生物学特性和功能的影响及作用机制[D]. 杨凌: 西北农林科技大学, 2018.
LI X Z. The mechanism and effects of of lncRNA H19 overexpression on biological characteristics and functions of bovine mammary epithelial cells[D]. Yangling: Northwest A&F University, 2018. (in Chinese)
[5] LU P, LI L, WANG F, GU Y. Effects of long non‐coding RNA HOST2 on cell migration and invasion by regulating MicroRNA let‐7b in breast cancer. Journal of Cellular Biochemistry, 2017, 119(6): 4570-4580.
[6] AMBROS V. The functions of animal microRNAs. Nature, 2004, 431(7006): 350-355.
[7] HUANG Y, SHEN X, ZOU Q, WANG S, TANG S, ZHANG G. Biological functions of microRNAs: a review. Journal of Physiology and Biochemistry, 2011, 67(1): 129-139.
[8] WANG X, ZHANG L, JIN J, XIA A, WANG C, CUI Y, QU B, LI Q, SHENG C. Comparative transcriptome analysis to investigate the potential role of miRNAs in milk protein/fat quality. Scientific Reports, 2018, 8(1): 6250.
[9] UCAR A, VAFAIZADEH V, JARRY H, FIEDLER J, KLEMMT P A B, THUM T, GRONER B, CHOWDHURY K. miR-212 and miR-132 are required for epithelial stromal interactions necessary for mouse mammary gland development. Nature Genetics, 2010, 42(12): 1101-1108.
[10] IBARRA I, ERLICH Y, MUTHUSWAMY S K, SACHIDANANDAM R, HANNON G J. A role for microRNAs in maintenance of mouse mammary epithelial progenitor cells. Genes & Development, 2007, 21(24): 3238-3243.
[11] LI D, XIE X, WANG J, BIAN Y, LI Q, GAO X, WANG C. miR-486 Regulates Lactation and Targets the PTEN Gene in Cow Mammary Glands. PLoS One, 2015, 10(3): e0118284.
[12] CUI W, LI Q, FENG L, DING W. miR-126-3p regulates progesterone receptors and involves development and lactation of mouse mammary gland. Molecular and Cellular Biochemistry, 2011, 355(1-2): 17-25.
[13] Chu M, ZHAO Y, YU S, HAO Y, ZHANG P, FENG Y, ZHANG H, MA D, LIU J, CHENG M, LI L, SHEN W, GAO H, LI L, MIN L. MicroRNA-221 may be involved in lipid metabolism in mammary epithelial cells. International Journal of Biochemistry and Cell Biology, 2018, 97: 118-127.
[14] 包黎娟, 刘育含, 马毅, 安小鹏, 张月, 张梦, 王建刚, 堵斌, 李广, 曹斌云. miR-92a对奶山羊乳腺上皮细胞增殖及凋亡的调控分析. 畜牧兽医学报, 2020, 51(01): 137-149.
BAO L J, LIU Y H, MA Y, AN X P, ZHANG Y, ZHANG M, WANG J G, DU B, LI G, CAO B Y. The Regulatory of miR-92a on proliferation and apoptosis of dairy goat mammary epithelial cells. Chinese Journal of Animal and Veterinary Sciences, 2020, 51(01): 137-149. (in Chinese)
[15] 王褚悦, 王春梅, 邵丽, 张莉, 林叶, 崔英俊, 高学军, 李庆章. miR-142-3p对奶山羊乳腺上皮细胞泌乳功能的影响. 中国畜牧兽医, 2015, 42(07): 1823-1829.
WANG C Y, WANG C M, SHAO L, ZHANG L, LIN Y, CUI Y J, GAO X J, LI Q Z. Effect of miR-142-3p on lactation function in dairy goat mammary epithelial cells. China Animal Husbandry & Veterinary Medicine, 2015, 42(07): 1823-1829. (in Chinese)
[16] WANG J, HAO Z, HU J, LIU X, LI S, WANG J, SHEN J, SONG Y, KE N, LUO Y. Small RNA deep sequencing reveals the expressions of microRNAs in ovine mammary gland development at peak-lactation and during the non-lactating period. Genomics, 2021, 113(1-2): 637-646.
[17] HAO Z, WANG J, LUO Y, LIU X, LI S, ZHAO M, JIN X, SHEN J, KE N, SONG Y, QIAO L. Deep small RNA-Seq reveals microRNAs expression profiles in lactating mammary gland of 2 sheep breeds with different milk performance. Domestic Animal Endocrinology, 2021, 74: 106561.
[18] LI Z, LIU H, JIN X, LO L, LIU J. Expression profiles of microRNAs from lactating and non-lactating bovine mammary glands and identification of miRNA related to lactation. BMC Genomics, 2012, 13(2): 731.
[19] 帅维, 陈琼, 王懿春. miR-221在人肺纤维化组织和TGFβ1干预A549细胞中的表达变化. 中国医师杂志, 2018, 20(02): 187-190.
SHUAI W, CHEN Q, WANG Y C. Examination of expression of miR-221 in human pulmonary fibrosis tissues and in A549 cells treated with TGFβ1. Journal of Chinese Physician, 2018, 20(02): 187-190. (in Chinese)
[20] OGAWA T, ENOMOTO M, FUJII H, SEKIYA Y, YOSHIZATO K, IKEDA K, KAWADA N. MicroRNA- 221/222 upregulation indicates, the activation of stellate cells and the progression of liver fibrosis. Gut, 2012, 61(11): 1600-1609.
[21] 李庆章. 乳腺发育与泌乳生物学.北京: 科学出版社, 2009.
LI Q Z. Mammary gland development and lactation biology. Beijing: Science Press, 2009. (in Chinese)
[22] 初美强. MiR-15b, miR-126, miR-221影响乳腺上皮细胞脂类代谢及分子机制探究[D]. 青岛: 青岛农业大学, 2017.
CHU M Q. MiR-15b, miR-126, miR-221 involved in lipid metabolism in mammary epithelial cells and the underlying mechanism[D]. Qingdao: Qingdao Agricultural University, 2017.(in Chinese)
[23] BOUTINAUD M, GUINARD-FLAMENTA J, JAMMES H. The number and activity of mammary epithelial cells, determining factors for milk production. Reproduction Nutrition Development, 2004, 44(5): 499-508.
[24] 陆黎敏, 李庆章, 王春梅, 李晔, 高学军. miR-221对小鼠乳腺上皮细胞增殖和泌乳功能的影响. 中国生物化学与分子生物学报, 2009, 25(5): 454-458.
LU L M, LI Q Z, WANG C M, LI Y, GAO X J. Impact of miR-221 on mouse mammary epithelial cells and lactation. Chinese Journal of Biochemistry and Molecular Biology, 2009, 25(5): 454-458. (in Chinese)
[25] KEENAN T W, WINTER S, RACKWITZ H R, HEID H W. Nuclear coactivator protein p100 is present in endoplasmic reticulum and lipid droplets of milk secreting cells. Biochimica et Biophysica Acta, 2000, 1523: 84-90.
[26] JIAO B, ZHANG X, WANG S, WANG L, LUO Z, ZHAO H, KHATIB H, WANG X. MicroRNA-221 regulates proliferation of bovine mammary gland epithelial cells by targeting theandgenes. Journal of Dairy Science, 2018, 102(1): 426-435.
[27] ZHAO J, LIN J, YANG H, KONG W, HE L, MA X, COPPOLA D, CHENG J. MicroRNA-221/222 Negatively regulates estrogen receptor alpha and is associated with tamoxifen resistance in breast cancer. The Journal of Biological Chemistry, 2008, 283(45): 31079-31086.
[28] 焦蓓蕾. MiR-221通过靶向和基因抑制奶牛乳腺上皮细胞增殖的研究[D].杨凌: 西北农林科技大学, 2018.
JIAO B L. MiR-221 regulates cell proliferation of bovine mammary epithelial cells by targetingandgenes[D]. Yangling: Northwest A&F University, 2018. (in Chinese)
[29] LAVAN B E, LANE W S, LIENHARD G E. The 60-kDa phosphotyrosine protein in insulin-treated adipocytes is a new member of the insulin receptor substrate family. The Journal of Biological Chemistry, 1997, 272(17): 11439-11443.
[30] RÄDLER P D, WEHDE B L, WAGNER K U. Crosstalk between STAT5 activation and PI3K/AKT functions in normal and transformed mammary epithelial cells.Molecular and Cellular Endocrinology, 2017, 451: 31-39.
[31] 舒适, 宋菊敏. 胰岛素受体底物-1/-2与胰岛素信号转导. 医学综述, 2008, 14(5): 723-725.
SHU S, SONG J M. Insulin receptor substrate-1/-2 and insulin resistance. Medical Recapitulate, 2008, 14(5): 723-725. (in Chinese)
[32] MENZIES K K, LEFÈVRE C, MACMILLAN K L, NICHOLAS K R. Insulin regulates milk protein synthesis at multiple levels in the bovine mammary gland. Functional & Integrative Genomics, 2009, 9(2): 197-217.
[33] MENZIES K K, LEE H J, LEFÈVRE C, ORMANDY C J, MACMILLAN K L, NICHOLAS K R. Insulin, a key regulator of hormone responsive milk protein synthesis during lactogenesis in murine mammary explants.Functional & Integrative Genomics, 2010, 10(1): 87-95.
[34] CHEN Q, ZHAO F, REN Y, HAN J, LIU J, LI Y, LIU H. Parenterally delivered methionyl-methionine dipeptide during pregnancy enhances mammogenesis and lactation performance over free methionine by activating PI3K-AKT signaling in methionine- deficient mice. Journal of Nutrition, 2020, 150(5): 1186-1195.
[35] LI Q, TIAN Y, LIANG Y, LI C. CircHIPK3/miR-876-5p/PIK3R1 axis regulates regulation proliferation, migration, invasion, and glutaminolysis in gastric cancer cells. Cancer Cell International, 2020, 20: 391.
The miR-221 Inhibits the Viability and Proliferation of Ovine Mammary Epithelial Cells by Targeting

College of Animal Science and Technology/Gansu Key Laboratory of Herbivorous Animal Biotechnology/Gansu Engineering Lab of Genetic Improvement in Ruminants, Gansu Agricultural University, Lanzhou 730070
【Background】MicroRNAs (miRNA) are a type of small RNAs (18-23 nt) that are widely involved in the regulation of mammogenesis and milk traits in livestock animals. In our previous research, the expression level of miR-221 in non-lactating mammary gland was found to be 3.6-time higher than in mammary gland at lactation period in Small-Tailed Han sheep by using RNA-Seq. However, the regulatory mechanism of miR-221 on ovine mammary gland development is still unclear.【Objective】The aim of this study was to investigate the inhibition of miR-221 on the viability and proliferation of ovine mammary epithelial cells by targeting insulin receptor substrate 1 (IRS1) gene, so as to provide a theoretical reference for revealing the molecular regulation mechanism of miR-221 on ovine lactation performance.【Method】In the study, mammary gland, heart, liver, kidney, spleen, lung,muscle and ovary tissues were collected in Small-Tailed Han sheep, and the expression profiles of miR-221 were constructed in ovine eight tissues by using reverse transcription-quantitative PCR (RT-qPCR). The effects of miR-221 on the viability and proliferation of ovine mammary epithelial cells (OMECs) were investigated by using cell transfection, CCK-8 and Edu assays. The miRDB and miRanda were used to predict the target genes of miR-221. Based on functional enrichment analysis, an investigated target gene was screened. The target relationship between miR-221 and the predicted target gene was investigated by constructing wild-type and mutant-type report vectors for the target gene by using dual luciferase reporter assay. Finally, the effects of over-expressed and silenced miR-221 on expression levels of the target gene and other functional genes in downstream signaling pathways were detected.【Result】The miR-221 was expressed in ovine eight tissues including mammary glands, with the highest expression levels in lung and spleen, and the lowest expression levels inmuscle and kidney. The CCK-8 assay result revealed that miR-221 mimic inhibited the viability of OMECs, whereas miR-221 inhibitor promoted the viability of OMECs. The Edu result found that miR-221 mimic reduced the number of Edu-labeled positive OMECs. On the contrary, miR-221 inhibitor increased the number of Edu-labeled positive OMECs. The result from dual luciferase reporter assays showed that the miR-221 mimics reduced the luciferase activity of the 3′UTR region of, while miR-221 inhibitor increased the luciferase activity. This suggested thatwas a target gene of miR-221. The results from RT-qPCR further found that over-expressed miR-221 reduced expression levels ofand<0.05), while silenced miR-221 enhanced the levels of the two genes in expression (<0.05). No effect onwas found for over-expressed and silenced miR-221 in OMECs (>0.05).【Conclusion】The miR-221 inhibited the viability and proliferation of OMECs by reducingexpression.
sheep; miR-221; insulin receptor substrate1; mammary epithelial cells.
2021-04-09;
2022-03-07
国家自然科学基金(32060746和31860635)、甘肃农业大学青年导师扶持基金(GAU-QDFC-2020-01)、甘肃农业大学伏羲青年英才培育计划(Gaufx-02Y02)、甘肃省基础研究创新群体项目(18JR3RA190)
柯娜,E-mail:ken@st.gsau.edu.cn。通信作者王继卿,E-mail:wangjq@gsau.edu.cn
10.3864/j.issn.0578-1752.2022.10.014
(责任编辑 林鉴非)
