基于Wnt/β-catenin信号通路探究小金丹对直肠癌细胞增殖、迁移和EMT的影响
2022-06-24谢兴旺柯超周红见裴胜利武汉市第三医院胃肠外科湖北武汉430060
谢兴旺 柯超 周红见 裴胜利 (武汉市第三医院胃肠外科,湖北 武汉 430060)
直肠癌是常见癌症,其发病率和死亡率极高,直肠癌细胞凋亡减少、迁移、侵袭能力增加是直肠癌快速进展的重要原因〔1〕。小金丹出自《外科证治全生集》,具有消肿、解毒、化痰、活血等功效,由地龙、木鳖子、五灵脂等组成,现阶段临床上用于甲状腺瘤、脓肿、慢性肝炎、聚合性痤疮等治疗〔2〕。有研究〔3,4〕显示,小金丹有抗肿瘤作用,对肝癌、乳腺癌等有抑制作用。目前尚不清楚小金丹对直肠癌细胞迁移等的作用和机制。Wnt信号是目前研究较多的信号转导通路,Wnt/β-连环蛋白(catenin)是经典的Wnt信号通路,参与糖尿病、肿瘤、脑卒中等疾病进展〔5〕。在肿瘤中已经发现Wnt/β-catenin过度激活,抑制Wnt/β-catenin可阻碍肿瘤生长和转移〔6〕。本实验基于Wnt/β-catenin信号研究小金丹对直肠癌细胞迁移、侵袭、凋亡、上皮间质转化(EMT)等的影响。
1 材料与方法
1.1材料 直肠癌细胞HR-8348,上海博麦德生物技术有限公司提供。小金丹提取物由西安高远生物科技有限公司提供。小金丹配方:50 g五灵脂、50 g枫香脂、50 g地龙、25 g醋没药、50 g制草乌、25 g醋乳香、25 g酒当归、4 g墨炭、50 g木鳖子,研磨成粉状,然后将人工麝香研磨,混合,添加4℃预冷后的乙醇(70%)浸泡,超声提取,4℃冷浸,提取上清液,过滤(0.22 μm),用培养基稀释成实验需要的浓度。主要试剂:兔抗B细胞淋巴瘤(Bcl)-2相关X蛋白(Bax)抗体、兔抗β-catenin抗体,武汉菲恩生物科技有限公司产品;兔抗c-myc抗体,美国Santa Cruz Biotechnology公司产品;兔抗基质金属蛋白酶(MMP)-9抗体,南京欧凯生物科技有限公司产品;兔抗细胞周期蛋白(Cyclin)D1抗体,美国Cell Signaling Technology公司产品;兔抗细胞周期蛋白依赖性激酶(CDK)2抗体,美国GeneTex公司产品;兔抗上皮性钙黏附素(E-cadherin)抗体,北京义翘神州科技股份有限公司产品;兔抗神经性钙黏附素(N-cadherin)抗体,江苏亲科生物研究中心有限公司产品;兔抗Bcl-2抗体,青岛捷世康生物科技有限公司产品;Wnt/β-catenin通路激活剂LiCl,北京索莱宝科技有限公司产品。
1.2实验分组 直肠癌细胞培养条件为:37℃,饱和湿度,5% CO2培养箱,细胞置于含有10%胎牛血清的DMEM中培养。细胞培养至对数期时,将细胞分成对照组、低剂量组、中剂量组、实验高剂量组(在实验开始时分别给予0、20、40、80 mg/L小金丹处理)、高剂量+LiCl组(在实验开始时给予80 mg/L小金丹和20 mmol/L〔7〕LiCl处理)。
1.3噻唑蓝(MTT)检测增殖活性 直肠癌细胞种植到96孔板内,分别在细胞中添加0、5、10、20、40、80、160 mg/L小金丹,细胞培养24 h后,在每个孔内添加MTT工作液10 μl,继续培养4 h。将孔中的上清溶液弃掉,添加150 μl二甲基亚砜,10 min后,上酶标仪测定各孔光密度(OD)值,以OD值表示细胞增殖活性。
1.4Western印迹检测β-catenin、c-myc、CyclinD1、CDK2、E-cadherin、N-cadherin、MMP-9、Bax、Bcl-2蛋白表达 直肠癌细胞种植到6孔板内,每个孔内添加106个细胞,按照1.2中方法分组处理细胞,培养24 h后,添加含有1%苯甲基磺酰氟化物(PMSF)的放射免疫沉淀试验(RIPA)溶液,放在冰上反应30 min。刮取细胞,11 000 r/min离心5 min。吸取上清,放在-80℃保存。利用二喹啉甲酸(BCA)方法检测蛋白浓度。在蛋白提取物中添加5倍上样缓冲液,100℃煮沸5 min。每个孔内添加60 μg蛋白(20 μl体积)。配制12%分离胶、5%积层胶,在积层胶中用80 V电压电泳,在分离胶中用120 V电压电泳,观察溴酚蓝染料进入凝胶的最下端,取出凝胶。裁剪聚偏氟乙烯(PVDF)膜,90 V电压转膜90 min。将PVDF膜放在5%牛血清白蛋白溶液中,在室温中结合1 h。然后将PVDF膜放在一抗内,4℃摇床孵育过夜。PVDF膜放在二抗内,在室温摇床孵育1 h。ECL发光。以GAPDH作为内参,扫描条带的灰度值,根据灰度值分析目的蛋白表达量。β-catenin、N-cadherin、c-myc、CDK2抗体稀释倍数为1∶1 200,E-cadherin、MMP-9抗体稀释倍数为1∶800,Bax、CyclinD1、Bcl-2抗体稀释倍数为1∶1 000,二抗稀释倍数为1∶4 000。
1.5PI单染法检测周期 直肠癌细胞种植到6孔板内,每个孔内添加106个细胞,按照1.2中方法分组处理细胞,培养24 h后,收集细胞,用预冷的70%乙醇固定,800 r/min离心5 min。吸弃上清。用磷酸盐缓冲液(PBS)洗涤细胞2次。添加碘化丙啶(PI)染色液,在37℃孵育30 min。用流式细胞仪检测周期。
1.6膜联蛋白(Annexin)V-FITC/PI双染法检测凋亡 直肠癌细胞种植到6孔板内,每个孔内添加106个细胞,按照1.2中方法分组处理细胞,培养24 h后,收集细胞,以1倍结合缓冲液重悬细胞,细胞浓度为1×106个细胞/ml,吸取100 μl细胞悬浮液,添加5 μl Annexin V-FITC、100 μg/ml PI溶液,在室温中避光孵育15 min。继续添加400 μl 1倍结合缓冲液,混合后,放在冰上备用。上流式细胞仪检测凋亡变化。
1.7Transwell小室检测迁移和侵袭 在细胞侵袭实验前,首先用Matrigel将小室包被。其余操作相同。将直肠癌细胞按照1.2中方法分组处理,悬浮在不含血清的细胞培养液中。在小室的上室内添加1×105个细胞(200 μl细胞培养液),在下室中添加600 μl含10%胎牛血清的DMEM细胞培养液。继续培养24 h。将小室内的液体吸弃,用棉签擦掉没有穿膜的细胞,90%乙醇固定,0.1%的结晶紫染色,在显微镜下观察细胞穿膜数目,即为细胞迁移/侵袭数目。
1.8统计学分析 采用SPSS25.0软件进行单因素方差分析。
2 结 果
2.1各组直肠癌细胞增殖活性比较 与0 mg/L(0.79±0.08)比较,20、40、80、160 mg/L小金丹处理后的直肠癌细胞增殖活性(0.66±0.04、0.55±0.03、0.43±0.04、0.32±0.02)显著降低(P<0.05);5、10 mg/L(0.76±0.08、0.74±0.08)无变化。160 mg/L小金丹处理后的直肠癌细胞存活率低于50%,选择20、40、80 mg/L小金丹进行后续实验。
2.2各组β-catenin、c-myc蛋白表达比较 与对照组比较,低、中、高剂量组β-catenin、c-myc蛋白表达量逐渐降低;与高剂量组比较,高剂量+LiCl组升高,差异均有统计学意义(P<0.05)。见图1和表1。
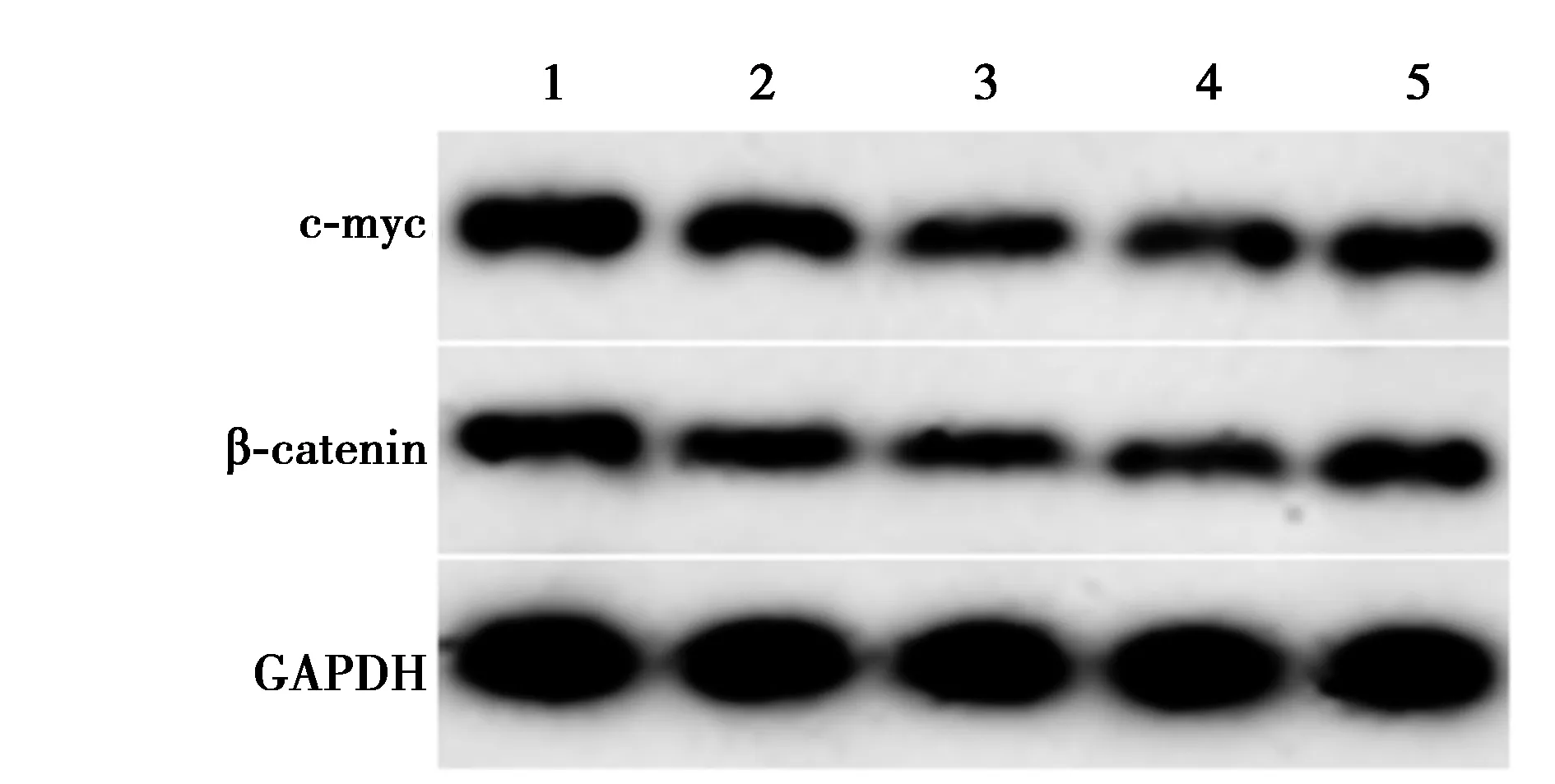
1~5:对照组,低剂量组,中剂量组,高剂量组,高剂量+LiCl组;图2、4、7同图1 Western印迹检测小金丹处理后直肠癌 细胞中Wnt/β-catenin信号相关蛋白表达
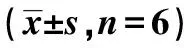
表1 各组β-catenin、c-myc蛋白表达量比较
2.3小金丹调控Wnt/β-catenin信号抑制直肠癌细胞增殖和周期进展 与对照组比较,低、中、高剂量组细胞增殖活性降低,G0/G1期比例逐渐升高,Cyc-linD1、CDK2蛋白表达量逐渐降低,差异有统计学意义(P<0.05);与高剂量组比较,高剂量+LiCl组细胞增殖活性升高,G0/G1期比例降低,CyclinD1、CDK2蛋白表达量升高,差异有统计学意义(P<0.05)。见图2、图3和表2。
图2 Western印迹检测小金丹处理后的 直肠癌细胞中CyclinD1、CDK2蛋白表达
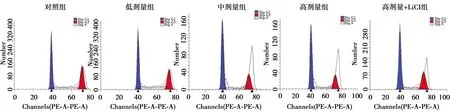
图3 PI单染法检测细胞周期
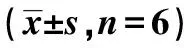
表2 各组直肠癌细胞增殖活性、细胞周期分布和CyclinD1、CDK2蛋白表达量比较
2.4小金丹调控Wnt/β-catenin信号抑制直肠癌细胞迁移、侵袭和EMT 与对照组比较,低、中、高剂量组细胞迁移数目、侵袭数目和N-cadherin、MMP-9蛋白表达量逐渐降低,E-cadherin蛋白表达量逐渐升高,差异有统计学意义(P<0.05);与高剂量组比较,高剂量+LiCl组细胞迁移数目、侵袭数目和N-cadherin、MMP-9蛋白表达量显著升高,E-cadherin蛋白表达量显著降低(P<0.05)。见图4、图5和表3。
2.5小金丹调控Wnt/β-catenin信号对直肠癌细胞凋亡的影响 与对照组比较,低、中、高剂量组细胞凋亡率和Bax蛋白表达量逐渐升高,Bcl-2蛋白表达量逐渐降低,差异有统计学意义(P<0.05);与高剂量组比较,高剂量+LiCl组细胞凋亡率和Bax蛋白表达量显著降低,Bcl-2蛋白表达量显著升高(P<0.05)。见图6、图7和表4。
图4 Western印迹检测小金丹处理后的直肠癌细胞中 E-cadherin、N-cadherin、MMP-9蛋白表达
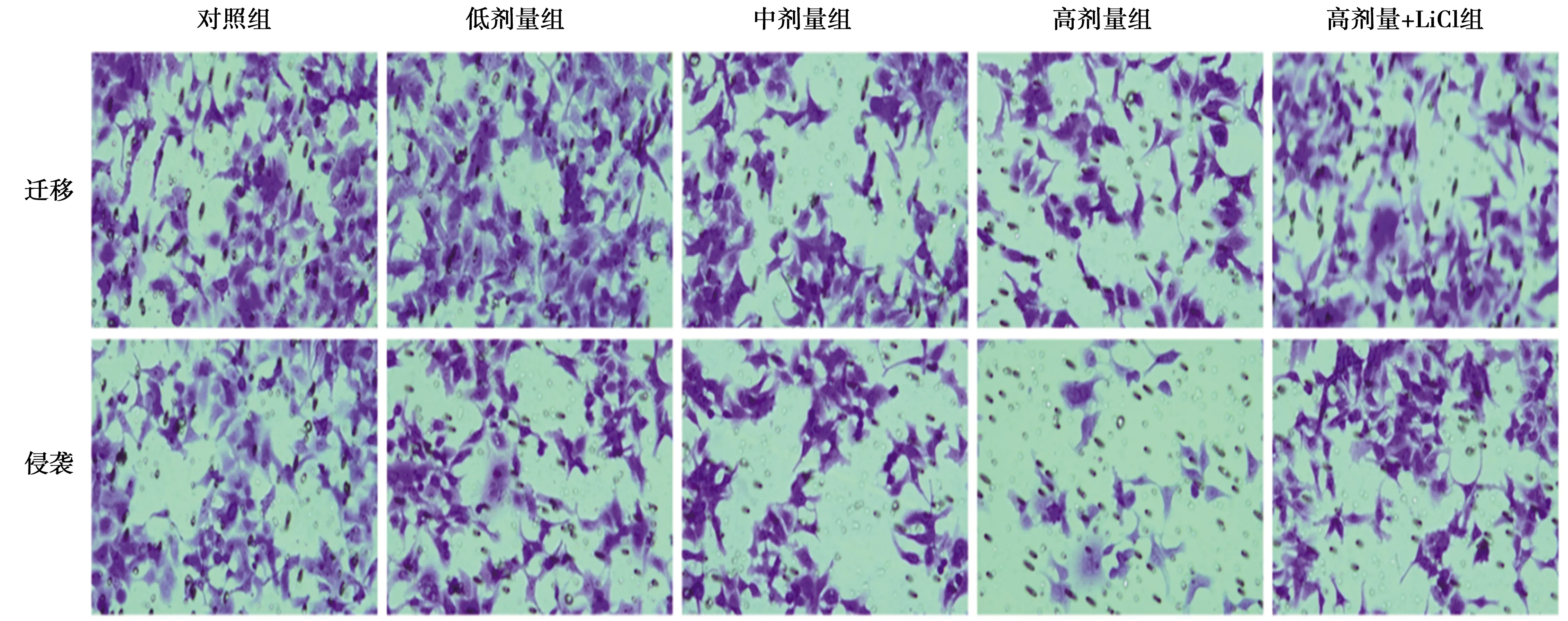
图5 Transwell小室检测直肠癌细胞迁移和侵袭(×200)
表3 各组细胞迁移数目、侵袭数目和E-cadherin、N-cadherin、MMP-9蛋白表达量比较
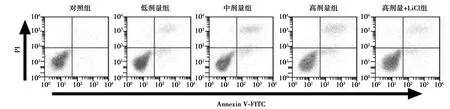
图6 Annexin V-FITC/PI双染法检测小金丹处理后的直肠癌细胞凋亡

图7 Western印迹检测小金丹处理后的 直肠癌细胞中Bax、Bcl-2蛋白表达
表4 各组细胞凋亡率和Bax、Bcl-2蛋白 表达量比较
3 讨 论
小金丹,原书上记载其可以用于治疗乳癖、流柱、乳岩等疾病,现代药理学研究发现其对肿瘤也有治疗作用〔2〕。有实验〔3,4〕显示,小金丹可降低乳腺癌、肝癌细胞增殖、迁移能力。本研究结果提示小金丹具有抗直肠癌细胞恶性生物学行为的作用,这为小金丹治疗直肠癌的临床应用提供了理论支撑。
肿瘤细胞恶性生物学行为与细胞内多种调控因子有关,细胞周期是细胞增殖的基础,其可以分成分裂期和分裂间期,其中细胞从G0/G1期向S期进展是细胞周期调控的关键点〔8〕。CyclinD1、CDK2是细胞周期的促进因子,可促进细胞从G0/G1期向S期转变,进而加快细胞增殖〔9〕。与细胞凋亡有关的调控因子有很多,其中包括Bcl-2蛋白家族,Bax是Bcl-2蛋白家族中的促凋亡因子,Bcl-2是Bax蛋白家族中的抗凋亡蛋白,二者表达变化与细胞凋亡改变有关〔10,11〕。MMP-9属于MMPs家族成员,在细胞运动、迁移中发挥促进作用,其能够将细胞外基质降解,进而为细胞迁移提供条件〔12〕。EMT是肿瘤转移的早期标志性事件,是指上皮细胞特征逐渐消失而间质细胞特征逐渐明显的过程,E-cadherin是上皮细胞标志蛋白,N-cadherin是间质细胞标志蛋白〔13,14〕。本实验进一步说明小金丹有抗直肠癌细胞转移潜能和促进细胞凋亡的作用。
β-catenin是Wnt经典信号通路Wnt/β-catenin的核心蛋白,c-myc是Wnt/β-catenin信号的下游靶基因〔15~17〕。本实验发现,小金丹能够降低直肠癌细胞中β-catenin、c-myc蛋白表达量,小金丹可能通过影响Wnt/β-catenin信号抑制直肠癌细胞生长和转移。Wnt/β-catenin信号在肿瘤中过度表达,而抑制Wnt/β-catenin信号能够抑制肿瘤进展和转移〔18~20〕。本实验结果提示小金丹通过下调Wnt/β-catenin信号激活水平发挥抗直肠癌细胞恶性生物学行为的作用,这为研究小金丹抗直肠癌分子机制奠定了基础。
