PRSS3基因突变相关胰腺炎并糖尿病患者1例报告并文献复习
2022-06-24肖敏迟静薇车奎吕文山祁梦梦张文洁王颜刚
肖敏 迟静薇 车奎 吕文山 祁梦梦 张文洁 王颜刚
(青岛大学附属医院,山东 青岛 266003 1 内分泌科; 2 甲状腺实验室)
急性胰腺炎(acute pancreatitis,AP)是胰酶激活引起胰腺组织自身消化,甚至可能导致死亡的炎症性疾病[1]。糖尿病(diabetes mellitus,DM)是以慢性高糖血症为特征的代谢异常性疾病,其与胰岛素分泌功能相对或绝对受损有关,可伴不同程度的胰岛素抵抗[2]。AP与DM关系密切,DAS等[3]的荟萃分析显示,AP首次发作1年内,DM患者发病率高达15%。TU等[4]也报道,有AP病史患者的DM患病率可达30.1%。同样,DM患者发生AP的概率也显著升高[5-6]。现报道1例AP合并DM病例,结合其基因检测结果,探讨AP与DM之间的关系,为此类疾病的早期防治提供指导。
1 临床资料
患者,女,36岁,因“恶心呕吐伴腹痛1 d”于2017年3月3日就诊于我院。入院体格检查:体温36.4 ℃,脉搏99 min-1,呼吸22 min-1,血压120/85 mmHg,身高168.0 cm,体质量80.5 kg,BMI 28.52 kg/m2,腹平软,脐上有压痛但无反跳痛,墨菲氏征阴性,余体格检查无异常。辅助检查:血淀粉酶1 372 U/L,血脂肪酶929 U/L,尿淀粉酶1 650 U/L,随机血糖23.83 mmol/L,尿酮体,糖化血红蛋白(HbA1c)10.4%,三酰甘油4.54 mmol/L,尿葡萄糖;腹部增强CT检查显示胰腺头颈部边缘略毛糙,周围见多发液体影。根据患者的临床症状、体格检查以及辅助检查等结果,诊断为AP、DM以及糖尿病酮症酸中毒。患者予以禁饮食,给予兰索拉唑30 mg溶于100 mL生理盐水中每日2次静脉滴注;奥曲肽0.3 mg溶于60 mL生理盐水中5 mL/h持续静脉泵入;胰岛素8 U溶于500 mL葡萄糖氯化钠注射液当中每日1次静脉滴注;肠内营养粉剂41 g溶于300 mL温水中经鼻肠管注入。治疗1周后患者症状缓解,无腹痛,血尿淀粉酶、空腹及餐后血糖降至正常范围。
2018年1月患者出现血糖控制欠佳的情况,空腹血糖波动在9~10 mmol/L,餐后血糖约13~15 mmol/L。于我院内分泌科就诊后进行C肽释放试验检查,结果示空腹C肽2.58 μg/L,口服标准75 g葡萄糖30、60、120、180 min后C肽值依次为2.06、2.50、3.76、3.45 μg/L;胰岛素释放试验测定空腹胰岛素15.56 mU/L,口服标准75 g葡萄糖30、60、120、180 min后胰岛素值依次为9.13、16.03、20.77、16.06 mU/L。上述两个检查结果提示患者胰岛储备功能不足,且存在胰岛素分泌高峰延迟。给予地特胰岛素16 U,睡前皮下注射;吡格列酮片30 mg,每日1次;盐酸二甲双胍片0.5 g,每日3次;非诺贝特胶囊0.2 g,每日1次治疗。用药1周后患者空腹及餐后血糖降至理想范围。2018年11月患者血糖再次超出正常范围,随机血糖13.7 mmol/L,HbA1c 9.9%,将盐酸二甲双胍片调整为西格列汀二甲双胍片0.5 g,每日2次,余治疗同前。调药2周后患者空腹及餐后血糖波动在正常范围,控制平稳,且AP未再复发。
为明确患者是否有AP及DM相关致病基因,于2019年3月5日对患者采全血进行全外显子测序,结果提示PRSS3基因突变,发现PRSS3基因第3个外显子编码区284和285位存在碱基缺失的杂合突变(c.284_285delAC),该突变位点既往未见相关文献报道。于同日取患者母亲血样,行全外显子测序,结果证实其母存在与患者相同变异体和基因突变。为明确患者突变来源及其家系特征,经家系成员同意,收集患者家系临床资料,构建家系图(图1)。家系成员资料显示,患者表姨曾患AP,其父母及外祖父母均患DM,其曾外祖母以及外祖母之妹则患有胰腺癌。
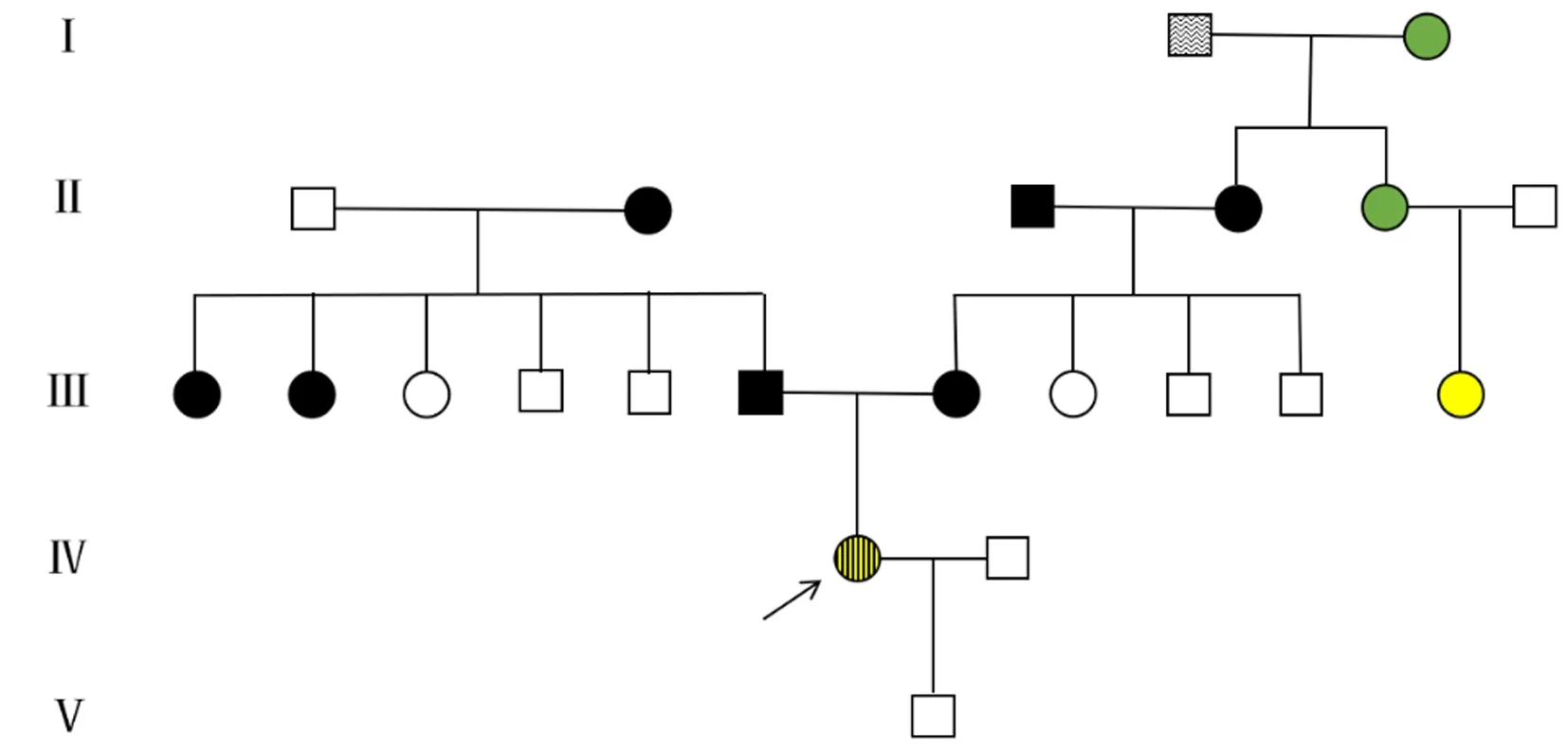
:正常男性,:正常女性,:未知,糖尿病女性,:糖尿病男性,:胰腺癌女性,:胰腺炎女性,:胰腺炎合并糖尿病,:先证者。Ⅱ4、Ⅱ5为双胞胎。图1 患者家系图Fig.1 Pedigree of the patient
基因检测后患者治疗方案不变。后期随访过程中,嘱患者注意饮食管理及适当运动。现患者空腹、餐后血糖及HbA1c控制在理想范围,AP未再复发,并保持定期随访。
2 讨 论
本研究患者以“恶心呕吐伴腹痛1 d”为首发症状,完善相关检查,考虑为AP合并DM。临床上AP和DM关系密切。有文献报道,胰腺炎发作后,患者罹患DM风险可达无胰腺炎病史者的2倍,其中80%的DM是由AP引起的[7]。WYNNE等[8]研究显示,在AP发作时,胰高血糖素、胰多肽、脂肪因子等激素会受到影响,使患者发生高糖血症的风险增加。胰腺疾病与糖代谢关系密切,由胰腺外分泌功能障碍导致的DM称为胰源性DM或者3c型DM(T3cDM)[8-10],该疾病患者占欧美人群DM的5%~10%[11-12]。该类疾病虽由不同胰腺外分泌疾病引发,但根本病理生理过程为胰腺内分泌功能障碍,终至糖代谢异常[13]。临床上,也有许多患者确诊DM后,长期血糖控制不佳,尤其合并血脂代谢异常时,继发AP[6]。此外,关于一些新型降糖药物引发血清脂肪酶和淀粉酶升高,进而增加AP患病风险的报道也日益增多[14-15]。
为明确本研究患者AP及DM的发病原因,我们对其进行了全外显子测序检查。结果未发现已知的2型DM(T2DM)易感基因,但是发现该患者的PRSS3基因存在c.284_285delAC的杂合突变。MASAMUNE等[16]对261例AP患者和269例健康对照人群的研究发现,AP患者PRSS3基因突变频率显著高于对照人群,而且AP患者中复发率高达33%,其中27.6%的AP复发者含PRSS3突变,提示PRSS3基因突变与AP密切关联。基础研究显示,蛋白酶激活受体(PAR)在组织中介导着炎症过程[17],而PRSS3编码的产物可以切割和激活PAR,引起PAR依赖性的炎性反应[17]。本研究病例中的PRSS3突变对AP的影响尚不清楚,根据上述研究结果我们考虑患者的PRSS3突变可能引起胰腺的炎性反应,从而导致胰腺损伤。而既往也有研究表明,PRSS3编码产物在体内激活后可能会减弱胰蛋白酶抑制剂对胰腺的保护作用,从而导致胰腺炎的发生和发展[18]。胰腺损伤则进一步导致胰腺及其他内分泌细胞的破坏以及肠-胰岛轴紊乱,继而出现各种激素(如胰岛素、胰多肽、肠促胰岛素多肽等)分泌紊乱,最终表现出血糖异常[12,19]。故结合临床表现以及基因诊断结果,本例患者不排除T3cDM可能。
根据C肽释放试验,本例患者胰岛功能储备不足,但有基础胰岛素分泌,也有胰岛素分泌高峰延迟现象,且患者父母及外祖父母均患T2DM,患者自身也存在肥胖、血脂代谢异常等T2DM相关危险因素[20],尤其首诊时HbA1c为10.4%,因此T2DM的诊断也不能除外。
根据患者的家系资料,患者的母亲与患者同为PRSS3基因c.284_285delAC的杂合突变,然而其临床表型却不同,其母亲仅患T2DM,无AP病史。由此提示,PRSS3基因c.284_285delAC突变携带者临床表型具有异质性,患者是否罹患AP,可能受多方因素影响,c.284_285delAC突变可能仅为患者患AP的危险因素,但非必要条件。除胆道结石、酒精和高脂血症是公认导致AP的三大常见原因以外[21],酒精、高脂血症及肥胖也使AP后患DM的风险增加[22-24]。本例患者超重,存在高脂血症,但其母亲为标准体质量,且无血脂代谢异常,这可能是患者区别于其母临床表型的原因。遗憾的是,患者家系中其他成员不愿采集血标本进行基因测序,故而无法判断其他成员基因突变情况。
此外,患者表姨也曾患AP,其是否与PRSS3基因c.284_285delAC突变相关,值得探讨。也有文献报道,PRSS3基因产物与胰腺癌细胞的增殖和转移密切相关[25],本家系中患者曾外祖母及外祖母同卵双生的胞妹有胰腺癌的病史,是否也与该基因有关,亦值得研究。
综上,本文通过1例AP并DM患者,发现了一个与AP和(或)DM相关的全新基因突变,进一步丰富了AP并DM患者基因突变数据库,有助于提高临床医师对该病的认识,以避免此类疾病的漏诊或误诊,有助于早期确诊并对患者进行规范化治疗。DM与AP之间关系密切,遇AP合并DM患者时,应积极完善基因测序,明确是否有AP或DM易感基因,强化患者生活方式干预,提高治疗依从性,进而改善其预后。
利益冲突声明:所有作者、资助者及作者单位之间不存在利益冲突。
ConflictsofInterest: All authors, funders and authors unit disclose no relevant conflicts of interest.
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL26753)。所有试验过程均遵照《人体医学研究的伦理准则》的条例进行。受试对象或其亲属已经签署知情同意书。
EthicsApprovalandPatientConsent: All experimental protocols in this study were reviewed and approved by The Medical Ethics Committee of The Affiliated Hospital of Qingdao University (Approval Letter No. QYFYWZLL26753), and all experimental protocols were carried out by following The Ethical Guidelines for Human Medical Research. Consent letters have been signed by the research participants or their relatives.
作者贡献:肖敏、迟静薇、车奎、张文洁、王颜刚参与了研究设计;肖敏、吕文山、祁梦梦参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byXIAOMin,CHIJingwei,CHEKui,ZHANGWenjie, andWANGYangang. The ma-nuscript was drafted and revised byXIAOMin,LYUWenshan, andQIMengmeng. All the authors have read the last version of the paper and consented submission.
