胰高血糖素样肽1系统与非酒精性脂肪性肝病防治的关系
2022-06-23崔泓亮
崔泓亮, 徐 立, 鲁 彤
陕西中医药大学 a.医学技术学院, b.医学科研实验中心, 陕西 咸阳 712046
非酒精性脂肪性肝病(NAFLD)是当今社会常见的代谢综合征之一,现已成为严重影响全球成人甚至儿童健康最普遍的慢性肝病。全球NAFLD的综合患病率为25.24%,其中南美和中东的患病率最高,非洲患病率最低[1],而我国有29.2%的人口正遭受NAFLD的折磨[2]。NAFLD发病初期并无典型症状,如不加以控制使得病情持续恶化,最终发展为肝硬化并导致肝衰竭[3],极大增加了肝病的致死率。目前尚无针对NAFLD的特异性药物,治疗NAFLD的方法主要以改变生活方式和调整饮食结构为主[4],对NAFLD症状的改善效果十分有限。近年来有研究[5]发现胰高血糖素样肽1(glucagon-like peptide-1, GLP-1)能通过不同的作用机制来改善肝脏脂肪变性,并有减弱肝细胞氧化应激和肝纤维化的作用。本文通过介绍GLP-1的产生、分解、效应系统和NAFLD的作用关系,总结其防治NAFLD的机制,为深入研究GLP-1系统中的因子作为治疗NAFLD的靶标提供理论参考。
1 GLP-1系统
1.1 GLP-1的产生与分泌 GLP-1是一种含有31个氨基酸的胃肠道肽类激素,主要由肠道L细胞产生和分泌,并且L细胞的密度从十二指肠到结肠逐渐增加。肠道L细胞内的胰高血糖素原基因翻译后,经前蛋白转化酶枯草溶菌素1或3加工产生甘氨酸延伸型GLP-1和酰胺化型GLP-1两种GLP-1的生物活性形式[6]。GLP-1的分泌受营养、神经和内分泌因子的刺激,富含脂肪、蛋白质和碳水化合物食物的摄入是促GLP-1分泌的主要生理刺激因素[7]。
1.2 GLP-1的分解 GLP-1分泌后大多数会被细胞中广泛存在的二肽基肽酶-4(DPP-4)迅速降解。DPP-4又被称为CD26,是一种丝氨酸氨基肽酶,既能以膜结合的形式存在,也能以游离形式存在于血液中[8],在肾脏、肝脏、胰腺、血管、肠道和大脑等器官中均有表达[9]。餐后的GLP-1在分泌后通过血液循环或者局部弥散的方式作用于靶细胞。然而,由于DPP-4的降解作用,能到达肝门静脉的活性GLP-1不足25%,血浆中循环的GLP-1大多是降解后的GLP-1[10]。
1.3 GLP-1受体及其效应 GLP-1通过与其靶细胞上的受体(GLP-1R)结合而发挥生物学作用,GLP-1R大量存在于肠道、中枢神经系统、胰岛α和β细胞中,在肺、心脏、肾脏、血管和外周神经系统也有GLP-1R的表达[11]。GLP-1R是由463个氨基酸构成的G蛋白偶联受体,有7个跨膜螺旋,具有一个C端细胞内结构域和一个N端细胞外结构域[12]。GLP-1通过其α螺旋和C-末端序列与GLP-1R的N端细胞外结构域结合,然后通过GLP-1的N端残基与受体的跨膜螺旋和胞外环结合[13]。当GLP-1与细胞表面的受体结合后,GLP-1R通过激活G蛋白并产生环磷酸腺苷(cAMP)[13]将细胞外信号转导到细胞内部。GLP-1R至少可以与4种不同形式的内源性和外源性GLP-1类似物结合,是开发治疗NAFLD药物的重要靶点。
2 GLP-1系统与NAFLD的防治
2.1 GLP-1对NAFLD的防治 GLP-1可以增加肝细胞对胰岛素的敏感性,并通过氧化作用增强脂质的代谢,减少脂肪酸流入肝细胞[14],抑制了NAFLD的形成和发展。同时,GLP-1能提高肝细胞中cAMP的水平,进而促进腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化,通过刺激脂肪酸氧化来逆转肝脏脂肪变性[15]。GLP-1在改善肝脏脂肪变性的同时也可以减弱肝内炎症反应,GLP-1通过线粒体的自噬作用抑制NOD样受体蛋白3炎症小体诱导的肝细胞凋亡,从而抑制单纯性脂肪肝向非酒精性脂肪性肝炎(NASH)的转变,阻止NAFLD的恶化[16]。
2.2 DPP-4与NAFLD的防治
GLP-1在肠道产生后会迅速被DPP-4分解从而失去生物学活性,因此控制DPP-4对GLP-1的降解速度就成为调节GLP-1效应时长的关键。DPP-4抑制剂可以使DPP-4失活,减缓对GLP-1的降解作用,从而提高内源性GLP-1的水平[17]。临床研究[18]发现,DPP-4抑制剂替格列汀能降低NAFLD患者的体质量并改善NAFLD。除替格列汀之外,DPP-4抑制剂类药物如西格列汀和利格列汀等,也能改善患者的脂质代谢和肝炎症反应,但DPP-4抑制剂对NAFLD的防治机理尚未被阐明。
2.2.1 DPP-4抑制剂调节脂质代谢的机制 脂质代谢紊乱导致肝细胞内脂肪过度蓄积是形成NAFLD的前提,而固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBP)是调节肝细胞内脂质蓄积的重要因子,脂肪酸合酶(fatty acid synthase,FAS)是脂肪酸合成的关键酶。研究[19]表明,DPP-4抑制剂可减少肝脏中SREBP-1c的mRNA表达,进而降低硬脂酰CoA去饱和酶-1(stearoyl-CoA desaturase-1,SCD-1)和FAS等基因的表达,阻止了脂肪酸和甘油三脂(TG)的生成,缓解肝脏脂质代谢紊乱。动物实验[20]证实,DPP-4抑制剂也可以通过激活由高脂饮食所抑制的AMPK/SIRT1(沉默信息调节因子)通路,下调其下游靶基因乙酰辅酶A羧化酶和肉毒碱-棕榈酰转移酶1的转录水平,降低游离脂肪酸的合成。最近的研究[21-22]发现,DPP-4抑制剂能通过调控围脂滴蛋白2(perilipinin-2,PLIN2)的翻译、蛋白稳定性或蛋白降解速率,抑制由脂毒性介导的内质网应激导致的肝细胞凋亡,进而减轻肝脏脂肪变性。
2.2.2 DPP-4抑制剂对肝脏炎症和纤维化的防治机理 DPP-4抑制剂类药物显示出了对NASH治疗的巨大潜力[23-24]。替格列汀可显著抑制TGFβ1和单核细胞趋化蛋白1等促炎因子标志物mRNA的表达,减少TNF相关凋亡诱导配体受体2介导的细胞凋亡,起到保护肝细胞,减轻肝脏炎症的作用[25]。动物实验[26]证实,DPP-4抑制剂通过下调M1型巨噬细胞标志物和上调M2型巨噬细胞标志物mRNA的表达,减少肝脏中浸润巨噬细胞的数量,显著缓解了小鼠肝脏炎症反应。
肝星状细胞(HSC)活化会产生α-平滑肌肌动蛋白(α-SMA),α-SMA的过量表达会加重肝纤维化程度,是肝纤维化的标志物。TNFα、TGFβ和血小板源性生长因子(PDGF-BB)等细胞因子是活化HSC的关键因子,活化后的HSC合成过多的细胞外基质导致肝纤维化[27]。DPP-4抑制剂可通过减弱MAPK/ERK1/2/Smad2/3信号通路并抑制核因子-κB (NF-κB)的核转位,减少细胞外基质的过多堆积以及肝内结缔组织的产生,与此同时下调促纤维化因子TNFα、TGFβ和PDGF-BB,并降低了纤维化标志物α-SMA表达,进而缓解了肝纤维化[28]。
2.3 GLP-1受体与NAFLD的治疗
由于GLP-1受体激动剂(GLP-1RA)既保有GLP-1的生物学效应又能抵抗DPP-4的降解,所以在NAFLD药物的开发中备受青睐。临床研究[29-30]已经提供了大量GLP-1RA改善肝脏脂质代谢,缓解NASH和肝纤维化作用的证据。目前,已上市的GLP-1RA类药物中被证实对于治疗NAFLD有作用的包括艾塞那肽、利拉鲁肽、杜拉鲁肽、利西拉肽和索马鲁肽[31]。
2.3.1 GLP-1RA与脂质代谢 首先,GLP-1RA可以通过多种信号通路直接或间接调节脂肪的合成与分解。GLP-1RA改善脂质代谢的机制可能与过氧化物酶体增殖物激活受体(PPAR)α的激活有关,PPARα活化后抑制叉头状转录因子O1蛋白的磷酸化,降低了载脂蛋白CⅢ的合成和分泌,增强脂蛋白脂肪酶对TG的水解[32]。GLP-1RA还可通过增加PLIN和激素敏感性脂肪酶(HSL)的磷酸化来加速分解脂肪分子,当PLIN被磷酸化时,HSL可以进入脂滴内加速脂肪降解[33]。SIRT1是肝脏调节脂质代谢稳态的关键因子,GLP-1RA可以下调microRNA-124a水平,使甘油三酯脂肪酶和SIRT1的表达升高[34],水解TG,降低肝脏中脂肪的合成量。除此之外,GLP-1RA还能诱导转录因子EB核易位并增加其下游靶蛋白组织蛋白酶B和溶酶体相关膜蛋白1的表达来激活溶酶体自噬,清除肝细胞内的脂滴,减轻肝脂肪变性[35]。
其次,GLP-1RA可以通过减少氧化应激和抑制肝细胞的凋亡来抑制肝脂肪变性。血管紧张素(angiotensin,Ang)Ⅱ可以激活由氧化应激介导的线粒体功能障碍诱发NAFLD。GLP-1RA能激活Ang1~7并通过其受体拮抗由AngⅡ介导的线粒体障碍,促进脂肪酸代谢,抑制肝细胞脂肪变性[36]。动物实验研究[14]发现GLP-1RA通过3-磷脂酰肌醇激酶激活蛋白激酶B(p-Akt),随后p-Akt通过抑制脂肪酸氧化基因的表达,促进肝细胞再生,抑制了NAFLD的发展。
2.3.2 GLP-1RA与肝脏炎症和肝纤维化 GLP-1RA类药物对NASH的抑制作用在临床试验中得到了证明,NAFLD合并糖尿病的患者在服用GLP-1RA类药物后血清中GGT和AST水平显著降低[37-38],索马鲁肽还能显著降低肥胖导致NAFLD患者血清ALT和超敏C-反应蛋白的水平,改善肝脏炎症反应[39-40]。动物研究[41]证实,GLP-1RA在降低大鼠血清中丙二醛、AST和ALT水平的同时有效降低了肝脏中Toll样受体4和NF-κB的水平,提示GLP-1RA通过抑制Toll样受体4/NF-κB信号通路改善NAFLD诱导的肝脏炎症反应。GLP-1RA通过上调IκB(NF-κB抑制蛋白)家族mRNA的表达并抑制NF-κB从细胞质到细胞核的易位,减少TNFα、IL-1β和IL-6等促炎因子的释放,逆转由炎症造成的肝细胞损伤[42]。进一步研究[43]发现,GLP-1RA通过抑制NOD样受体蛋白3炎症小体的激活,增强细胞自噬/线粒体自噬,使IL-1β水平降低,减轻氧化应激损伤,延缓肝脏炎症的进展。
临床研究[44]发现,GLP-1RA类药物在降低促炎细胞因子水平的同时还伴随着NAFLD患者体内肝纤维化标志物水平的降低。GLP-1RA能促进参与细胞凋亡的主要因子c-Jun氨基末端激酶(JNK)的磷酸化,激活JNK信号通路,通过抑制ERK磷酸化来阻断ERK信号通路,进而促进活化的HSC凋亡[45],阻止肝纤维化的发生和发展。还有研究[46]发现,GLP-1RA通过上调由Sestrin2介导的Nrf2/HO-1通路中相关因子的mRNA水平,降低丙二醛和TNFα含量,改善NAFLD导致的肝纤维化。此外,GLP-1RA还可以通过癌胚抗原相关细胞黏附分子1依赖途径,有效抑制小鼠在饮食诱导下TGFβ-Smad2/Smad3促纤维化途径的激活,抑制肝纤维化的进一步发展[47]。
综上所述,GLP-1系统能通过调节脂肪合成通路上相关基因及蛋白的表达减少肝脏脂肪堆积,减轻肝组织的脂肪变性,从而改善NAFLD症状。与此同时,GLP-1系统作用于多种信号通路降低肝脏中的炎症反应并抑制HSC的活化,阻止NAFLD向NASH和肝纤维化发展(图1)。
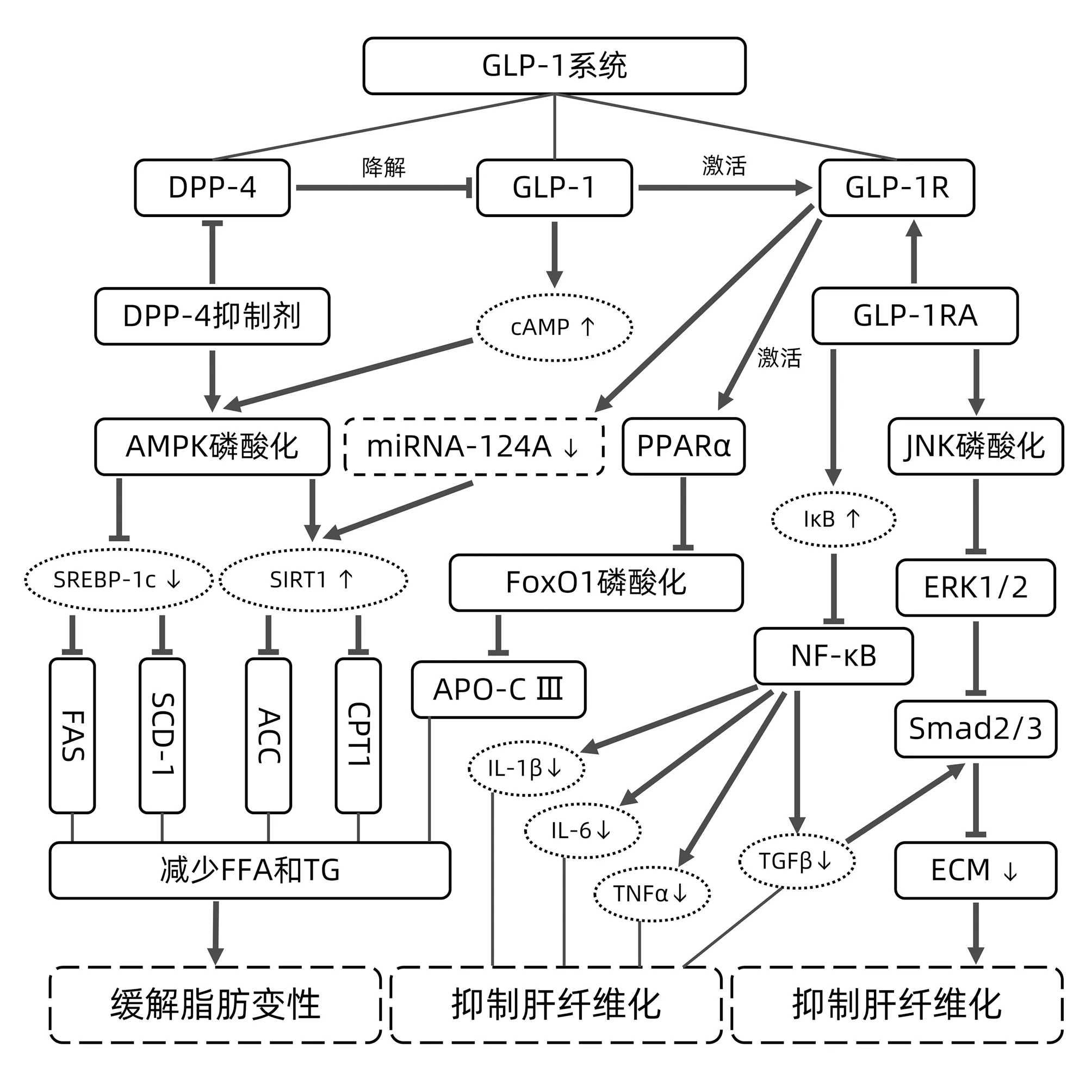
注:ACC,乙酰辅酶A羧化酶;CPT1,肉毒碱-棕榈酰转移酶1;APO-CⅢ,载脂蛋白CⅢ;ECM,细胞外基质;FoxO1,叉头状转录因子O1;FFA,游离脂肪酸。
3 GLP-1系统治疗NAFLD的问题与展望
首先,由于GLP-1在体内的降解速度极快,大部分GLP-1在到达目标组织前就已失去活性,导致体内能发挥生物学作用的GLP-1只占其总量的少部分。最近有证据表明,GLP-1(9-36)和GLP-1(9-37)等GLP-1的非活性形式对肝脏有类似胰岛素的作用。GLP-1的“非活性形式”实际上并非无活性,而是通过与不同于GLP-1R的其他细胞表面受体结合,以一种新的信号通路发挥作用[48]。今后的研究应关注其他活性形式GLP-1的发现及其与靶点的相互作用,通过研究不同形式GLP-1对细胞的作用机理,为利用GLP-1系统治疗NAFLD提供更多的可能。
其次,目前对肝细胞中是否表达GLP-1R存在一定的争议,虽然一些研究称已经在肝细胞中发现了对胰岛素敏感性有影响的GLP-1R,但也有研究的结论是肝脏中没有GLP-1R的表达[49]。有研究[50]表明,GLP -1R在肝门附近的门静脉壁上表达,由于GLP-1在肝门静脉循环中被释放,所以GLP -1R可能定位于门静脉神经末梢。尽管从未在肝脏中发现GLP-1R大量表达的现象,但是与其同源的胰高血糖素受体在人肝细胞中大量表达,胰高血糖素受体可能会介导GLP-1在肝脏中的效应,肝脏中也可能存在潜在的GLP-1替代受体[51]。关于GLP-1R在肝脏中是否表达的问题仍需大量的实验研究来证实,这样才能为深入研究GLP-1R激动剂作为治疗NAFLD的药物提供确切靶点。GLP-1替代受体和GLP-1之间的作用关系是阐明GLP-1系统对NAFLD调节作用的一个全新的研究方向,可能为开发治疗NAFLD药物提供全新的思路。
最后,近年来发现的对防治NAFLD有效的药物以往大都用于治疗其他代谢类疾病,至今没有专门用于治疗NAFLD的靶向药物。GLP-1RA因具有良好的安全性而有望成为治疗NAFLD的潜在药物,但是也会导致如恶心和腹泻等副作用。同时,对于GLP-1RA治疗NAFLD的临床研究大多是小样本,且观测人群大多为2型糖尿病合并NAFLD的患者[52],现在急需挑选潜在药物针对NAFLD患者进行更大规模的长期、随机、对照试验,提供更准确的研究数据,加快NAFLD药物的研发。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:鲁彤收集文献,撰写初稿;崔泓亮收集文献,撰写并修改论文;徐立负责课题设计,资料分析,拟定写作思路,指导撰写和修改文章并最后定稿。
