降钙素基因相关肽受体成分蛋白在肝细胞癌中的表达及其与预后的关系
2022-06-23孙冠群周思蕾曾榃伦刘君宇梁喜俊
孙冠群, 周思蕾, 曾榃伦, 刘君宇, 梁喜俊, 程 卓
1 海军军医大学转化医学研究中心 临床肿瘤研究所, 上海 200433;2 海军军医大学附属东方肝胆外科医院 肿瘤科, 上海 200433
肝细胞癌(以下简称肝癌)是最常见的肝脏原发性肿瘤,致死率极高且预后差[1],5年生存率仅为18%,是继胰腺癌之后排名第2位的致死性肿瘤[2]。根据世界卫生组织年度预测,2030年或将有超过100万患者死于肝癌[3]。然而,目前尚缺少十分有效的肝癌标志物。因此,探索新的肝癌治疗靶点和预测预后复发的生物标志物至关重要。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是一种广泛表达的神经肽,属于降钙素家族,在不同器官中表达差异较大[4-5]。CGRP受体成分蛋白(CGRP receptor component protein,CRCP)与降钙素受体样受体和受体活性修饰蛋白-1共同组成CGRP受体,并参与调控体内多种信号转导过程[6]。此外,CRCP还被称为DNA指导的RNA聚合酶Ⅲ亚基RPC9,在RNA转录过程中发挥重要作用。目前,CRCP在肿瘤发生发展过程中的功能尚无研究报道。本研究旨在观察CRCP分子在肝癌和癌旁组织中的表达水平,并分析其与肝癌患者预后和临床病理数据的关系。
1 资料与方法
1.1 研究对象 收集2003年6月—2009年9月在海军军医大学附属东方肝胆外科医院行手术切除治疗的肝癌患者的肝癌组织及相应癌旁组织标本79例,记录其临床病理数据(如病理分级、肿瘤大小、是否伴有门静脉癌栓等)并进行术后随访,记录患者肿瘤复发、死亡时间,末次随访时间为2012年3月。
1.2 CRCP分子检测 免疫组化染色所用CRCP单克隆抗体购自Abcam公司。石蜡切片60 ℃烘烤1 h,二甲苯、乙醇脱蜡,室温下于3% H2O2甲醇液中放置20 min,双蒸水洗涤5 min×3次。酸性修复液煮沸,进行抗原修复15 min,自然冷却至室温,双蒸水洗涤5 min×2次,PBS洗涤1次,5 min。均匀滴加1%BSA的封闭液,使其完整覆盖整块切片, 37 ℃孵育30 min。吸弃封闭液,滴加一抗(1∶200稀释),4 ℃孵育过夜。第2天,取出切片,室温复温15 min,PBS洗涤4次,每次5 min,二抗孵育30 min,PBS洗涤5 min×4次。滴加DAB显色液显色,至切片出现明显棕色即终止,双蒸水洗涤5 min×2次,苏木素复染10 min后用1%盐酸分化1~2次,自来水流水冲洗20~30 min,洗去多余苏木素,双蒸水洗涤5 min×2次。二甲苯、乙醇脱水,滴加适量中性树脂,盖上干净盖玻片,彻底干燥后观察染色情况并扫片分析。
1.3 免疫组化芯片评分方法 免疫组化芯片利用ImageScope(Aperio公司)软件进行扫描,扫描后利用该软件的Algorithms(Positive Pixel Count)程序对每个组织点进行“阳性Pixel”分析计算,选择Positivity数据(Positivity=Positive例数/Total例数)作为分析对象。
1.4 Western Blot检测 取约3 mm×3 mm大小的肝癌与癌旁组织样本,加入M-PER裂解液研磨(70 Hz,180 s),冰上裂解10 min后,于4 ℃,12 000 r/min离心10 min。BCA法测定蛋白浓度,加入6×上样缓冲液,煮沸变性。通过10%聚丙烯酰胺凝胶电泳分离蛋白,利用电转仪将蛋白转移至硝酸纤维素膜上(100 V,60 min),使用含5%脱脂奶粉的TBST溶液封闭1 h,于TBST稀释的一抗(购自Abcam)中4 ℃孵育过夜。次日,回收一抗,TBST洗涤3次,每次10 min,加入HRP标记的兔二抗,室温孵育1 h,TBST洗涤3次后,使用ECL化学发光显色底物法检测蛋白条带。
1.5 统计学方法 采用SPSS 21.0软件进行统计学分析。计数资料两组间比较采用χ2检验。采用受试者工作特性曲线(ROC曲线)分析获得曲线下面积(AUC),评估拟合优度确定其预测效能,计算Youden指数确定最佳截断值,利用Kaplan-Meier生存分析法分析CRCP表达与肝癌复发和预后的关系,两组间比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 79例肝癌患者中,男67例,女12例,年龄10~72岁;病理分级4级1例,3级61例,2级17例;20例合并门静脉癌栓;巴塞罗那分期0期5例,A期55例,B期11例,C期8例。
2.2 CRCP分子在肝癌中的表达情况 Western Blot检测6例患者肝癌及癌旁组织中CRCP表达水平,结果显示,4例患者肝癌组织中CRCP表达水平低于癌旁组织(图1)。利用免疫组化法检测79例患者肝癌及癌旁组织中CRCP的表达水平及定位情况,60例(75.9%)的患者肝癌组织中CRCP表达水平明显低于癌旁组织(图2)。
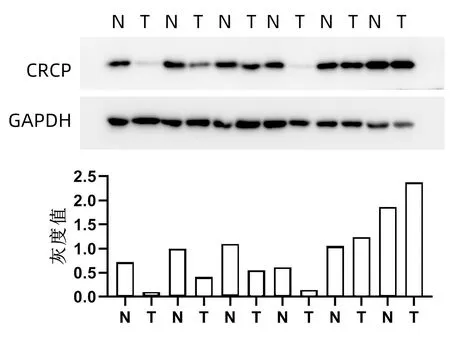
注:N,癌旁组织;T,肿瘤组织。

注:a,2例肝癌患者癌组织及癌旁组织中的CRCP表达情况(×12.8),CRCP在胞浆与胞核中均有表达,与癌组织相比,癌旁组织染色更深,提示癌旁组织中CRCP表达量更高。b,79例肝癌患者CRCP的相对表达,每位患者癌组织与癌旁组织的免疫组化评分(Positivity,简称P)相除后取log值[即log(P癌组织/P癌旁组织)]并作图,其中60例(75.9%)患者的癌组织CRCP表达量低于癌旁组织即为低表达部分,19例(24.1%)癌组织CRCP表达量高于癌旁组织即为高表达部分。
2.3 CRCP分子表达与肝癌预后的关系 使用ImageScope软件对79例患者的免疫组化芯片染色结果进行定量分析,利用SPSS 21.0软件将患者癌组织中CRCP表达量对预后(生存和复发)的影响进行ROC曲线分析,评估生存和复发的AUC分别为0.770、0.644, 计算约登指数确定CRCP最佳截断值(生存:0.425,复发:0.245),依据最佳截断值将CRCP表达分为低表达组和高表达组。采用Kaplan-Meier 生存分析法分析CRCP表达与肝癌患者生存、复发的关系,结果显示,与CRCP低表达组相比,CRCP高表达组患者的总体生存期更长,复发率更低(P值分别为<0.001、0.009)(图3)。
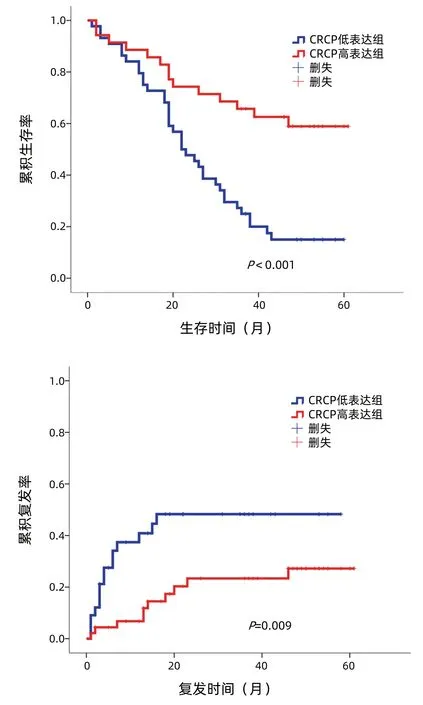
图3 肝癌组织中CRCP表达水平与患者预后的关系
2.4 CRCP表达水平与肝癌临床病理特征的关系 以上述癌组织中CRCP表达量对生存的影响进行ROC曲线分析,根据最佳截断值(0.425)将CRCP表达分为低表达组和高表达组。 CRCP低表达组CK19阳性、肿瘤包膜不完整、合并门静脉癌栓和肿瘤病理分级高的患者所占比例更高(χ2值分别为6.410、4.829、9.319、9.083,P值均<0.05),提示CRCP低表达的肝癌患者的恶性程度更高(表1)。
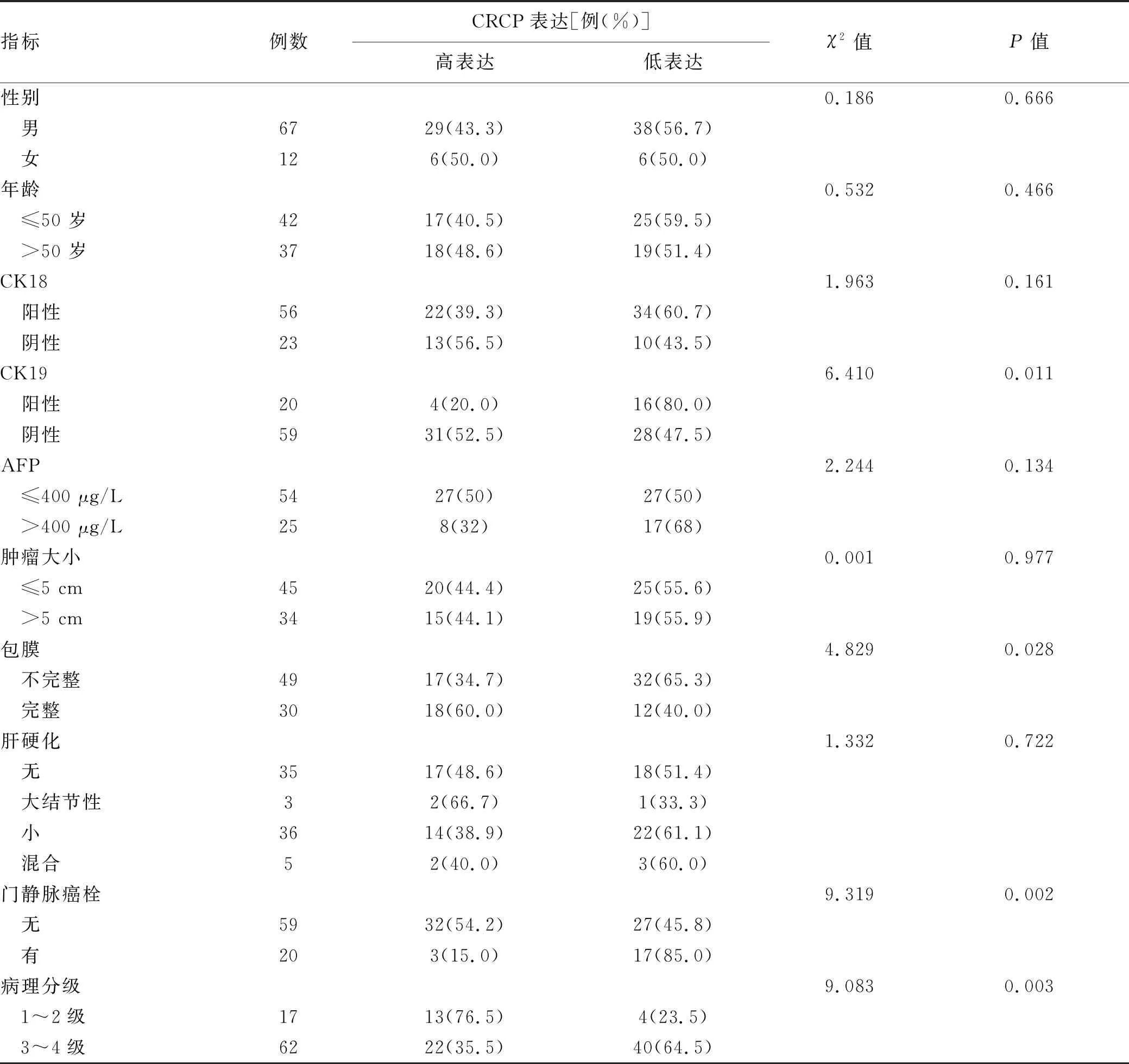
表1 CRCP分子表达与肝癌患者临床病理特征的关系
3 讨论
恶性肿瘤是全球第二大病死原因,仅次于心血管疾病。肿瘤的发生发展是一个长期的多因素共同影响的过程[7]。随着医疗技术的不断提高,部分肿瘤的诊疗手段也愈发精准、有效,但仍有很多肝癌患者因确诊较晚、肿瘤发生转移且暂无有效的治疗方法等原因死亡[8]。外科治疗是肝癌患者获得根治和长期生存的最主要途径[9],但肝癌术后复发和转移率高,尤其复发率高达70%[10]。因此,探索更多肝癌转移的治疗靶点和预测转移的分子标志物意义重大。
CRCP在细胞内通过参与降钙素受体成分蛋白和RNA聚合酶Ⅲ的形成,在CGRP信号转导和RNA合成中发挥关键作用。CGRP是由37个氨基酸残基组成的神经肽,由中枢和外周神经系统分泌[11],在心血管系统和心脏所有部位均能够被检测到[12],是最有效的血管舒张药之一[13-14]。CGRP还参与体内多种重要生理功能,例如强心作用和代谢、促炎等过程[15]。CRCP由148个氨基酸残基组成[16],作为CGRP受体的辅助蛋白存在,能够耦联CGRP受体参与下游信号转导通路[16]。研究[17]发现,CRCP的表达受炎症、神经性疼痛的影响。此外,有研究[18]发现,在斑马鱼中,CRCP通过调节P53信号调节造血干/祖细胞维持。但CRCP是否参与调控肿瘤发生发展过程尚不明确。
本研究结果显示,CRCP在肝癌组织中的表达显著低于癌旁组织。目前,关于CRCP表达的调控机制相关报道极少。Gao等[19]研究发现,在胰腺导管癌中,CGRP启动子甲基化修饰导致CGRP表达下调。刘彦梅等[20]研究发现,在血管平滑肌细胞中,CGRP可调控CRCP的表达。笔者团队推测,CRCP在肝癌中低表达机制可能与上述研究类似:CGRP高甲基化导致CGRP表达降低,最终引起CRCP表达减少。此外,微小RNA(miRNA)可通过降解靶基因mRNA或抑制靶基因mRNA翻译,下调靶基因蛋白表达水平[21]。笔者团队猜测,肝癌中CRCP分子低表达可能与相关miRNA表达上调有关。Lou等[22]研究发现miR-494-3p、miR-1207-5p和miR-1225-5p等在肝癌患者转移肿瘤组织中表达高于原位肿瘤组织,过表达miR-494-3p可促进肝癌细胞的迁移和侵袭能力。笔者团队进一步通过TargetScan 7.0数据库查询发现,miR-494-3p 、miR-1207-5p和miR-1225-5p可直接结合CRCP mRNA的3′UTR区域,据此猜测肝癌患者肿瘤组织可能通过上调上述miRNA,进而下调CRCP的蛋白表达水平。
预后分析显示,CRCP低表达的肝癌患者生存期更短,复发率更高,预后更差。同时,CRCP低表达与CK19阳性、肿瘤包膜不完整、伴有门静脉癌栓及更高的病理分级呈正相关。有研究[23]发现,CK19和GPC3联合可作为肝癌转移的参考分子,CK19+/GPC3+肝癌患者发生肝内转移、微脉管入侵、局部淋巴结入侵和远距离转移的风险更高;也有研究[24-27]显示,原发性肝癌中CK19高表达与预后差相关,CK19是原发性肝癌发生淋巴结转移的有效风险因子。有研究[28]报道,血清CK19水平高提示癌细胞低分化,恶性程度高,转移能力高。本研究的CK19阳性患者中,CRCP低表达患者占比(80%)远高于高表达患者(20%)。肿瘤包膜破损及门静脉癌栓的形成也是影响肝癌患者预后的重要因素。有研究[29]发现,与有肿瘤包膜的肝癌相比,无肿瘤包膜的肝癌血管侵犯的比例更高、分化程度更差。本研究结果显示,肿瘤外无包膜或包膜不完整的患者肿瘤组织中CRCP低表达更多。此外,合并门静脉癌栓的患者中,CRCP低表达患者占比远高于高表达患者,且肿瘤病理分级越高的患者,其CRCP低表达患者所占比例越高。据此,笔者团队提出假设:CRCP低表达患者的肿瘤可能更易发生转移,恶性程度更高。
综上所述,肝癌组织中CRCP低表达的患者预后更差,CRCP可能参与肝癌的发生发展与转移过程,该分子或可作为肝癌患者预后判定的生物标志物。但由于肝癌具有高度异质性,且本研究样本量较小,为获得更准确、详实的研究数据和结论,还需扩大样本数量开展进一步探究。
伦理学声明:本研究于2020年6月15日经由海军军医大学附属东方肝胆外科医院医学研究伦理委员会批准,所纳入患者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:孙冠群和周思蕾负责文章撰写及相关实验数据的获取;曾榃伦、刘君宇负责数据分析;梁喜俊负责文章撰写、修改指导;程卓负责关键性实验设计、文章撰写、修改指导及审定。
