高浓度地塞米松对骨髓间充质干细胞小分子非编码RNA表达的调控机制研究▲
2022-06-21彭建平王传东张晓玲
周 兴 刘 凯 彭建平 王传东* 张晓玲
(1 广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心,广西再生医学重点实验室,广西南宁市 530021;2 上海交通大学医学院附属新华医院骨科实验室,上海市 200092)
大约有3%的50岁以上成年人因过敏、炎症或癌症而接受糖皮质激素治疗。长期使用糖皮质激素会产生多种副作用,其中骨质疏松和骨折是其最常见的不良反应[1-5]。地塞米松是临床常用的一种糖皮质激素,亦是骨质疏松模型的诱导剂, Deng等[6]的研究表明,地塞米松可通过PI3K/AKT/GSK3β信号通路诱导成骨细胞凋亡,体内实验也证明高浓度地塞米松处理的大鼠中碱性磷酸酶、骨钙素等成骨相关指标表达下调[7]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)具备多向分化潜能,并且是骨髓中造血系统的关键生态位细胞[8]。在再生医学和组织工程等领域中,BMSCs因其成骨分化能力以及低免疫原性而成为理想的“种子细胞”[9]。既往研究也表明,在成人骨髓腔内BMSCs是成骨细胞的主要来源[10]。小分子非编码RNA(small non-coding RNA, sncRNA)包括转运RNA(transfer RNA,tRNA)、PIWI相互作用RNA(PIWI-interacting RNA,piRNA)、微小RNA(microRNA,miRNA)、重复相关小干扰RNA(repeat associated small interfering RNA,rasiRNA)、核仁小RNA(small nucleolar RNA,snoRNA)和核小RNA(small nuclear RNA,snRNA)等[11]。既往研究表明,地塞米松可能通过调控sncRNA影响骨重建。例如,有研究报道地塞米松通过下调miR-34a-5p的表达激活下游的Notch信号通路从而抑制BMSCs的成骨分化能力[12]。Hong等[13]的研究表明经地塞米松治疗后的坏死股骨头组织中miR-579累积增加。Tang等[14]的研究表明过表达的miR-199a可有效减弱地塞米松对BMSCs成骨分化的抑制作用。然而,地塞米松调控sncRNA进而影响BMSCs分化的相关研究目前仍主要集中于miRNA,其他sncRNA的相关研究较少。
以往的芯片测序方法只能局限于已知序列和结构的sncRNA,而高通量small RNA测序技术提供了更高的灵敏度,有助于我们发现新的sncRNA[15-17]。因此,本研究使用高通量small RNA测序技术,全面地研究地塞米松抑制BMSCs成骨分化过程中sncRNA的表达谱,以了解地塞米松抑制BMSCs成骨分化的潜在分子机制,为后续深入研究激素性骨质疏松症的靶向治疗提供参考依据。
1 材料和方法
1.1 材料与仪器 C57BL/6J小鼠购自上海吉辉实验动物饲养有限公司。α-MEM培养基(货号:B1131-053)和胎牛血清(货号:BN1630-149)购自BIOEXPLORER公司,胰蛋白酶(货号:25200072)购自ThermoFisher公司,青链霉素双抗(货号:E607011-0100)购自生工生物工程(上海)股份有限公司,茜素红(货号:A5533)、地塞米松(货号:D4902)、维生素C(货号:A5960)和β-甘油磷酸钠(货号:G9422)购自Sigma公司。酶标仪(型号:infinite M200 PRO)购自TECAN公司。
1.2 C57BL/6J小鼠BMSCs分离培养 取雄性3~4周的C57BL/6J小鼠,使用颈椎脱臼法将其处死,置于75%乙醇中消毒5 min,分离并切除股骨和胫骨上下缘。吸取3 mL左右的α-MEM完全培养基(含有10%胎牛血清、1%青链霉素双抗)将骨头冲洗至发白。将骨髓冲洗液接种于6孔板并置于37 ℃、5%CO2的培养箱中。2 d后首次换液,此后每3 d更换一次培养基,约7 d后细胞长满,将其继续传代培养至第3代用于后续实验。本研究已获得上海交通大学医学院附属新华医院医学伦理委员会的批准。
1.3 成骨分化诱导 阴性对照组(negative control,NC组)诱导液为含0.1 μmol/L地塞米松、50 μmol/L维生素C、104μmol/L β-甘油磷酸钠的α-MEM完全培养基。地塞米松组(dexamethasone,DEX组)诱导液为含10 μmol/L地塞米松、50 μmol/L维生素C、104μmol/L β-甘油磷酸钠的α-MEM完全培养基。将小鼠第3代BMSCs 以2×104个/cm2的密度接种于6孔板,使用完全培养基培养细胞,待生长融合至60%~70%后,分别更换为NC组和DEX组诱导液继续诱导,每组设3个复孔,每3 d更换一次诱导液。
1.4 钙结节染色及半定量测定 精确称量1.37 g茜素红粉末溶解于100 mL磷酸盐缓冲液(phosphate buffer solution, PBS)中,并调节pH值为4.1~4.3,放置室温备用。成骨分化诱导结束后去除培养基,使用PBS冲洗2遍,加入1 mL 4%多聚甲醛固定15 min,再使用PBS冲洗2遍,每孔加入1 mL茜素红染色液,室温孵育20 min后吸掉染色液,使用PBS冲洗2遍后进行拍照。每孔加入1 mL 0.1 mol/L氢氧化钠溶液溶解茜素红钙结节,然后震荡混匀,吸取100 μL的裂解液加入96孔板中,利用酶标仪检测548 nm处的吸光度值。
1.5 高通量small RNA测序 NC组和DEX组均在诱导3 d后去除培养基,6孔板中每孔加入2 mL PBS洗涤2遍后弃除,接着在每个孔中加入1 mL TRIzol试剂溶解RNA,将溶解液放置在-80 ℃冰箱中,样品提交给生工生物工程(上海)股份有限公司进行后续实验。实验主要流程包括从总RNA中分离small RNA、逆转录PCR扩增、small RNA建库纯化,最后采用Illumina Hiseq 2500平台进行测序。
1.6 生物信息学分析 生物信息学分析主要包括使用Trimmomatic软件过滤原始数据、Bowtie软件比对参考基因组、DESeq2软件进行差异基因分析、R软件vegan包进行主成分分析。miRNA差异基因筛选标准为倍数变化(Fold Change)≥2且P<0.05,piRNA、rasiRNA、snoRNA、snRNA差异基因筛选标准为倍数变化(Fold Change)≥1.5且P<0.05。
1.7 统计学方法 使用SPSS 17.0统计学软件进行数据分析,所有数据均以均数±标准差(x±s)表示,两组间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 茜素红染色与钙结节含量检测结果 茜素红染色结果显示,与NC组相比,DEX组茜素红染色变浅(图1A)。对茜素红染色进行半定量检测,结果显示,与NC组相比,DEX组钙结节含量显著降低(P<0.01)。见图1B。
2.2 miRNA的表达 热图分析结果显示NC组和DEX组miRNA的表达模式存在差异(图2A)。火山图显示,与NC组相比,DEX组中有6个miRNAs表达上调,19个miRNAs表达下调(图2B)。DEX组与NC组的差异基因中,|log2Fold Change|≥1的miRNAs有25个,其中DEX组的6个miRNAs表达上调,19个miRNAs表达下调(均P<0.05),见表1。主成分分析结果显示,基于miRNA差异表达情况进行数据降维,能够很好地区分NC组和DEX组,保证分析结果的可靠性(图2C)。此外,基因本体论(Gene Ontology,GO)分析结果显示,上调的差异miRNAs的靶基因主要参与蛋白质磷酸化、肌肉和器官发育、细胞黏附等生物过程(图2D),下调的差异miRNAs主要参与蛋白质自磷酸化、蛋白质泛素化、细胞内雌激素受体信号通路、细胞增殖等生物过程(图2E)。京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析显示,上调的差异miRNAs主要富集在脂肪合成相关信号通路、Ras信号通路、钙信号通路等(图2F),下调的差异miRNAs主要富集在Wnt信号通路、Hippo信号通路等(图2G)。

表1 DEX组与NC组差异表达的miRNAs

图2 两组miRNA的表达
2.3 piRNA的表达 热图分析结果显示NC组和DEX组piRNA的表达模式存在差异(图3A)。火山图显示,与NC组相比,DEX组中有34个piRNAs表达上调,6个piRNAs表达下调(图3B)。DEX组与NC组的差异基因中,|log2Fold Change|≥1的piRNAs有3个,其中DEX组的mmu_piR_025570表达上调,mmu_piR_026493、mmu_piR_026351表达下调(均P<0.05)。主成分分析显示,基于piRNA差异表达情况进行数据降维,能够很好地区分NC组和DEX组,保证分析结果的可靠性(图3C)。

图3 两组piRNA的表达
2.4 rasiRNA的表达 热图分析结果显示NC组和DEX组rasiRNA的表达模式存在差异(图4A)。火山图显示,与NC组相比,DEX组中有3个rasiRNAs表达上调,2个rasiRNAs表达下调(图4B)。DEX组与NC组的差异基因中,|log2Fold Change|≥1的rasiRNAs有2个(LTR、LTR/ERV1),两者在DEX组中的表达均上调(均P<0.05)。主成分分析显示,基于rasiRNA差异表达情况进行数据降维,能够很好地区分NC组和DEX组,保证分析结果的可靠性(图4C)。

图4 两组rasiRNA的表达
2.5 snoRNA的表达 热图分析结果显示NC组和DEX组snoRNA的表达模式存在差异(图5A)。火山图显示,与NC组相比,DEX组中有12个snoRNAs表达上调,11个snoRNAs表达下调(图5B)。DEX组与NC组的差异基因中,|log2Fold Change|≥1的snoRNAs有8个,其中DEX组有6个snoRNAs表达上调,2个snoRNAs表达下调(均P<0.05),见表2。主成分分析显示,基于snoRNA差异表达情况进行数据降维,能够很好地区分NC组和DEX组,保证分析结果的可靠性(图5C)。
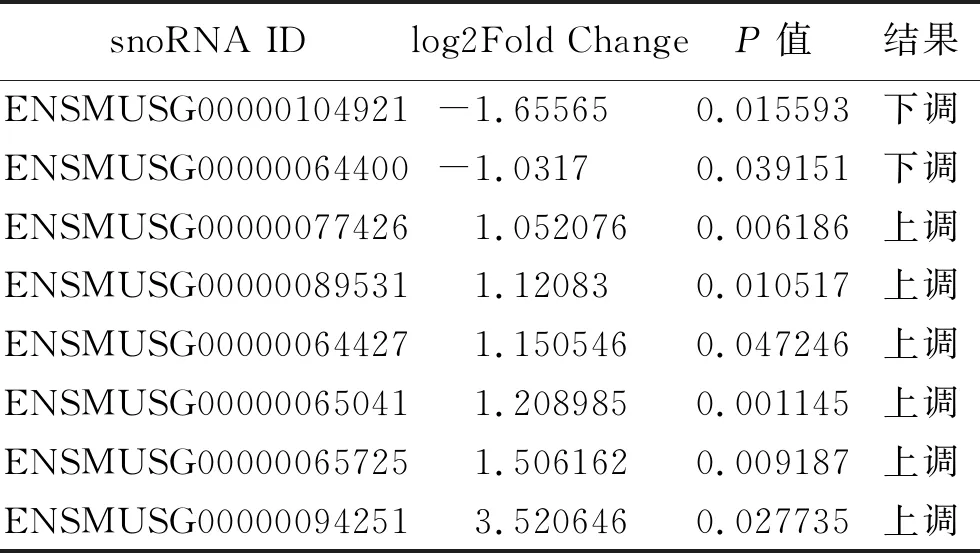
表2 DEX组与NC组差异表达的snoRNAs

图5 两组snoRNA的表达
2.6 snRNA的表达 火山图分析表明,与NC组相比,DEX组中有3个snRNAs表达下调(图6A)。差异基因中,|log2Fold Change|≥1的snRNA仅有ENSMUSG00000064856,该基因在DEX组中的表达下调(P<0.05)。主成分分析显示,基于snRNA差异表达情况进行数据降维,能够很好地区分NC组和DEX组,保证分析结果的可靠性(图6B)。
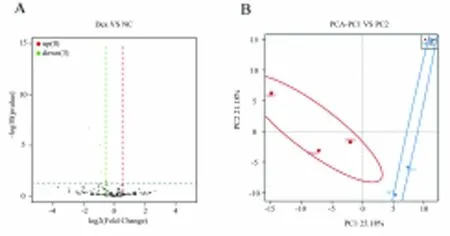
图6 两组snRNA的表达
3 讨 论
骨质疏松症的常见病因包括雌激素缺乏、某些药物如糖皮质激素的大量使用、吸烟以及遗传因素等[18]。糖皮质激素可以影响骨重建中的多种细胞类型,包括BMSCs、成骨细胞、破骨细胞等[6,19-21]。长期使用糖皮质激素类药物可促进BMSCs的凋亡进而导致骨形成减少[22]。由此可见,深入研究糖皮质激素抑制BMSCs成骨分化潜在的分子机制,对于理解糖皮质激素治疗后发生骨质疏松症等疾病至关重要。
本研究结果显示,与NC组相比,DEX组茜素红染色变浅,钙结节含量显著降低(P<0.001)。王伟等[23]使用0.001 μmol/L至10 μmol/L浓度的地塞米松诱导脂肪来源的干细胞成骨分化,结果显示0.01μmol/L浓度的地塞米松诱导成骨后其矿化程度达到最高峰,而随着地塞米松浓度的升高,干细胞成骨分化能力被显著抑制。由此可见,高浓度地塞米松显著抑制BMSCs的成骨分化能力。
本研究的测序结果主要包括miRNA、piRNA、rasiRNA、snoRNA和snRNA五大类,其中miRNA、piRNA、snoRNA为有较多显著性差异表达的基因。本研究结果显示,DEX组miR-490-3p、miR-451a、miR-675-3p、miR-150-5p的表达显著下调(均P<0.05)。既往研究结果显示,在胸椎黄韧带骨化疾病中,过表达miR-490-3p可直接靶向FOXO1并抑制其表达,从而负调控胸椎黄韧带细胞的成骨分化[24]。此外,miR-451a、miR-675-3p等靶向骨形态发生蛋白通路调控骨形成[25]。Wang等[26]的研究表明miR-150-5p与BMSCs成骨分化正相关。然而,上述基因在地塞米松抑制成骨分化中的作用尚未完全明确。此外,本研究还发现了mmu-novel-1、mmu-novel-121等尚未被数据库收录的miRNAs,这些miRNAs具体的生物学功能有待后续进一步研究。
GO分析和KEGG分析表明,高浓度地塞米松上调的miRNAs主要富集的信号通路与脂肪合成相关,而下调的miRNAs主要富集于Wnt信号通路、Hippo信号通路,这些信号通路与成骨相关[27-28]。He等[29]报道在地塞米松诱导的骨质疏松症模型中,过氧化物酶体增殖物激活受体-γ表达增强,并通过靶向Wnt/β-catenin信号通路调节BMSCs成骨分化。此外,地塞米松处理后的干细胞外泌体中miR-365a-5p可有效激活Hippo信号通路进而促进成骨分化[30]。因此,这提示了高浓度地塞米松可能靶向调控多个miRNAs及通路,通过促进BMSCs成脂肪分化能力以及抑制成骨分化能力等加重骨骼稳态失衡。
本研究发现了34个piRNAs表达呈显著性上调,而有6个piRNAs表达显著性下调;3个rasiRNAs表达显著性上调,而有2个rasiRNAs表达显著性下调;12个snoRNAs表达显著性上调,11个snoRNAs表达显著性下调;3个snRNAs表达显著性下调。本研究中,DEX组的LTR显著上调了4.5倍左右(P<0.05),既往研究报道LTR是骨形态发生蛋白4的下游靶基因,但其对于成骨分化的作用尚未明确[31]。其他的piRNA、rasiRNA、snoRNA和snRNA目前尚无可用的数据库进行功能预测,未来需要进行更多的研究探索这些sncRNAs在糖皮质激素抑制BMSCs成骨分化过程中的作用。
本研究通过使用高通量small RNA测序技术检测地塞米松抑制BMSCs成骨分化过程中sncRNA的表达情况,这些sncRNA受到地塞米松调控并且可能通过下游靶基因间接调控BMSCs的成骨分化潜能,这也提示了表观遗传修饰在其中的广泛参与。本课题组将在后续研究中筛选出预测miRNA的靶基因,此外在细胞和动物模型上进一步验证相关的miRNA在激素性骨质疏松症中的生物学功能。目前除miRNA以外的sncRNA尚缺乏成熟的生物学方法进行验证,且其相关的数据库尚未完善,因此我们将继续深入研究这些sncRNAs及其靶基因,为未来糖皮质激素诱导的骨质疏松症的治疗提供新的理论基础。
