复方苦参注射液通过保护线粒体防治大鼠急性放射性皮炎的研究
2022-06-21许文婧马玥诗王佩马理海汪宇宏杨志祥程俊高丽萍
许文婧,马玥诗,王佩,马理海,汪宇宏,杨志祥,程俊,高丽萍
(重庆市中医院,重庆 400021)
放射疗法(简称放疗)是治疗恶性肿瘤最重要的三大手段之一,据国内外统计,约有2/3 的肿瘤患者在病程不同阶段出于不同目的的需要进行放射治疗[1]。放射性皮炎作为放射疗法最常见的并发症之一,有报道称其发病率约为87%,其中3 级以上的严重皮炎约占10%~15%[2]。放射性皮炎可使患者皮肤红肿、疼痛、渗液和并发感染,甚至发生溃疡和坏死,给患者造成较严重的身心负担,降低患者生存质量。对于如乳腺癌、外阴癌、头颈部肿瘤、肛管癌部位的肿瘤等,放射性皮炎一般较重,甚至会导致放疗计划中断、延期甚至终止,使疗效大受影响。因此,放射性皮炎的预防和治疗,一直困扰着广大放疗工作者。
当前西医的应对策略是通过优化放疗计划尽可能减轻放射性皮炎,并以药物治疗为主的综合治疗策略。目前所用治疗药物主要是激素类软膏、含超氧化物歧化酶的放疗防护膏、复方维生素B12混合液、高分子材料软膏、生长因子类软膏等,有一定局限性[3]。根据中医学观点,放射线其性属热邪,在其治疗肿瘤的同时,会造成热毒壅盛、热入营血,外发于肌肤则见红斑;火毒郁结于肌肤、皮肤热盛而肉腐,则见脱屑或溃疡;血失濡润、热蕴毒结,瘀阻经络,热邪伤阴,而至灼痛或瘙痒[4],因此中医治疗本病以“清热解毒”为要,清热解毒类中药如芦荟、黄芩、黄连、黄柏和苦参等已经在治疗方面获得不错的疗效[5]。复方苦参注射液以其“清热利湿、凉血解毒、散结止痛”的功效,已在抗肿瘤、放化疗增敏以及减轻肿瘤放化疗副反应方面取得较好的临床效果[6];但是当前研究多以临床观察为主,缺乏更加深入的基础研究。因此本实验通过观察比较复方苦参注射液对放射性皮炎模型大鼠的疗效,进一步探讨其在放射性皮炎反应中的治疗作用和机制。
1 材料和方法
1.1 实验动物
7~8 周龄SD 雌性大鼠[湖南斯莱克实验动物有限公司,许可证号:SCXK(湘)2019-0004],共30 只,体质量180~200 g,喂养于重庆市中医院SPF 级动物实验室,环境温度25 ℃,湿度50%~55%,以纯化水和大鼠灭菌专用饲料(江苏省协同医药生物工程有限责任公司)饲养。
1.2 主要试剂与仪器
复方苦参注射液(山西振东制药股份有限公司,批号:Z14021230);Gluta 电镜固定液、线粒体提取试剂盒SM0020(北京索莱宝科技有限公司);大鼠白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(北京四正柏生物科技有限公司);延胡索酸、顺乌头酸酶试剂盒,大鼠8-羟基脱氧鸟苷(8-OHDG)ELISA 试剂盒(上海酶联生物科技有限公司)。
直线加速器(医科达Synergy);转轮式切片机(徕卡-2016,德国);JT-12S 自动组织脱水机(武汉俊杰电子有限公司);BMJ-A 型包埋机(常州郊区中威电子仪器厂);RS36型全自动染色机(常州派斯杰医疗设备有限公司);PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);数字切片扫描仪(Pannoramic 250,济南丹吉尔电子有限公司)。
1.3 分组与造模
将30 只SD 大鼠随机分为空白对照组、放疗模型组、皮肤给药组、腹腔给药组和联合治疗组。除空白对照组外,其余组大鼠采用直线加速器照射的方式于右侧大腿皮肤处建立放射性皮炎模型。在造模开始前1日,对大鼠右侧大腿皮肤予以剃毛处理,以便于后期进行皮肤状态观察。采用10% 水合氯醛(0.3 mL/100 g)对大鼠进行腹腔注射麻醉,俯卧位固定于大鼠固定板上,采用直线加速器以4 mV X 射线源皮距100 cm 处照射大鼠右侧大腿皮肤,射野为2.5 cm × 2.5 cm 的矩形野,单次剂量为30 Gy,建立急性放射性皮炎模型。
1.4 给药方法
本次研究已在前期进行了预实验,并通过课题组其他实验的数据,得出复方苦参注射液的优化治疗剂量为0.3 mL/100 g。自照射后第2天起开始治疗,皮肤给药组予以复方苦参注射液照射区域皮肤湿敷,每天2 次,每次10 min;腹腔给药组以0.3 mL/100 g 剂量进行复方苦参注射液腹腔注射,每日1 次;联合治疗组同时予以复方苦参注射液皮肤湿敷以及腹腔给药;空白对照组、放疗模型组给予等量生理盐水1 mL 腹腔注射以及患处湿敷。连续处理14 d。
1.5 标本采集与检测指标
1.5.1 放射性皮炎分级
参考人类急性放射反应评分标准(RTOG/EORTC)将放射性皮炎分为0~5 级:0 级为无变化;1 级为出现点、片状红斑和干性脱皮;2 级为出现明显面积红斑、少量湿性脱皮、轻度水肿;3 级为中度以上水肿,大面积的湿性脱皮;4 级为大面积皮肤溃疡、出血、坏死;5 级为因为放射性皮炎死亡。末次给药后,观察大鼠的一般情况及皮肤改变情况,并及时记录。
1.5.2 皮肤组织病理形态
于最后一次给药的次日,采用颈椎脱臼法处死大鼠,剪去大腿右侧皮肤,用4 ℃磷酸盐缓冲液(PBS)冲洗,剪碎为约0.5 cm×1.0 cm的大小,分别置于福尔马林中固定,并冻存于-80 ℃冰箱备用。另剪取0.1 cm × 0.1 cm 大小的皮肤组织放置于电镜固定液中。在福尔马林中固定24 h后,常规梯度酒精脱水、二甲苯透明、石蜡包埋、组织切片及常规HE染色,观察大鼠皮肤结构、炎症细胞浸润等情况。
1.5.3 皮肤组织细胞超微结构
电镜固定液中固定的标本送陆军军医大学基础实验室做电镜组织包埋、切片,在电镜下观察细胞超微结构的改变。
1.5.4 皮肤组织IL-6、TNF-α表达情况
将大鼠的皮肤组织在液氮下进行研磨,再经超声匀浆,细胞匀浆液3 000 r/min 离心10 min 后取得上清液,按试剂盒说明书进行酶联免疫吸附测定法(ELISA)测定IL-6、TNF-α的相对表达量。
1.5.5 皮肤组织线粒体延胡索酸酶、顺乌头酸酶、8-羟基脱氧鸟苷(8-OHDG)表达量
按线粒体提取试剂盒说明书进行梯度离心操作提取细胞线粒体,ELISA 试剂盒进行组织8-OHDG 测定;按延胡索酸试剂盒说明书处理标本,再使用分光光度法,检测450 nm 吸光度值;按顺乌头酸酶试剂盒说明书处理样本,再使用分光光度法,检测340 nm 吸光度值,通过标准曲线法计算以上酶的活性。
1.6 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,多组间均值比较采用单因素方差分析,若Levene 检验方差齐,则采用单因素方差分析进行总均值比较,然后采用LSD 法进行两两比较,若Levene 检验方差不齐,则改用welch 检验进行总体均值比较,然后再采用Dunnett T3 检验进行两两比较;等级资料进行秩和检验,进一步用秩变换分析方法进行组间比较。以P<0.05 代表差异具有统计学意义。
2 结果
2.1 各组大鼠放射性皮炎分级比较
空白对照组大鼠大腿皮肤未见异常,毛发生长良好;放疗模型组大鼠皮肤反应在2~3级,以3级反应为主;皮肤给药组大鼠皮肤反应在1~3 级,以2 级为主;腹腔给药组大鼠皮肤反应在1~2级,以1级为主;联合治疗组大鼠皮肤反应在1~2 级,以2 级为主。见图1。各组大鼠放射性皮炎分级情况经等级数据进行秩和检验(Kruskal-Wallis 法)后发现放射性皮炎的总体分布差异具有统计学意义(χ2=52.084,P<0.001);进一步用秩变换分析方法进行组间比较,发现皮肤给药组与放疗模型组的差异无统计学意义(P=0.240),腹腔给药组与联合给药组的差异无统计学意义(P=0.419),其余各组差异均有统计学意义(P<0.05)。见表1。
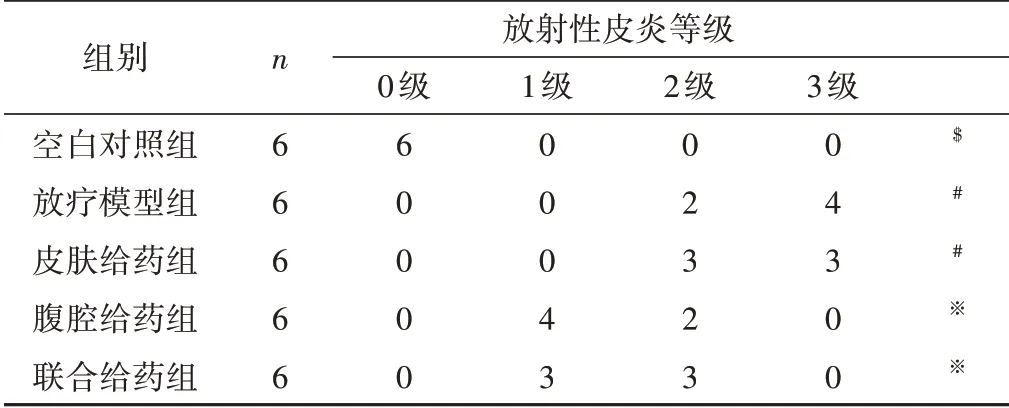
表1 各组大鼠放射性皮炎分级(例)

图1 各组大鼠放射性皮炎分级比较
2.2 各组大鼠皮肤组织病理形态及电镜下超微结构比较
空白对照组大鼠皮肤组织表皮结构完整清晰,角化层明显,复层扁平上皮层较薄,细胞排列整齐紧密;真皮层内胶原纤维交错排列,较致密,胞质红染、均匀;毛囊和皮脂腺等附属器结构完整,皮下结构清晰可见。放疗模型组大鼠皮肤组织角化层明显,复层扁平上皮层明显增厚;真皮层内胶原纤维较疏松,少量表皮层细胞坏死,胞核崩解或消失,毛囊和皮脂腺等附属器数量较少,较多毛囊坏死,内部结构均消失,且伴有杆状核中性粒细胞浸润及淋巴细胞浸润。皮肤给药组表皮角化层明显,复层扁平上皮层增厚,真皮层少量的胶原纤维坏死,胞核固缩,毛囊和皮脂腺等附属器数量稍少,少许杆状核中性粒细胞浸润。腹腔给药组大鼠皮肤组织表皮结构完整清晰,角化层明显,复层扁平上皮层稍有增厚,真皮层内胶原纤维多呈交错排列,毛囊和皮脂腺等附属器数量较多,少许杆状核中性粒细胞浸润,皮下结构清晰可见。联合治疗组大鼠皮肤组织表皮结构完整清晰,角化层明显,真皮层少量的胶原纤维坏死,胞核固缩,少量毛囊坏死;伴粒细胞及淋巴细胞浸润,皮下结构清晰可见。见图2。

图2 各组大鼠皮肤组织光镜图(HE,×100)
空白对照组大鼠皮肤细胞排列整齐紧密;基底膜细胞伪足多,见桥粒链接致密,核糖体等细胞器丰富,线粒体数量多、形态正常。放疗模型组大鼠皮肤细胞排列疏松,细胞连接疏松,基底膜伪足明显减少,核糖体高尔基体等细胞器减少,线粒体明显减少,形态难以辨认。皮肤给药组大鼠见皮肤细胞排列较为紧密,基底膜伪足减少,见部分核固缩,但线粒体明显空泡肿胀、部分线粒体结构破坏。腹腔给药组大鼠皮肤细胞排列致密,桥粒链接较多,但部分线粒体出现空泡肿胀,线粒体嵴减少。联合治疗组大鼠皮肤排列致密,较多线粒体出现空泡肿胀,线粒体嵴减少及断裂、嵴排列紊乱。见图3。

图3 大鼠皮肤细胞透射电镜图(×20 000)
2.3 各组大鼠皮肤组织IL-6、TNF-α表达量比较
各组大鼠皮肤组织中IL-6、TNF-α水平分布差异总体具有统计学意义(P<0.001),经LSD法两两分析后发现,除了腹腔给药组与联合给药组的IL-6、TNF-α水平差异无统计学意义外(P=0.431,P=0.334),其余各组差异均有统计学意义(P<0.05)。见表2。
表2 各组大鼠皮肤组织IL-6、TNF-α的表达(±s,ng/mL)

表2 各组大鼠皮肤组织IL-6、TNF-α的表达(±s,ng/mL)
注:IL-6、TNF-α的总体分布差异均具有统计学意义,P <0.001;数据后面所标相同符号表示差异无统计学意义,P >0.05,所标符号不同表示差异有统计学意义,P <0.05。
组别空白对照组放疗模型组皮肤给药组腹腔给药组联合给药组n6 6 6 6 6 IL-6 211.17±6.53#335.26±18.81$290.98±20.19*250.26±15.75※257.31±10.57※TNF-α 102.37±6.71#189.50±9.34$161.48±3.89*132.32±5.01※136.51±9.92※
2.4 各组大鼠皮肤组织线粒体延胡索酸酶、顺乌头酸酶、8-OHDG表达量比较
各组大鼠皮肤组织中延胡索酸酶、顺乌头酸酶水平差异总体具有统计学意义(P<0.001),经LSD 法两两分析后发现皮肤给药组与放疗模型组的差异无统计学意义(P= 0.196,P= 0.136)、腹腔给药组与联合给药组的差异无统计学意义(P= 0.053,P=0.074),其余各组差异均有统计学意义(P<0.05);各组大鼠皮肤组织中8-OHDG 分布不符合方差齐性,使用welch 检验发现总体差异具有统计学意义(P<0.001),经Dunnett T3 法两两分析后发现,除腹腔给药组与联合给药组的差异无统计学意义(P=0.946)外,其余各组的差异均有统计学意义(P<0.05)。见表3。
表3 各组大鼠延胡索酸酶、顺乌头酸酶、8-OHDG的表达(±s,ng/mL)

表3 各组大鼠延胡索酸酶、顺乌头酸酶、8-OHDG的表达(±s,ng/mL)
注:延胡索酸酶、顺头乌酸酶、8-OHDG 的总体分布差异均具有统计学意义,P <0.001;数据后面所标相同符号表示组间差异无统计学意义,P >0.05,所标符号不同表示组间差异有统计学意义,P <0.05。
组别空白对照组放疗模型组皮肤给药组腹腔给药组联合给药组n6 6 6 6 6延胡索酸酶62.58±4.89#42.41±3.45$45.35±4.24$56.51±2.81※52.01±3.46※顺乌头酸酶31.75±1.87#22.61±1.16$23.90±1.49$27.99±0.89※26.43±1.62※8-OHDG 23.93±0.42#45.47±2.21$38.84±1.91*31.61±2.15※32.91±2.06※
3 讨论
放射性皮炎是放疗过程中由电离辐射照射引起的皮肤黏膜炎症性损害,表现为疼痛、红肿等皮炎反应,色素沉着,或表皮糜烂、脱皮,继之形成溃疡,皮脂腺、汗腺的毁损、皮肤可逆或永久萎缩,永久性的毛发缺失,甚至放射性坏死。电离辐射造成的生物学效应主要分为直接作用和间接作用,间接作用约占放疗2/3,其主要是指活性氧(ROS)产生的作用[7]。线粒体作为内源性ROS 产生以及代谢的主要细胞器以及细胞内主要能源代谢产生的场所,其DNA 以及酶的活性与正常生理功能及放疗敏感性密切相关[8]。在放射性心肌损伤模型中发现,线粒体膜的结构发生改变,通透性增强,膜两侧的离子平衡紊乱,使其进行性肿胀,结构发生破坏。而对线粒体膜具有稳定和保护作用的苦参能保持细胞内离子的相对稳定,对放疗引起的心肌损伤起到保护作用,提示针对线粒体的保护可能减轻放射性损伤[9]。已经有文献报道,复方苦参注射液的主要有效成分苦参碱及氧化苦参碱等在其他模型中对线粒体具有保护作用,张鸣号等发现氧化苦参碱能对抗大鼠感染性休克引起的心肌线粒体结构和功能损伤、改善感染性休克过程中心肌细胞能量代谢状况,减少心肌细胞损伤[10]。鄢卫华发现氧化苦参碱可以改善大鼠脑线粒体氧化磷酸化效率、提高缺氧模型大鼠脑线粒体膜电位,抑制缺氧引起的线粒体脱耦联效应,增加ATP 生成,从而使得密闭缺氧小鼠的存活时间明显提高,且有量效依赖效果[11]。因此本课题组推测,在临床使用中复方苦参注射液减轻放射性炎症反应的机制,可能是通过保护线粒体来达到的。
复方苦参注射液由苦参和白土苓提取精制而成,具有缓解癌性疼痛、出血,放化疗增效减毒等效果,苦参与白土苓的配伍,比起使用单味药材,增强了抗炎、止痛和止血功效[12]。在本次试验中发现,复方苦参注射液在减轻放射性皮炎上方面较为明显的效果,腹腔给药组和联合治疗组大鼠放射性皮炎的发生严重程度较轻;与放疗模型组相比,腹腔给药组、联合治疗组大鼠皮肤组织炎症因子IL-6 与TNF-α 的含量显著降低,提示复方苦参注射液能减轻放射线诱导的炎症反应。在光镜和电镜下,发现腹腔给药组、联合治疗组大鼠皮肤组织和细胞微结构的损伤相对较小,特别是皮肤细胞线粒体的空泡、臌胀现象明显减少。线粒体的几个关键酶,如与三羧酸循环相关酶延胡索酸酶(其活性中心无硫铁簇,不受氧自由基影响)以及三羧酸循环限速顺乌头酸酶(NO 信号传导的重要靶酶和效应器,受氧化自由基抑制)的活性也较放疗模型组更高,而DNA 氧化损伤标志物8-OHDG 的含量则更低,以上表现提示经复方苦参注射液干预,大鼠皮肤组织线粒体的结构、相应酶的功能及细胞的氧化损伤均得到减轻。可以认为,复方苦参注射液具有减轻放射性炎症反应、保护皮肤组织及细胞结构的效果,其机制可能与保护线粒体结构和其关键酶功能有关。
在试验中发现,腹腔注射组、联合治疗组的对放射性皮炎的改善效果明显优于皮肤给药组,但皮肤给药组的效果与放疗模型组之间比较差异无统计学意义,这一现象与试验预期有所差异。经研究以及课题组组内讨论分析,认为可能由以下原因导致:①药物有效成分的渗透性差异,可能部分有效成分因分子量或极性的原因,在药物外敷时进入皮肤真皮深层减少,无法起到相应的效果。②在实际试验过程中发现,经历湿敷时SD 大鼠均出现了强烈的攻击和挣扎行为,与通常SD 大鼠较为温顺的行为不符,提示药物湿敷可能对大鼠造成了不适。经研究分析,正常皮肤微环境为偏酸性的,pH 值大概在4.5~6.5 左右,而该药物pH 值偏碱性(实测pH 值在7.5~8.5 之间),这可能与药物含有较多的活性生物碱有关,而偏碱性的药物直接湿敷可能对皮肤造成了刺激,特别是在放疗后皮肤损伤的情况下。③老鼠具有舔舐行为,实验过程中发现大鼠会舔舐湿敷后的皮肤,可能会将附着于皮肤表面的药液舔舐掉,无法保持皮肤有效药用浓度和作用时间,也可能影响到药物外用的效果。
综上所述,苦参注射液能防治大鼠急性放射性皮炎,其机制可能与保护线粒体的结构和酶的功能有关,这一结果为其在临床治疗放射性皮炎的有效性上提供了一定的理论依据;实验结果亦提示若在临床上如湿敷外用,需要注意皮肤刺激性或进一步研究更适合的药物剂型或载体。
