胫骨横向骨搬移术促进重度糖尿病足创面愈合机制的初步研究▲
2022-06-20麻仕玺花奇凯邝晓聪
麻仕玺 花奇凯* 邝晓聪 韦 姣 莫 燕 候 俊
(1 广西医科大学第一附属医院关节外科,广西南宁市 530021;2 广西医科大学基础医学院,广西南宁市 530021;3 广西医科大学玉林校区,广西玉林市 537000)
糖尿病足创面是一种典型的难愈性创面,目前采用胫骨横向骨搬移(tibial transverse transport,TTT)技术治疗效果显著[1],其可促进创面原组织再生修复[2],但对该技术治疗效果的生物学机制尚未清楚。本研究通过观察创面再生愈合时相变化及微血管形成和巨噬细胞极化情况,对TTT技术促进糖尿病足创面愈合的作用机制作初步探讨。
1 对象及方法
1.1 观察对象 选择2017~2020年在广西医科大学关节外科住院治疗的重度糖尿病足患者61例为研究对象,患者年龄34~83(60.82±9.91)岁,糖尿病足病程1~72(5.43±9.96)个月,Wagner分级3~5级。考虑到免疫组化检测的资金及患者依从性问题,从61例患者中随机挑选Wagner分级3、4、5级各4例患者进行创面边缘组织免疫组化检测,12例患者均知情同意。
1.2 纳入标准及排除标准 纳入标准: (1)糖尿病足Wagner分级3~5级;(2)患者院外经血糖控制、创面换药,创面依然迁延不愈。排除标准:B超或血管造影检查显示患者腘动脉流出道狭窄>85%;患者因客观或主观因素不配合手术及后期治疗;患者近期发生过心脑血管事件或存在心脑血管疾病的危险因素。
1.3 材料 鼠抗人CD86、CD163、CD31、血管内皮生长因子(vascular endothelial growth factor, VEGF)单克隆抗体(美国CST公司),含10 mL/kit正常羊血清原液、生物素标记羊抗鼠IgG、1 mL/kit辣根酶标记链霉卵白素原液3种试剂的免疫组化染色试剂盒(厂家:中国碧云天生物技术有限公司)。
1.4 方法
1.4.1 创面边缘组织免疫组化检测 (1)取材固定:切取创面边缘组织于10%的福尔马林溶液中固定;(2)浸蜡包埋;(3)切片贴片;(4)脱蜡水化:二甲苯溶液通透,使用浓度分别为100%、95%、80%、70%的乙醇溶液及蒸馏水依次浸泡;(5)抗原热修复:修复液中持续煮沸5 min,冷却;(6)磷酸缓冲溶液(phosphate buffer solution,BPS)冲洗;(7)内源性过氧化物酶活性灭活:3%过氧化氢溶液浸泡,置于37 ℃温箱15 min;(8)BPS冲洗;(9)封闭非特异蛋白:山羊血清;(10)Ⅰ抗孵育:(添加鼠抗人CD86、CD163、CD31、VEGF单克隆抗体1 ∶500),置于4 ℃冰箱过夜;(11)37 ℃温箱复温,BPS冲洗;(12)Ⅱ抗孵育:滴加生物素标记羊抗鼠IgG(1 ∶100),37 ℃温箱孵育15 min;(13)BPS冲洗;(14)滴加辣根过氧化物酶标记链霉亲和素稀释液(1 ∶100),37 ℃温箱放置15 min;(15)BPS冲洗;(16)二氨基联苯胺显色;(17)BPS冲洗;(18)苏木素复染;(19)1%盐酸酒精分化液分化;(20)饱和碳酸锂溶液返蓝;(21)浓度分别为75%、90%、95%、100%的乙醇溶液依次脱水,二甲苯溶液通透;(22)中性树胶封片、显微镜下观察染色情况,分别取3个视野,统计每个视野下阳性细胞数。
1.4.2 创面边缘组织HE 染色 (1)取材固定:取创面边缘组织于10%的福尔马林溶液中固定;(2)浸蜡包埋;(3)切片贴片;(4)脱蜡水化:二甲苯脱蜡,用浓度分别为100%、95%、75%的乙醇溶液及蒸馏水依次浸泡水化;(5)染色:苏木素染色,1%盐酸酒精分化液分化,水洗,饱和碳酸锂溶液返蓝,75%乙醇溶液脱水,伊红染色液染色;(6)脱水通透:95%、100%乙醇溶液脱水,用二甲苯乙醇溶液(1 ∶1)、二甲苯依次浸泡。
1.5 观察指标 (1)观察患者术后创面的愈合情况。(2)术前、术后1个月创面边缘组织CD86及CD163免疫组化染色结果、阳性细胞计数和M1/M2值(分别以CD86、CD163单克隆抗体标记M1、M2型巨噬细胞,应用Image Pro Plus 6.0软件统计阳性细胞计数,CD86阳性细胞数与CD163阳性细胞数之比即为M1/M2值),以及CD31和VEGF免疫组化染色结果、阳性细胞计数变化。(3)术前、术后1个月创面边缘组织HE染色情况。(4)术前及术后1个月,行足部血管造影检查观察足部微血管变化。
1.6 统计学方法 采用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,术前术后比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 创面愈合情况 61例患者创面全部愈合,愈合时间为1~12(3.83±2.31)个月。创面愈合过程基本按炎症期、增殖期和重塑期3个阶段发展,炎症期可见创面黄白、渗液、组织坏死(图1A、1B);增殖期溃疡创面炎症逐渐消退,开始出现粉红色颗粒状肉芽组织,创面边缘上皮组织逐渐向创面中心爬行(图1C、1D);重塑期愈合的创面皮肤外观逐渐接近正常组织(图1E)。创面愈合期间有部分患者会出现炎症期反复和炎症期与增殖期的重叠。





图1 不同时期的创面愈合过程形态变化
2.2 创面边缘组织免疫组化染色结果 术前CD86阳性细胞呈带状分布于表皮中,术后1个月可见阳性细胞减少,呈散在分布(图2)。术前CD163阳性细胞主要位于真皮层中,术后1个月可见阳性细胞比术前明显减少(图3)。术前VEGF阳性细胞较少,术后比术前明显增多(图4)。术前CD31阳性细胞较少,术后比术前明显增多,并呈细小条索状串联,微血管数量增多(图5)。

图2 创面边缘组织CD86免疫组化染色情况(×40、×100、×400)
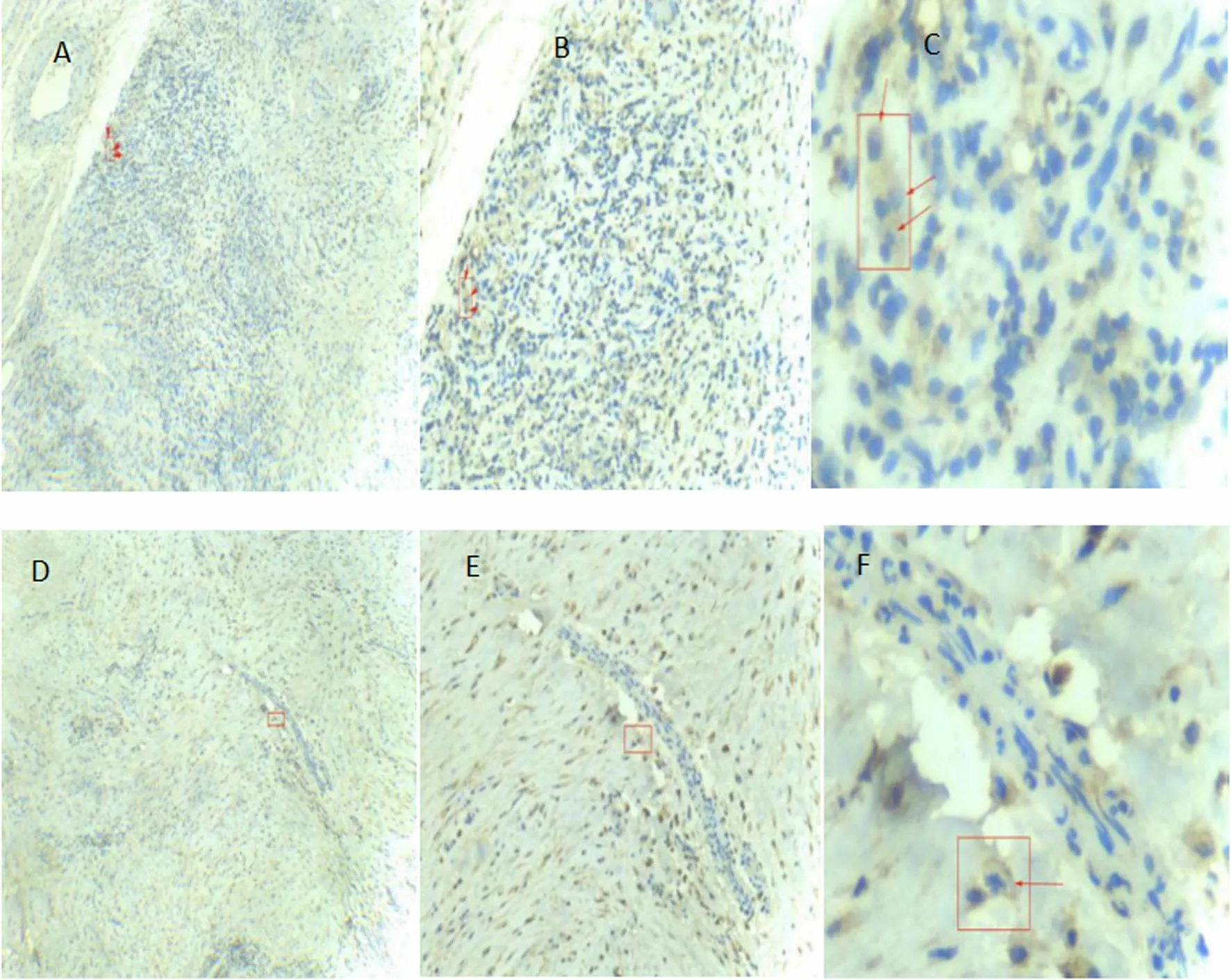
图3 创面边缘组织CD163免疫组化染色情况(×40、×100、×400)
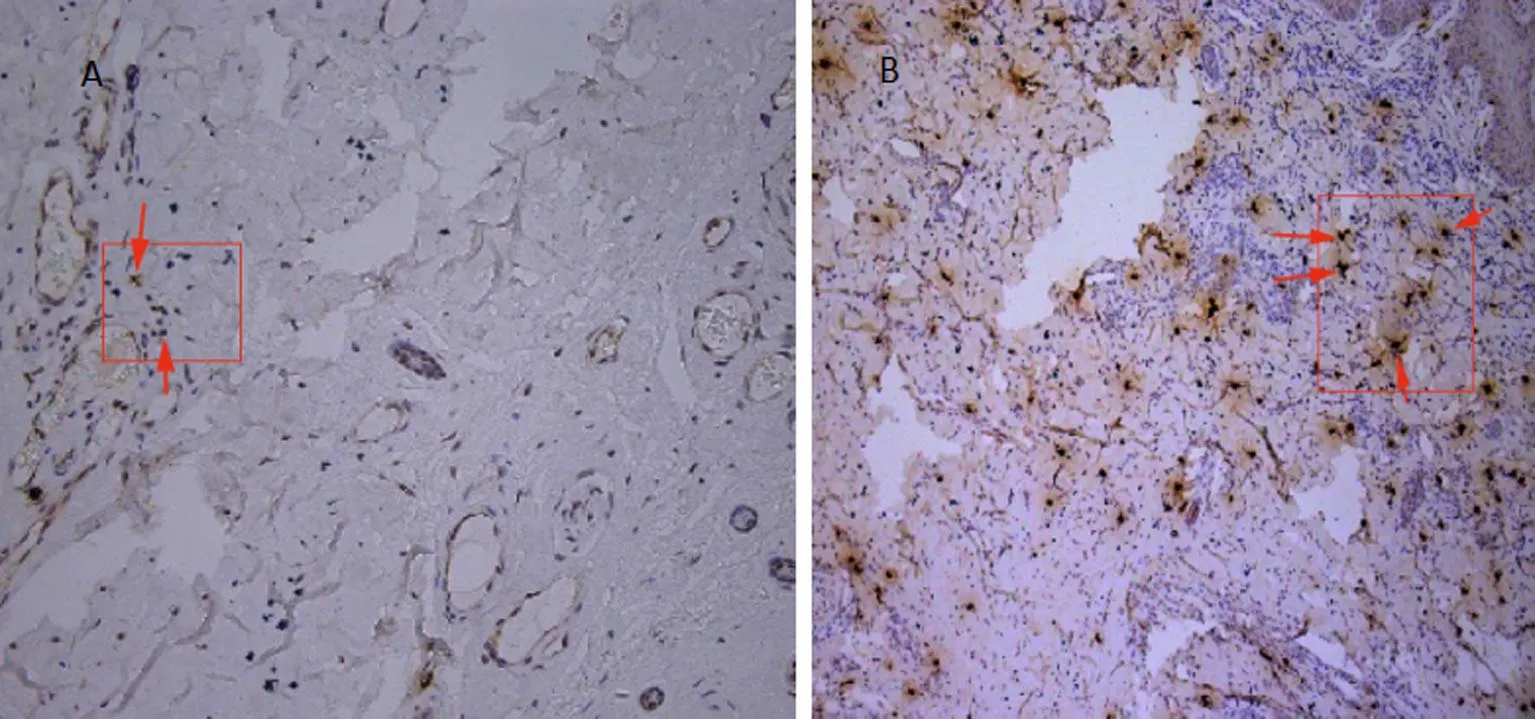
图4 创面边缘组织VEGF免疫组化染色情况(×100)

图5 创面边缘组织CD31免疫组化染色情况(×100)
2.3 手术前后M1、M2 型巨噬细胞计数及M1/M2变化情况 术后M1型巨噬细胞计数(79.74±13.96)较术前(158.18±29.14)明显减少(t=12.390,P<0.001);术后M2型巨噬细胞计数(32.27±6.62)较术前(43.64±7.70)减少(t=4.407,P<0.001);术后M1/M2(2.50±0.29)较术前(3.62±0.18)降低(t=9.974,P<0.001)。
2.4 创面边缘组织HE染色 术前HE染色显示组织残缺,未见皮肤附属器(图6A、6B、6C);术后组织结构完整,可见腺体样结构和胶原沉积(图6D、6E、6F)。


图6 创面边缘组织手术前后HE染色情况(比例尺625 μm、200 μm、100 μm)
2.5 足部血管造影检查 术前微血管少(图7A);术后1个月微血管增多,侧支微循环形成(图7B)。

图7 足部血管造影检查的影像学资料
3 讨 论
生物力学领域中,张力-应力法则是对生物组织施加持续牵拉应力,使张力-应力的机械信号转化为生物学信号,激发组织细胞增殖,促进组织再生。TTT是以张力-应力激发细胞生物效应而促进创面组织再生的微创外科技术,其是在患者胫骨内上侧骨皮质微创开窗,经搬移装置对皮质截骨片持续施加牵张应力,由此产生生物效应,促进创面组织再生修复[3]。本研究中,61例重度糖尿病足患者接受TTT术后创面组织再生愈合,并且术后1个月取创面的新生皮肤做组织学检查,发现其表皮、真皮和皮下组织等各层结构完整,基底层的细胞增多,且在真皮与皮下组织发现胶原沉积和腺体样结构。足部血管造影检查显示术后1个月微血管及侧支微循环形成增多。这提示TTT可促进糖尿病足创面的组织再生。
本课题组前期试验发现,术后1个月外周血中基质细胞衍生因子-1、单个核细胞、单个核细胞上的CXCR4水平均较术前增高[4],表明术后介导骨髓干细胞动员的重要信息通路SDF-1/CXCR4信号轴活性增强,骨髓干细胞动员效应增强,进入创面向组织细胞分化的干细胞数量相应增多,这可能是创面组织再生最重要的细胞生物学基础。
本研究中大部分糖尿病足患者的创面在术后1~2周出现炎性分泌物逐渐减少,炎症减轻,局部开始生长粉红肉芽组织的情况,即使部分创面局部坏死,经过再次清创,亦能长出粉红肉芽组织,这是创面愈合早期的关键转折,标志着创面从迁延不愈的炎症期进入细胞增殖分化、组织再生的增殖期。有研究表明,创面愈合受多种因素的共同作用影响,巨噬细胞的生物效应在创面组织再生的过程中具有重要的促进作用[5-6]。而创面巨噬细胞的生物效应取决于巨噬细胞的数量和表型,尤其是M1/M2平衡[7]。 因此,本研究主要从创面巨噬细胞极化、创面愈合分期和微血管增加的角度来进行初步分析。
术前创面黄白、水肿,可见坏死组织和炎性分泌物,处于炎症期,这一时期糖尿病足创面巨噬细胞数量和功能异常,M1型巨噬细胞释放大量炎性因子[8],创面高炎状态导致巨噬细胞向M2表型极化障碍[9],进而导致创面基质金属蛋白酶增多,降解细胞外基质及生长因子,阻断创面血管发生,胶原沉积减少[10-11],这是导致创面炎症迁延不愈并停滞于炎症期的因素之一。术后1个月M1、M2型巨噬细胞计数均比术前减少,提示术后创面从高炎状态进入低炎状态;M1/M2减小,表明M1型巨噬细胞向M2型巨噬细胞极化,M1、M2型巨噬细胞趋向平衡。进入创面的干细胞分泌前列腺素E2、TSG-6、白介素-10等细胞因子以及外泌体,并以旁分泌或其他方式作用于巨噬细胞,调控细胞内相关信息通路,抑制炎性因子的表达,上调抗炎因子的表达[12],这是干细胞诱导创面巨噬细胞表型重新编程的主要细胞生物效应,可诱导促炎型M1型巨噬细胞向抗炎型M2型巨噬细胞极化。此外,巨噬细胞炎性因子的表达、分泌减少,由TNF-α等炎性因子诱导单核细胞分化形成的M1型巨噬细胞随之减少,从而改变创面炎性状态。以上因素的综合作用使创面巨噬细胞发生质变、量变,生物效应也随之改变。随着M1型巨噬细胞向M2型巨噬细胞转化,M1/M2逐渐降低,创面逐渐从M1型巨噬细胞生物效应占主导作用转变成M2型巨噬细胞生物效应占主导作用。M2型巨噬细胞主要分泌VEGF、血小板衍生生长因子、转化生长因子-β、内皮生长因子和碱性成纤维细胞生长因子等促血管生成因子,促进创面炎症消退和细胞增殖、分化,介导创面血管生成[13-19]。然而这些因子的分泌量取决于创面巨噬细胞M1/M2的平衡,M1型巨噬细胞向M2型巨噬细胞极化,促进血管生成因子的分泌量也随而增加。转化生长因子-β调控相关信息通路诱导间充质干细胞向创面迁移募集[15],VEGF、成纤维细胞生长因子、转化生长因子诱导干细胞向内皮细胞分化,促进内皮细胞增殖、迁移、募集,基质金属蛋白酶-1、基质金属蛋白酶-3在细胞迁移的前沿区域降解纤维蛋白和其他基质成分,有利于干细胞、内皮细胞的迁移以及管样结构的形成。血小板衍生生长因子介导间充质干细胞和周细胞的锚定,有助于创面新生毛细血管的功能和形态的维持[20]。此时,创面从炎症期进入增殖期,临床可见创面炎性分泌物消退,开始生长出红润颗粒状肉芽组织。综上,从创面巨噬细胞极化的生物效应与创面愈合的关系来说,M1、M2型巨噬细胞的细胞生物效应在创面血管生成过程中分别起抑制和促进效应。
VEGF是最强的血管生成诱导因子,其在细胞外基质中分布的空间梯度是血管形态发生的关键因素。CD31是血管内皮细胞标志物。本研究中术后1个月创面边缘组织中VEGF、CD31密度均比术前增加,并且CD31阳性细胞呈细小条索状串联,提示术后创面组织中血管内皮细胞增多,微血管的生成增多。术后1个月血管造影结果显示创面微血管比术前增多,下肢血管网的小血管开始增加,提示糖尿病足创面血供改善。创面中血管生成有利于创面组织再生相关的细胞、细胞因子以及创面组织代谢产物的运输,这是再生修复的先决条件。
综上所述,TTT可能通过诱导M1型巨噬细胞向M2型巨噬细胞转化,促进创面M1、M2型巨噬细胞平衡,使创面M2型巨噬细胞生物效应占主导作用,促使创面从炎症期进入增殖期,促进创面组织的微血管再生,为糖尿病足溃疡和再生愈合提供血供基础和良好的微环境。但TTT技术相关的生物学机制还有待不断地深入研究,以便推动其发展和应用。
