不同产地川乌炮制前后差异性成分研究
2022-06-18吴丹丹刘艳郭鹏飞匡海学杨炳友
吴丹丹 刘艳 郭鹏飞 匡海学 杨炳友
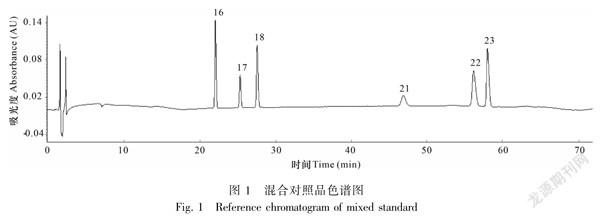
摘要:為建立川乌及制川乌的高效液相色谱(HPLC)指纹图谱,并结合化学计量学方法和主成分含量测定和比较3个不同产地川乌炮制前后的差异成分。该文采用HPLC法,利用中药色谱指纹图谱相似度评价系统(2012版)计算相似度,并结合聚类分析(HCA)、主成分分析(PCA)、偏最小二乘判别分析(PLSDA)、正交偏最小二乘判别分析(OPLSDA)及主成分含量测定结果进行综合分析。结果表明:(1)建立了3个产地15批川乌炮制前后的HPLC指纹图谱,分别标定了25个和14个共有峰,并通过对照品指认出6个共有峰,分别为苯甲酰新乌头原碱(峰16)、苯甲酰乌头原碱(峰17)、苯甲酰次乌头原碱(峰18)、新乌头碱(峰21)、次乌头碱(峰22)、乌头碱(峰23)。(2)化学计量学方法分析显示,川乌炮制前后的30批样品被明显分为2类,15批川乌被分为3类,15批制川乌被分为3类,新乌头碱、次乌头碱等6个成分可能是不同产地川乌炮制前后的潜在差异成分。(3)炮制前后主成分含量测定结果均有不同程度的变化,四川江油所产川乌炮制前后部分成分含量明显高于另外两个产地所产川乌。该研究建立的指纹图谱精密度、重复性、稳定性均较好,结合化学计量学分析方法和主成分含量测定分析,可为不同产地川乌炮制前后质量控制提供参考。
关键词:川乌,高效液相色谱(HPLC),指纹图谱,化学计量学方法,含量测定,质量控制
中图分类号:Q946
文献标识码:A
文章编号:1000-3142(2022)05-0820-13
DifferentcomponentsbetweenAconitiRadixand
itsprocessedproductfromdifferentregions
Abstract:ToevaluatethedifferencesofAconitiRadixandAconitiRadixPreparatafromthreedifferentregionsbychemometricsandprincipalcomponentcontentdeterminations.Thehighperformanceliquidchromatography(HPLC)methodwasestablishedonaWatersSunFireC18(4.6mm×150mm,5μm),andacetonitrileglacialaceticacid(0.2%)solution(triethylamineadjustedpHto6.20)wasadoptedasthemobilephaseforgradientelution,withtheflowrateof1.0mL·min1andthedetectionwavelengthof235nm.Thefingerprintswereanalyzedbythesoftwareof“SimilarityEvaluationSystemforChromatographicFingerprintofTraditionalChineseMedicine(2012)”.Thediscriminantanalysisofhierarchicalclusteranalysis(HCA),principalcomponentanalysis(PCA),orthogonalpartialleastsquaresdiscriminantanalysis(OPLSDA)andpartialleastsquaresdiscriminantanalysis(PLSDA)wereemployed,combinedwithchemometricsandthedeterminationresultsofprincipalcomponents.Theresultswereasfollows:(1)HPLCfingerprintsof15batchesofAconitiRadixanditsprocessedproductsfromthreeareaswereestablished,25and14commonfingerprintpeakswerecalibratedin15batchesofrawandprocessed,sixpeakswereidentifiedbythemixedreferenceproduct.Theywerebenzoylmesaconitine(peak16),benzoylaconitine(peak17),benzoylhypaconitine(peak18),mesaconitine(peak21),hypaconitine(peak22),aconitine(peak23).(2)Chemometricsshowedthat30batchesofsampleswereclusteredintotwocategories,15batchesofAconitiRadixwereclassifiedintothreeclasses,15batchesofAconitiRadixPreparatawereclassifiedintothreeclasses.SixcomponentscontainingmesaconitineandhypaconitinemaybethepotentialdifferentcomponentsofAconitiRadixfromdifferentregionsbeforeandafterprocessing.(3)Thecontentdeterminationresultsofprincipalcomponentschangedinvaryingdegreesbeforeandafterprocessing,andthedeterminationresultsofsomeprincipalcomponentsinJiangyouofSichuanproducingareabeforeandafterprocessingweresignificantlyhigherthanthoseintheothertwoproducingareas.Thefingerprintmethodwhichestablishedinthestudyisaccurate,repeatable,andreliable.Furthermore,combinedwithchemometricsandprincipalcomponentcontentdetermination,itcouldbeusedforthequalitycontrolofAconitiRadixanditsprocessedproductfromdifferentregions.
Keywords:AconitiRadix,highperformanceliquidchromatography(HPLC),fingerprints,chemometricmethod,contentdetermination,qualitycontrol
川乌味辛、苦,性热,有大毒,一般炮制后用(唐梅等,2017;中华人民共和国药典,2020;叶协滔等,2020),主产于四川、陕西、云南等地,其道地产区为四川江油,多以栽培品为主。由于各地种植程度不等及栽培环境不同,对川乌质量产生了极大的影响(林华和邓广海,2011;赵军宁等,2020)。现代医学研究表明,川乌具有抗炎(Yuetal.,2019)、镇痛(Wangetal.,2015;Nyirimigaboetal.,2015)、抗肿瘤(Wang&Chen,2010)等作用,同时也对心脏(Liuetal.,2019;Lietal.,2020)和中枢(Qinetal.,2012;Liuetal.,2017)等有毒性作用。川乌中所含的双酯型生物碱既是其有效成分同时又是其毒性成分(Qinetal.,2012),炮制后可将其水解为单酯型生物碱,从而降低毒性(Liuetal.,2017)。但是,由于炮制不当或错误使用等问题,常导致中毒事件发生,因此严格控制川乌炮制前后的质量尤为重要(Shaw,2010)。
目前,中药材质量控制的方法以含量测定为主(Shaw,2010;Luoetal.,2016),但由于中药成分复杂且不明确,仅以单个或几个成分的含量进行质量控制,不能全面地反映药材的质量,因此能够实现多成分、多指标质量控制的指纹图谱技术开始受到广泛的关注(Zhuetal.,2013;赵翡翠等,2014;Zhengetal.,2014;马丽娟等,2016;Luoetal.,2018;Miaoetal.,2019)。然而,对川乌的高效液相色谱(HPLC)指纹图谱研究仅为不同产地的川乌差异比较(熊江等,2005;林华和邓广海,2011;司欣鑫,2019;魏惠珍等,2020;杨磊,2020)和炮制前后差异比较(于永军等,2009;黄志芳等,2011;邓广海,2011;秦语欣,2016),共有峰标定均较少,对差异性成分的研究不明确且没有将HPLC指纹图谱与多元统计分析和含量测定的方法相结合,综合考察产地因素对川乌炮制前后差异成分的影响。因此,本实验选取川乌3个主要产地炮制前后的川乌样品,建立HPLC指纹图谱并结合化学计量学方法及主成分含量测定,筛选3个不同产地川乌炮制前后的潜在差异成分,为川乌与制川乌质量控制提供参考。
1材料与方法
1.1材料和仪器
乙腈和冰醋酸为色谱纯,其余试剂均为分析纯;实验用水为屈臣氏蒸馏水;新乌头碱(以下简称Mes,批号CHB180311)、乌头碱(以下简称Aco,批号CHB180408)、次乌头碱(以下简称Hyp,批号CHB180524)、苯甲酰新乌头原碱(以下简称BMA,批号CHB180310)、苯甲酰乌头原碱(以下简称BAC,批号CHB180309)、苯甲酰次乌头原碱(以下简称BHA,批号CHB180307)均购自成都克洛玛生物科技有限公司,纯度均≥98%。川乌药材采自于陕西省汉中市城固县三合镇龙王庙村2组、四川省江油市太平镇普照村2组、四川省绵阳市平武代坝村3个产地各5批,共15批川乌样品,已均被黑龙江中医药大学药学院樊锐锋副教授鉴定均为毛茛科植物乌头(Aconitumcarmichaelii)的干燥母根,保存于黑龙江中医药大学中药化学实验室。制川乌的炮制方法采用2020版《中国药典》方法蒸制(中华人民共和国药典,2020)。
高效液相色譜仪(e2695,美国Waters公司);色谱柱为WatersSunFireC18(150mm×4.6mm,5μm);旋转蒸发仪(OSB2100,日本EYELA公司)。
1.2方法
1.2.1色谱条件WatersSunFireC18(4.6mm×150mm,5μm)色谱柱,流动相为乙腈(A)-0.2%冰醋酸水溶液(B,三乙胺调pH值6.20),梯度洗脱(0~8min,5%~13%A;8~13min,13%~21%A;13~25min,21%~26%A;25~50min,26%~26%A;50~53min,26%~29%A;53~58min,29%~37%A;58~63min,37%~40%A;63~73min,40%~80%A);体积流量1.0mL·min1;检测波长235nm;柱温35℃;进样量20μL。
1.2.2对照品溶液的制备分别取对照品适量,用0.01%盐酸甲醇溶液定容,配制成含Mes0.06mg·mL1、Aco0.06mg·mL1、Hyp0.05mg·mL1、BMA0.05mg·mL1、BAC0.06mg·mL1、BHA0.06mg·mL1的混合对照品溶液,备用。
1.2.3供试品溶液制备分别取川乌和制川乌粉末(过三号筛)适量置于具塞锥形瓶中,依次加入氨试液2.0mL、异丙醇25mL和乙酸乙酯25mL,超声提取2次(300W,40kHz,25℃以下),每次30min,静置过夜,过滤,合并滤液。减压浓缩(40℃以下),0.01%盐酸甲醇溶液定容至5.0mL,进样前离心,取上清液过0.22μm微孔滤膜,备用。
1.2.4含量测定取对照品适量,用0.01%盐酸甲醇溶液定容,配制成含Mes3.17mg·mL1、Aco3.18mg·mL1、Hyp3.00mg·mL1、BMA0.61mg·mL1、BAC0.10mg·mL1、BHA0.13mg·mL1的混合对照品储备液,备用。按“1.2.3”项下“供试品溶液制备”方法制备供试品溶液,并按“1.2.1”项下“色谱条件”重复测定3次。
1.2.5方法学考察
1.2.5.1线性关系考察取“1.2.2”项下混合对照品储备液,梯度稀释,并按“1.2.1”项下“色谱条件”进样检测,记录峰面积。横坐标(X)为质量浓度、纵坐标(Y)为峰面积,进行线性回归,分别得到线性回归方程。
1.2.5.2精密度考察取“1.2.2”项下混合对照品储备液,按“1.2.1”项下“色谱条件”重复测定5次,记录峰面积。
1.2.5.3稳定性考察取川乌样品(S1)适量,按“1.2.3”项下“供试品溶液制备”方法制备供试品溶液,并按“1.2.1”项下“色谱条件”分别于室温在0、2、4、8、12、24h进样检测,记录峰面积。
1.2.5.4重复性考察取川乌样品(S1)5份,按“1.2.3”项下“供试品溶液制备”方法制备供试品溶液,并按“1.2.1”项下“色谱条件”进样检测,记录峰面积。
1.2.5.5加样回收率考察取已知含量的川乌样品(S1)适量,按一定比例(50%、100%、150%)加入混合对照品储备液(Mes、Aco、Hyp、BMA、BAC、BHA),按“1.2.3”项下“供试品溶液制备”方法制备供试品溶液,并按“1.2.1”项下“色谱条件”重复测定3次,记录各峰面积。
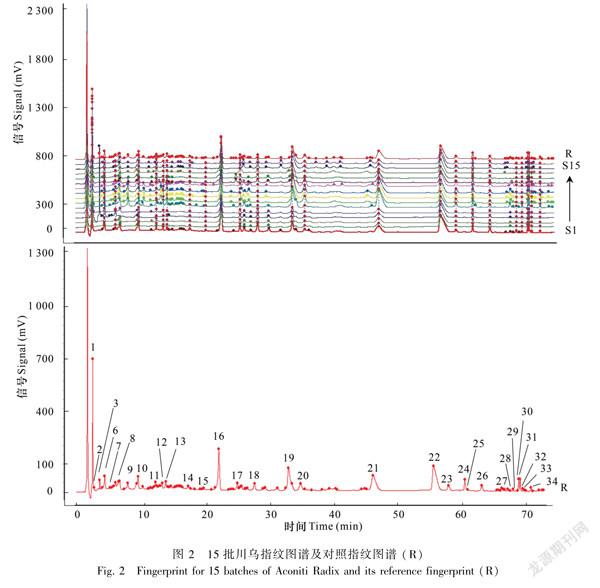
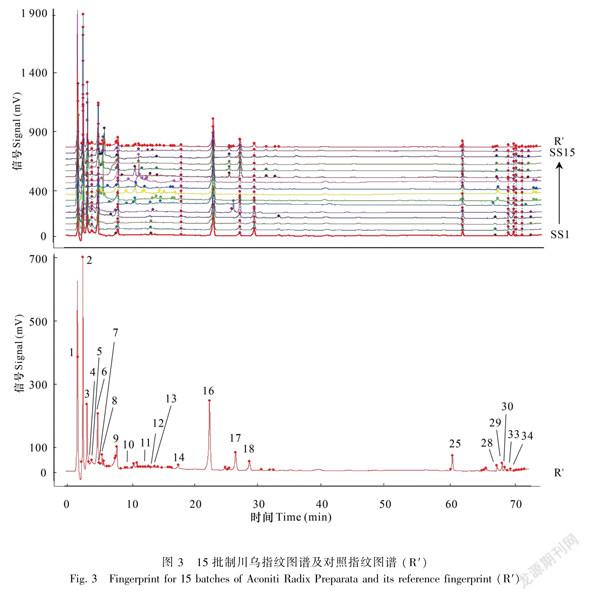
1.2.6指纹图谱的建立分别取混合对照品溶液、15批川乌和15批制川乌制备的供试品溶液,按“1.2.1”项下“色谱条件”进样检测,记录色谱图。其混合对照品色谱图见图1。将所得15批川乌及15批制川乌的图谱导入到“中药色谱指纹图谱相似度评价系统(2012版)”中,设S1样品的图谱为参照图谱,时间窗宽度设为0.1min,选用中位数法,进行多点校正,以全谱峰进行峰匹配,生成对照指纹图谱,分别得到15批川乌与15批制川乌样品的指纹图谱及其对照指纹图谱,见图2与图3。
2结果与分析
2.1相似度分析
川乌样品S1~S15与参照指纹图谱的相似度结果分别为0.949、0.948、0.951、0.776、0.952、0.902、0.926、0.925、0.923、0.908、0.969、0.970、0.955、0.956、0.955,除样品S4与参照图谱的相似度为0.776外,其余样品与参照图谱的相似度均≥0.902,可知除陕西汉中产地外其余产地川乌相似
度较好;制川乌样品SS1~SS15与参照指纹图谱的相似度结果分别为0.812、0.870、0.756、0.738、0.925、0.914、0.913、0.900、0.898、0.862、0.836、0.924、0.903、0.912、0.904,除样品SS3和SS4与参照图谱的相似度为0.756和0.738外,其余样品与参照图谱的相似度均≥0.812,可知除陕西汉中产地,另外两个产地相似度均较好,但也存在一定差异。
2.2化學计量法分析
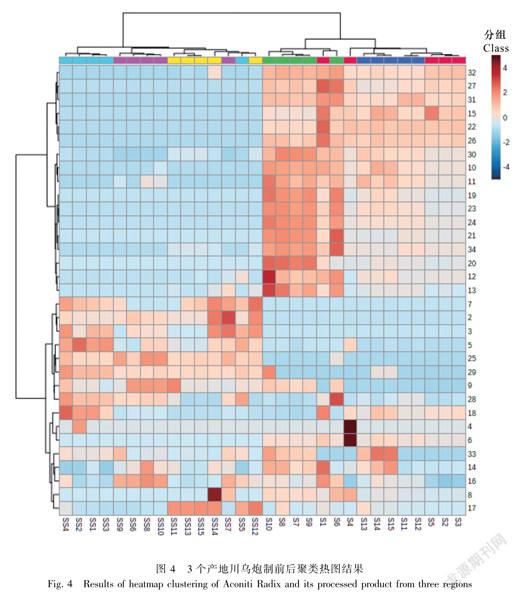
2.2.1聚类分析(HCA)采用MetaboAnalyst5.0(https://www.metaboanalyst.ca/MetaboAnalyst/home.xhtml)统计学网站对15批川乌和15批制川乌指纹图谱的34个特征峰峰面积进行聚类热图分析。由图4可知,30批样品被明显聚为两类,川乌(S1~S5为陕西汉中川乌的五个批次,S6~S10为四川江油川乌的五个批次,S11~S15为四川绵阳川乌的五个批次)聚为一类,制川乌(SS1~SS5为陕西汉中制川乌的五个批次,SS6~SS10为四川江油制川乌的五个批次,SS11~SS15为四川绵阳制川乌的五个批次)聚为一类。即川乌和制川乌能被明显区分,说明川乌炮制前后化学成分有一定差异,可通过指纹图谱的聚类分析将其分类。根据热图分析可判断制川乌中峰2、3、5、7、9、16(BMA)、17(BAC)、18(BHA)、25、28、29代表的化学成分明显高于川乌;川乌中峰10、11、12、13、15、19、20、21(Mes)、22(Hyp)、23(Aco)、24、26、27、30、31、32、34代表的化学成分明显高于制川乌;四川江油的川乌中峰10、11、12、13、19、20、
21(Mes)、23(Aco)、24、30、34代表的化学成分明显高于另外两个产地。
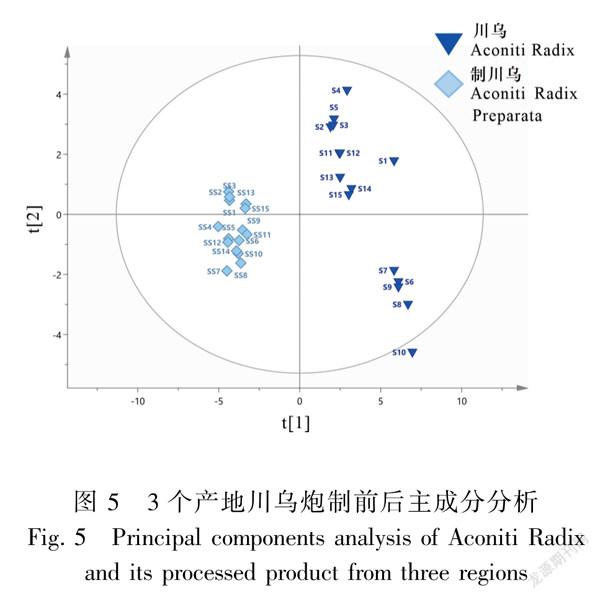
2.2.2主成分分析(PCA)采用SIMCA14.1统计学软件对15批川乌和15批制川乌指纹图谱的34个特征峰峰面积进行主成分分析,得分矩阵图见图5,模型参数R2X值及预测能力参数Q2值分别为0.751和0.541。结果显示30批样品可被分为两组,其中川乌(S1~S15)为一组,制川乌(SS1~SS15)为一组,此分组与HCA结果基本一致。此外批次S10位于得分图范围外,推测这一批样品与其他批质量差异较大。
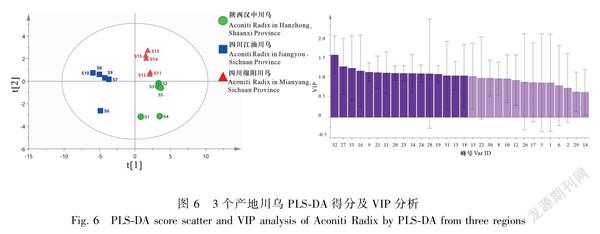
2.2.3偏最小二乘判别分析(PLSDA)采用SIMCA14.1分析软件,分别对15批川乌和15批制川乌指纹图谱的34个特征峰峰面积进行PLSDA分析,得分图见图6和图7。模型参数R2X值、稳定性参数R2Y值及预测能力参数Q2值分别为0.996、0.999、0.977,说明所建PLSDA模型稳定性良好。结果显示在得分散点图中3个产地的川乌明显被分为3类,该分析结果与HCA和PCA结果基本一致。从3个产地15批川乌中共提取得到
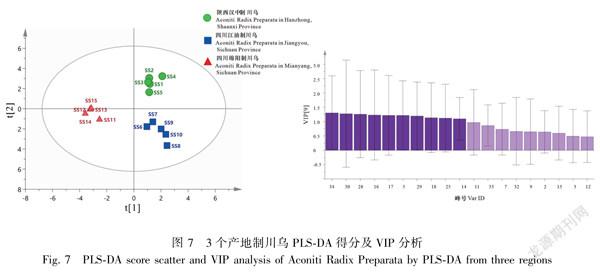
16个主成分[变量投影重要性指标(variableimportanceinprojection,VIP),VIP>1.0],其中峰32、27、33、16(BMA)、9、21(Mes)、11、20、23(Aco)、34、24、28、19、31、13和18(BHA)的变化对不同产地川乌的区分贡献较大;同样对3个产地15批制川乌进行PLSDA分析,共提取8个主成分(VIP>1.1),模型参数R2X值、R2Y值及Q2值分别为0.973、0.999、0.912,结果显示在得分散点图中3个产地的制川乌明显被分为3类,峰34、30、28、16(BMA)、17(BAC)、5、29、18(BHA)、25、14的变化对不同产地制川乌的区分贡献较大,该分析结果与HCA和PCA结果基本一致。
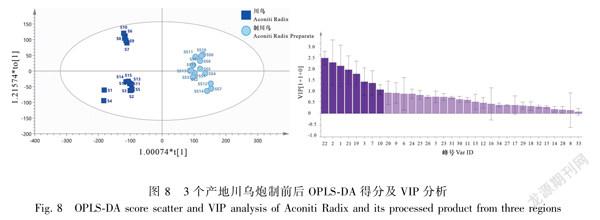
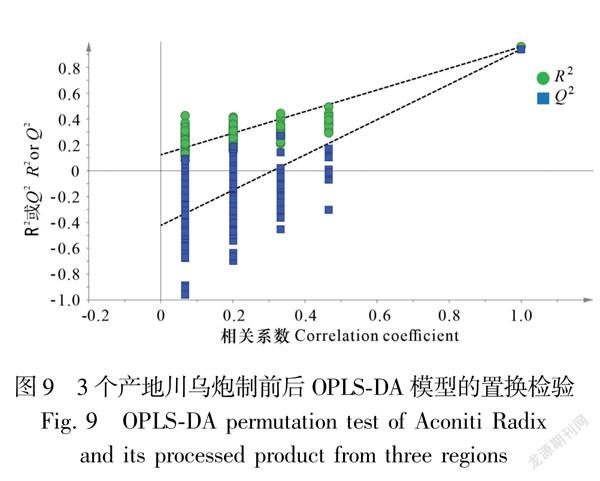
2.2.4正交偏最小二乘判别分析(OPLSDA)采用SIMCA14.1软件,对15批川乌和15批制川乌指纹图谱的34个特征峰峰面积进行OPLSDA分析,提取得到8个主成分(VIP>1.0),模型参数R2X值、R2Y值及Q2值分别为0.721、0.960、0.941,在得分散点图中炮制前后的川乌明显被分为2类,峰22(Hyp)、2、1、21(Mes)、19、3、7和10的变化对炮制前后的区分贡献较大,该分析结果与HCA和PCA结果基本一致,具体见图8。采用置换检验(n=200)对当前模型进行验证,检验参数R2=(0.0,0.143),Q2=(0.0,-0.396),结果见图9,左侧随机排列产生的R2及Q2的值均小于右侧的原始值,表明所建立的OPLSDA模型拟合良好,能够用于川乌与制川乌的判别分析。
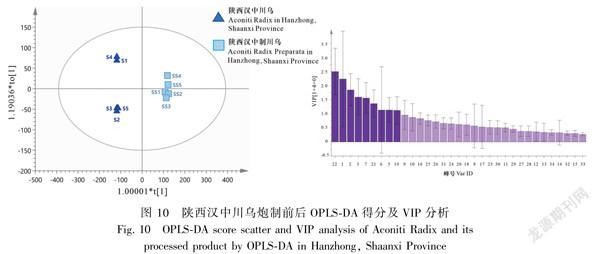
对陕西汉中产地10批炮制前后川乌进行OPLSDA分析,共提取得到9个主成分(VIP>1.1),
模型参数R2X值、R2Y值及Q2值分别为0.991、0.999、0.995,结果显示在得分散点图中炮制前后的川乌明显被分为2类,峰22(Hyp)、1、2、3、7、21(Mes)、6、5、19的变化对陕西汉中产地炮制前后川乌的区分贡献较大,推测次乌头碱(Hyp)可能为陕西汉中产地川乌炮制前后的差异成分,该分析结果与HCA和PCA结果基本一致,见图10。
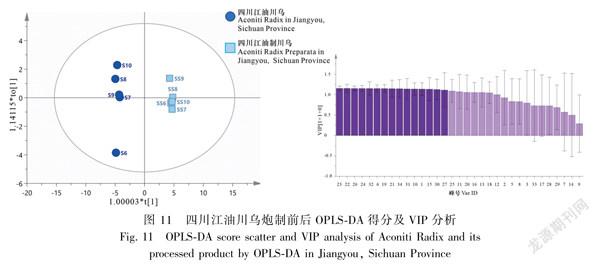
对四川江油产地10批炮制前后川乌进行OPLSDA分析,共提取得到15个主成分(VIP>1.1),模型参数R2X值、R2Y值及Q2值分别为0.792、0.998、0.994,结果显示在得分散点图中炮制前后的川乌明显被分为2类,峰23(Aco)、22(Hyp)、26、24、32、6、19、21(Mes)、34、31、10、1、15、30、27的变化对四川江油产地炮制前后川乌的区分贡献较大,推测乌头碱(Aco)可能为四川江油产地川乌炮制前后的差异成分,该分析结果与HCA和PCA结果基本一致,见图11。
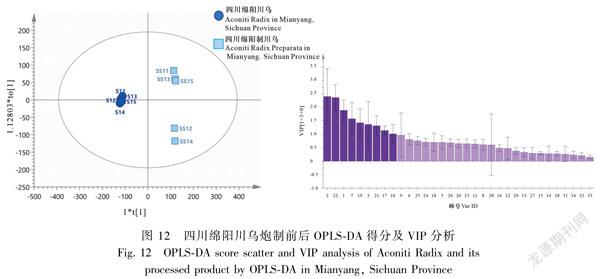
对四川绵阳产地10批炮制前后川乌进行OPLSDA分析,共提取得到9个主成分(VIP>1.0),模型参数R2X值、R2Y值及Q2值分别为0.964、0.999、0.995,结果显示在得分散点图中炮制前后的川乌明显被分为2类,峰2、22(BAC)、1、7、19、3、21(BMA)、17(BHA)、10的变化对四川绵阳产地炮制前后川乌的区分贡献较大,推测苯甲酰乌头原碱(BAC)可能为四川绵阳产地川乌炮制前后的差异成分,该分析结果与HCA和PCA结果基本一致,见图12。
通过上述化学计量学方法分别对3个不同产地各10批川乌炮制前后的差异成分与所有产地30批川烏炮制前后的差异性成分进行筛选与比对,得出4个共有的差异成分,分别为峰1、19、21(Mes)和22(Hyp),与于永军等(2009)报道的基本一致,被指认的新乌头碱(Mes)和次乌头碱(Hyp)可能为川乌炮制前后潜在差异成分。川乌3个不同产地的11个主要潜在差异成分,分别为峰11、13、19、20、21(Mes)、23(Aco)、24、27、31、32和34,结合文献(魏惠珍等,2020)认为被指认的新乌头碱(Mes)可能为不同产地川乌潜在差异成分;制川乌3个不同产地的6个主要潜在差异成分,分别为峰5、16(BMA)、17(BAC)、18(BHA)、25和29,被指认的苯甲酰新乌头原碱(BMA)、苯甲酰乌头原碱(BAC)和苯甲酰次乌头原碱(BHA)可能为不同产地制川乌的潜在差异成分。
2.3方法学考察结果
2.3.1线性关系考察分别以质量浓度为横坐标(X)与峰面积为纵坐标(Y),进行线性回归,得到Mes、Aco、Hyp、BMA、BAC、BHA的线性回归方程分别为Y=1430998172X+203326.359(r=0.9990)、Y=14679346.9618X-37144.5228(r=0.9997)、Y=16104467.1166X-50882.6064(r=0.9997)、Y=16143894.8115X-271765.7667(r=0.9996)、Y=26224738.8882X-121965.41(r=0.9995)、Y=28537646.8818X-45476467(r=0.9987),线性范围分别为0.0127~0.3170mg·mL1、0.0127~0.3180mg·mL1、0.0120~0.3000mg·mL1、0.0780~0.9000mg·mL1、0.0130~0.1500mg·mL1、0.0169~0.1950mg·mL1。
2.3.2精密度考察计算Mes、Aco、Hyp、BMA、BAC、BHA峰面积的相对标准偏差(relativestandarddeviation,RSD)分别为1.69%、2.31%、2.02%、3.05%、2.98%、3.66%(n=5),表明仪器精密度较好。
2.3.3稳定性考察计算Mes、Aco、Hyp、BMA、BAC、BHA峰面积的RSD分别为3.64%、2.92%、3.81%、2.58%、1.69%、3.99%(n=6),表明该供试品溶液在室温条件下24h内稳定。
2.3.4重复性考察计算Mes、Aco、Hyp、BMA、BAC、BHA峰面积的RSD分别为3.75%、3.88%、3.08%、3.19%、2.96%、2.01%(n=5),表明该方法重复性较好。
2.3.5加样回收率考察计算Mes、Aco、Hyp、BMA、BAC、BHA的平均加样回收率分别为97.97%、98.65%、97.91%、98.20%、97.02%、100.01%,RSD分别为4.75%、4.08%、3.28%、3.99%、4.06%、2.91%(n=3)。
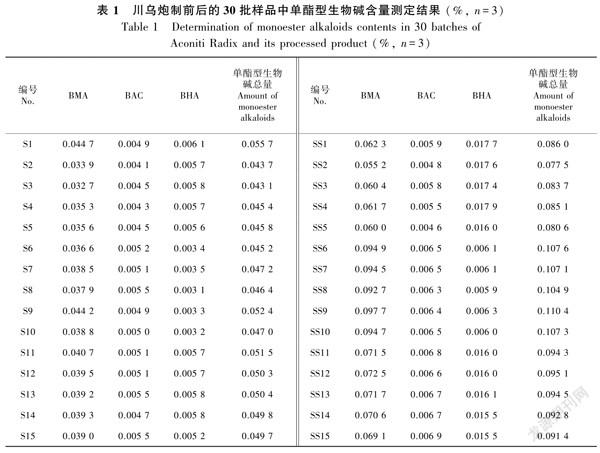
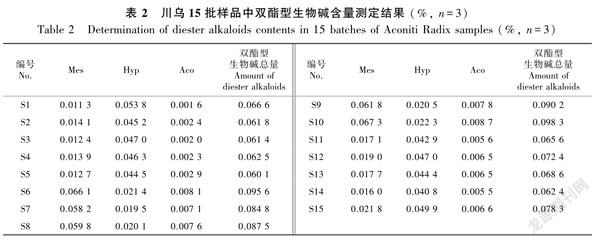
2.4含量测定结果
30批炮制前后的川烏含量测定结果见表1及表2,本实验中制川乌样品的双酯型生物碱可能由于含量极低均未检出,故未列在表格中。由含量测定结果可知,3个产地川乌中四川江油所产川乌的新乌头碱(Mes)和乌头碱(Aco)含量明显高于另外两个产地,其中新乌头碱含量最高,与熊江等(2005)研究结果一致,另外两个产地川乌中的次乌头碱(Hyp)含量最高,这可能与四川江油的地理环境有关(林华和邓广海,2011;Luoetal.,2018;魏惠珍等,2020)。炮制后单酯型乌头碱含量均增加,双酯型乌头碱含量显著减少,与于永军等(2009)研究结果一致,其中四川江油产川乌炮制后苯甲酰新乌头原碱(BMA)含量升高且明显高于另外两个产地,而另外两产地川乌炮制后苯甲酰次乌头原碱(BHA)含量升高地更显著,以上含测结果与化学计量学分析结果相互佐证。
3讨论与结论
本实验分别选用无水乙醇、95%乙醇、异丙醇-乙酸乙酯(1∶1)3种溶剂对供试品进行超声提取,结果表明,采用异丙醇-乙酸乙酯(1∶1)提取得到的供试品溶液,经HPLC检测所得的色谱峰较多且峰形较好;另外本课题组还考察了乙腈-四氢呋喃(25∶15)-0.1mol·L1醋酸铵溶液(每1000mL加冰醋酸0.5mL)、乙腈-0.1mol·L1醋酸铵溶液、乙腈-冰醋酸(0.2%)水溶液(三乙胺调pH值6.20)3个流动相系统,最终选择乙腈-冰醋酸(0.2%)水溶液(三乙胺调pH值6.20)作为流动相系统,分离度及峰形均较好,且基线较平稳,有利于指纹图谱分析。
相似度分析结果显示四川省两个产地的川乌与制川乌相似度均高于陕西汉中;化学计量法分析结果显示新乌头碱和次乌头碱可能为川乌炮制前后潜在差异成分,结合魏惠珍等(2020)推测新乌头碱可能为不同产地川乌的潜在差异成分,苯甲酰新乌头原碱、苯甲酰乌头原碱和苯甲酰次乌头原碱可能为不同产地制川乌的潜在差异成分;含量测定结果显示3个产地川乌中四川江油的新乌头碱含量最高,与熊江等(2005)研究结果一致,且明显高于另外两个产地,3个产地制川乌中四川江油的苯甲酰新乌头碱含量明显高于另外两个产地。结合上述结果分析,新乌头碱和苯甲酰新乌头碱可能分别为四川江油道地产川乌与制川乌的差异性成分,且本实验通过对比化学计量学结果发现,不同产地川乌及制川乌潜在差异成分不存在交集,对比于永军等(2009)研究发现炮制前后化学成分差异较明显,因此川乌生品及炮制品应分别建立产地差异质量控制标准。
综上所述,建立川乌与制川乌的HPLC指纹图谱可较为全面地反映3个产地川乌炮制前后的化学成分信息,结合化学计量学及主成分含量测定,使分析结果更科学和全面,可为完善川乌与制川乌的质量控制标准提供实验依据。
参考文献:
ChinesePharmacopoeiaCommission,2020.PharmacopoeiaofthePeople’sRepublicofChina:VersionⅠ[M].Beijing:ChinaMedicalSciencePress:40-43.[国家药典委员会,2020.中华人民共和国药典:一部[M].北京:中国医药科技出版社:40-43.]
DENGGH,2011.ThestudyofprocessingtechnologyandfingerprintofAconitiRadixandAconitiKusnezoffiiRadix[D].Guangzhou:GuangzhouUniversityofChinesemedicine.[邓广海,2011.川乌、草乌炮制工艺及指纹图谱的研究[D].广州:广州中医药大学.]
HUANGZF,YIJH,CHENDA,etal.,2011.HPLCspecificchromatogramofRadixAconitiPraeparataanddeterminationofsixestericalkaloids[J].ChinJPharmAnal,31(2):217-221.[黄志芳,易进海,陈东安,等,2011.制川乌HPLC特征图谱研究和6种酯型生物碱的含量测定[J].药物分析杂志,31(2):217-221.]
LIMT,XIEXF,CHENHM,etal.,2020.AconitineinducescardiotoxicitythroughregulationofcalciumsignalingpathwayinzebrafishembryosandinH9c2cells[J].JApplToxicol,40(6):1-14.
LINH,DENGGH,2011.HPLCfingerprintofRadixAconiti[J].ChinJExpTradMedForm,17(3):73-76.[林华,邓广海,2011.川乌HPLC指纹图谱的研究[J].中国实验方剂学杂志,17(3):73-76.]
LIUF,HANX,LIN,etal.,2019.Aconitumalkaloidsinducecardiotoxicityandapoptosisinembryoniczebrafishbyinfluencingtheexpressionofcardiovascularrelativegenes[J].ToxicolLett,305(2):10-18.
LIUS,LIF,LIY,etal.,2017.AreviewoftraditionalandcurrentmethodsusedtopotentiallyreducetoxicityofAconitumrootsinTraditionalChineseMedicine[J].JEthnopharmacol,207:237-250.
LUOH,HUANGZF,TANGXL,etal.,2016.DynamicvariationpatternsofaconitumalkaloidsindaughterrootofAconitumcarmichaelii(Fuzi)inthedecoctionprocessbasedonthecontentchangesofnineaconitumalkaloidsbyHPLC-MS-MS[J].IranJPharmRes,15(1):263-273.
LUOCM,YIFL,XIAYL,etal.,2018.ComprehensivequalityevaluationofthelateralrootofAconitumcarmichaeliiDebx.(Fuzi):simultaneousdeterminationofninealkaloidsandchemicalfingerprintingcoupledwithchemometricanalysis[J].JSepSci,42(5):980-990.
MALJ,CHENQX,HANL,etal.,2016.StudyonHPCE-DADfingerprintofaconitumandaconite[J].InnMongolTradChinMed,35(15):5.[马丽娟,陈巧霞,韩乐,等,2016.乌头附子类药材HPCE-DAD指纹图谱的研究[J].内蒙古中医药,35(15):5.]
MIAOLL,ZHOUQM,PENGC,etal.,2019.DiscriminationofthegeographicaloriginofthelateralrootsofAconitumcarmichaeliiusingthefingerprint,multicomponentquantification,andchemometricmethods[J].Molecules,24(22):4124.
NYIRIMIGABOE,XUYY,LIYB,etal.,2015.Areviewonphytochemistry,pharmacologyandtoxicologystudiesofAconitum[J].JPharmPharmacol,67(1):1-19.
QINY,WANGJB,ZHAOYL,etal.,2012.EstablishmentofabioassayforthetoxicityevaluationandqualitycontrolofAconitumherbs[J].JHazardMat,199-200(15):350-357.
QINYX,2016.StudyonfactorsaffectingqualityandqualitycontrolinprocessingofRadixAconiti[D].Beijing:BeijingUniversityofChineseMedicine.[秦语欣,2016.川乌炮制过程中影响质量的因素分析及质量控制研究[D].北京:北京中医药大学.]
SHAWD,2010.ToxicologicalrisksofChineseherbs[J].PlantaMed,76(17):2012-2018.
SIXX,2019.StudyonthequalityevaluationandgradestandardofAconitiRadix[D].Ya’an:SichuanAgriculturalUniversity.[司欣鑫,2019.川乌质量评价及等级标准研究[D].雅安:四川农业大学.]
TANGM,ZHAOLC,XUM,etal.,2017.ChemicalconstituentsandpharmacologicalactivitiesofAconitilateralisRadixPraeparata[J].Guihaia,37(12):1614-1627.[唐梅,赵立春,徐敏,等,2017.附子化学成分和药理作用研究进展[J].广西植物,37(12):1614-1627.]
WANGC,SUNDN,LIUCF,etal.,2015.MotherrootofAconitumcarmichaeliiDebeauxexertsantinociceptiveeffectinCompletFreund’sAdjuvantinducedmice:rolesofdynorpin/kappaopioidsystemandtransientreceptorpotentialvanilloidtype1ionchannel[J].JTranslMed,13(1):284.
WANGFP,CHENQH,2010.TheC19-diterpenoidalkaloids[J].TheAlkaloidsChemBiol,69:1-577.
WEIHZ,YANGL,SONGXZ,etal.,2020.StudyonqualitymarkerofAconitiRadixbasedonmultivariatestatisticalanalysis[J].ChinMedMat,43(7):1658-1662.[魏惠珍,杨磊,宋细忠,等,2020.基于多元统计分析的川乌质量标志物研究[J].中药材,43(7):1658-1662.]
XIONGJ,TANNH,ZHOUJ,2005.FingerprintandalkaloidcontentdeterminationofRadixAconiti[C].Wuhan:Proceedingsofthe8thNationalSymposiumontraditionalChinesemedicineandnaturalmedicineandthe5thNationalSymposiumonmedicinalplantsandplantpharmacy:343.[熊江,譚宁华,周俊,2005.川乌的指纹图谱及生物碱含量测定[C].武汉:第八届全国中药和天然药物学术研讨会与第五届全国药用植物和植物药学学术研讨会论文集:343.]
YANGL,2020.StudyofqualitystandardofAconitiRadixqualityevaluationandgradestandardresearch[D].Nanchang:JiangxiUniversityofChineseMedicine.[杨磊,2020.川乌质量标准化研究-质量评价和等级标准研究[D].南昌:江西中医药大学.]
YEXT,ZHONGLY,ZHANGDY,etal.,2020.ResearchprogressonmultimaterialandmultiprocessprocessingofAconitiRadix[J].ChinJExpTradMedForm,26(18):202-209.[叶协滔,钟凌云,张大永,等,2020.川乌的多物料,多流程炮制研究进展[J].中国实验方剂学杂志,26(18):202-209.]
YUHH,LIM,LIYB,etal.,2019.BenzoylaconitineinhibitsproductionofIL6andIL8viaMAPK,Akt,NFκBsignalinginIL1βinducedhumansynovialcells[J].BiolPharmBull,43(2):334-339.
YUYJ,LIJS,CAIH,etal.,2009.ThecomparativestudyofHPLCfingerprintbetweenRadixAconitiandRadixAconitiPreparata[J].ChinArchTradChinMed,27(11):2456-2458.[于永军,李俊松,蔡皓,等,2009.川乌炮制前后高效液相色谱指纹图谱比较研究[J].中华中医药学刊,27(11):2456-2458.]
ZHAOFC,NIEJH,WANGW,etal.,2014.HPLCfingerprintanalysisofAconitumHerbalsinXinjiang[J].JChinPharmSci,49(24):2159-2164.[赵翡翠,聂继红,王伟,等,2014.基于HPLC指纹图谱的准噶尔乌头化学亲缘关系研究[J].中国药学杂志,49(24):2159-2164.]
ZHAOJN,HUAH,DAIY,etal.,2020.DaodiherbspharmacologyandnewideasofDaodiherbsstandardconstruction[J].ChinJChinMatMed,45(4):7-12.[赵军宁,华桦,戴瑛,等,2020.道地药材药理学与道地药材标准构建新思路[J].中国中药杂志,45(4):7-12.]
ZHENGQF,ZHAOYL,WANGJB,etal.,2014.Spectrum-effectrelationshipsbetweenUPLCfingerprintsandbioactivitiesofcrudesecondaryrootsofAconitumcarmichaeliiDebeaux(Fuzi)anditsthreeprocessedproductsonmitochondrialgrowthcoupledwithcanonicalcorrelationanalysis[J].JEthnopharmacol,153(3):615-623.
ZHUHB,WANGCY,QIY,etal.,2013.FingerprintanalysisofRadixAconitiusingultraperformanceliquidchromatographyelectrosprayionization/tandemmassspectrometry(UPLCESI/MSn)combinedwithstoichiometry[J].Talanta,103:56-65.
(責任编辑周翠鸣)
收稿日期:2022-01-28
基金项目:国家重点研发计划项目(2018YFC1707103);黑龙江省“头雁”团队项目
第一作者:吴丹丹(1990-),硕士研究生,研究方向为中药药效物质基础及作用机制,(Email)dlwudd@163.com。
通信作者:杨炳友,博士,教授,研究方向为中药药效物质基础及作用机制,(Email)ybywater@163.com。
