蔗糖对列当科两种根部半寄生植物吸器发生的促进作用
2022-06-18李艳梅隋晓琳薛瑞娟李悦罗燕李爱荣
李艳梅 隋晓琳 薛瑞娟 李悦 罗燕 李爱荣

摘要:吸器是寄生植物的特征器官,研究影響其发生的因素,有助于了解寄生关系的建立和调控过程。该研究以两种列当科(Orobanchaceae)根部半寄生植物甘肃马先蒿(Pedicularis kansuensis)和松蒿(Phtheirospermum japonicum)为材料,通过皿内培养试验,分析了蔗糖、DMBQ(2,6二甲氧基对苯醌,一种高效的列当科根部半寄生植物吸器诱导化合物)和寄主植物诱导下两种根部半寄生植物吸器发生情况。结果表明:(1)蔗糖显著促进两种根部半寄生植物吸器发生,无寄主存在时,2%蔗糖处理使甘肃马先蒿和松蒿吸器发生率分别提高39.9%和20.2%。(2)蔗糖明显提升寄主植物对两种根部半寄生植物的吸器诱导水平,添加蔗糖后,寄主诱导的甘肃马先蒿单株吸器数和具木质桥的吸器比例分别增加5.7个/株和17.9%,松蒿吸器发生率和具木质桥的吸器比例分别提升76.7%和16.2%。(3)蔗糖对松蒿吸器发生的促进作用与已知吸器诱导化合物DMBQ相当,均能诱导50%以上的植株产生吸器。(4)培养基中添加4%蔗糖对两种根部半寄生植物的吸器诱导效果最好,其中甘肃马先蒿吸器发生率为56%、松蒿为37.9%。综上认为,蔗糖对两种根部半寄生植物吸器发生和分化均有明显的促进作用。
关键词: 甘肃马先蒿, 松蒿, 2,6二甲氧基对苯醌, 吸器发生, 蔗糖浓度
中图分类号:Q945.4
文献标识码:A
文章编号:10003142(2022)05081109
Enhancement effects of sucrose on haustorium formation
in two root hemiparasitic species of Orobanchaceae
Abstract:Haustoria are characteristic organs of parasitic plants. That a better knowledge of factors influencing haustorium formation is essential to understand the establishment and regulation of parasitic relationship. Pedicularis kansuensis and Phtheirospermum japonicum, two hemiparasitic species from the family Orobanchaceae, were used as research objects. Agar culture experiments were conducted to investigate the effects of sucrose, DMBQ(2,6dimethoxypbenzoquinone, an effective haustoriuminducing factor for root hemiparasitic Orobanchaceae species) and host plants on haustorium formation. The results were as follows: (1) Sucrose significantly promoted haustorium formation. Amendment with 2% sucrose increased the percentage of plants with haustoria in Pedicularis kansuensis and Phtheirospermum japonicum by 39.9% and 20.2% in the absence of host plants. (2) Sucrose enhanced haustoriuminducing activity of host plants. The number of haustoria per plant and ratio of haustoria with xylem bridges induced by host plants increased by 5.7 and 17.9% in Pedicularis kansuensis, and percentage of plants with haustoria and ratio of haustoria with xylem bridges increased by 76.7% and 16.2% in Phtheirospermum japonicum. (3) The promoting effect of sucrose on haustorium formation was of a similar magnitude as DMBQ for Phtheirospermum japonicum, with over 50% plants formed haustoria in both treatments. (4) Four percent was the optimal sucrose concentration for haustorium formation of two root hemiparasitic species, leading to the highest percentage of plants with haustoria (56% for Pedicularis kansuensis and 37.9% for Phtheirospermum japonicum). All the above results indicate that sucrose has significant promoting effects on both haustorium initiation and differentiation of the tested hemiparasitic species.
Key words: Pedicularis kansuensis, Phtheirospermum japonicum, 2,6dimethoxypbenzoquinone(DMBQ), haustorium formation, sucrose concentration
寄生植物是被子植物中的一个特殊类群,可以通过特有的寄生器官(吸器)从寄主获取养分和水分,以满足自身生长需求。寄生植物种类约占被子植物总数的1%,经历了至少12次独立进化(Westwood et al., 2010),分属于27个科,其中列当科(Orobanchaceae)是寄生植物种类最丰富的一个科(Joel et al., 2013; Wakatake et al., 2018)。列当科的独脚金属(Striga spp.)和列当属(Orobanche spp.)的部分寄生植物是重要的农业杂草(Yoshida & Shirasu, 2009; Cui et al., 2016; Kokla & Melnyk 2018)。据统计,非洲地区每年仅因独脚金侵害造成的农业损失高达20亿美元(Kokla & Melnyk, 2018)。因此,了解寄生植物的寄生过程和调控机制对制定合理的寄生杂草防控策略具有积极意义(Westwood et al., 2010)。
吸器是沟通寄生植物和寄主的桥梁和唯一通道,具有连接寄主、侵入寄主组织并从寄主获取水分和养分等资源的功能(Westwood et al., 2010; Yoshida et al., 2016)。虽然寄生植物形态各有不同,对寄主植物的依赖程度也存在较大差异,但形成吸器是所有寄生植物与寄主建立寄生关系并从寄主获取资源的必要环节(Westwood et al., 2010)。目前,关于吸器发生的研究主要集中在列当科,尤其是列当科的根部半寄生植物(Atsatt et al., 1978; Baird & Riopel, 1984; Ishida et al., 2017; Clermont et al., 2019)。虽然根部半寄生植物具有绿色叶片,可以进行一定程度的光合作用,但依然需要通过在根部形成吸器以从寄主获取部分资源,被认为是植物从自养向全寄生进化的过渡类群(Westwood et al., 2010)。列当科根部半寄生植物吸器的发生和调控过程具有较高的多样性,是研究吸器发生和寄生植物进化的理想材料(Ishida et al., 2017; Xiang et al., 2018; Clermont et al., 2019)。大量的皿内试验表明,植物根系分泌物中的化学物质(主要包括醌类、酚类和黄酮类等物质)对列当科根部半寄生植物吸器发生具有强烈的诱导作用(Albrecht et al., 1999; Goyet et al., 2019),其中醌类物质2,6二甲氧基对苯醌(DMBQ)是目前列当科根部半寄生植物皿内吸器诱导试验中最常用的化合物(Ishida et al., 2016)。当前由于研究主要关注寄主植物或已知吸器诱导物诱导下吸器的发生以及生理和分子调控过程,因此对影响吸器发生的其他因素的研究仍然十分有限。
蔗糖是植物皿内培养体系中应用最为广泛的碳源物质,对植物代谢及发育过程具有非常重要的作用(Deak & Malamy, 2005;Solfanelli et al., 2006)。尽管目前探讨寄生植物吸器发生和调控的研究多在皿内培养条件下进行,但关于蔗糖对吸器发生影响的研究十分有限。仅有的数据显示,蔗糖对不同寄生植物吸器发生的影响可能存在较大差异。例如,在水琼脂培养基中添加2%的蔗糖显著促进甘肃马先蒿(Pedicularis kansuensis)吸器形成(Xiang et al., 2018),但添加蔗糖反而抑制多枝列当(Phelipanche ramosa,原Orobanche ramosa)吸器形成(GonzálezVerdejo et al., 2008)。在另外两种根部半寄生植物直果草(Triphysaria versicolor)和松蒿(Phtheirospermum japonicum)的研究中,我们发现研究者在直果草的培养基中会添加蔗糖(Albrecht et al., 1999),而培养松蒿时却刻意避开蔗糖(Wakatake et al., 2018)。由于上述研究在观察时间及所关注的吸器调控过程方面各有侧重,因此尚未有专门针对蔗糖影响吸器发生的较为全面的研究报道。
本研究选取列当科的两种根部半寄生植物甘肃马先蒿和松蒿作為材料,通过皿内试验探究在培养基中添加蔗糖对两种根部半寄生植物吸器发生的影响。具体而言,拟回答以下问题:(1)蔗糖对这两种根部半寄生植物吸器发生的影响与已知吸器诱导物DMBQ有无差异;(2)蔗糖是否影响寄主对这两种根部半寄生植物吸器发生的诱导效应;(3)蔗糖对两种根部半寄生植物吸器发生的影响是否相同,是否受蔗糖浓度的影响。相关结果可以推动对已知吸器诱导物之外因素的探讨,从而促进对吸器发生影响因素和调控过程的多元化理解,并为皿内吸器调控试验中培养基配制提供理论参考。
1材料与方法
1.1 材料
所用材料为甘肃马先蒿的种子,于2017年9月采自新疆巴音布鲁克草原(平均海拔为2 500 m,83°42.5′ E、42°53.1′ N)。种子经室温干燥和过筛处理后放置于纸袋并储存在4 ℃冰箱中。紫花苜蓿(Medicago sativa)种子购买自克劳沃(北京)生态科技公司;松蒿种子由日本奈良先端科学技术大学院大学植物共生实验室提供;拟南芥种子(Arabidopsis thaliana)由昆明植物研究所胡金勇研究员课题组提供。
1.2 种子萌发方法
首先将甘肃马先蒿种子浸没于70%酒精中震荡消毒5 min,然后用反渗透水(reverse osmosis,RO水)冲洗至无酒精味,于5%次氯酸钠中震荡10 min,在超净台内用无菌水冲洗5次以上,最后将种子置于无菌滤纸上吹干。待种子表面水分吹干后用无菌镊子逐颗接种于0.5%水琼脂(Wako; cat.no. 01015815)培养基上,每皿40~50颗种子。接种后的培养皿用封口膜封好置于25 ℃/18 ℃(日/夜)光温培养箱中萌发,光周期为22.2 μmol·m2·s1,12 h光照和12 h黑暗。
首先将紫花苜蓿种子用70%酒精震荡消毒5 min,然后于超净台内无菌水冲洗5次以上后将种子置于无菌滤纸上吹干表面水分,最后用无菌镊子逐颗接种于1/2 MS(0.5%琼脂+1%蔗糖)培养基中。接种后的培养皿用封口膜封好后置于光温培养箱(培养条件同上)。
松蒿种子萌发参照Wakatake等(2018)的方法,略有改动,具体如下:将松蒿种子于0.5%次氯酸钠中浸泡5 min,在超凈台内用无菌RO水冲洗5次,转移到1/2 MS培养基中,4 ℃暗处理1~2 d,转移至25 ℃/18 ℃(日/夜)光温培养箱暗处理4~5 d后水平光照培养(光周期12 h)。其中,用于寄主试验的松蒿种子培养于0.8%水琼脂中。
首先将拟南芥种子于70%酒精消毒10 min,无菌水冲洗5次以上后转至1/2 MS培养基,4 ℃暗处理2 d,然后25 ℃/18 ℃(日/夜)光温培养箱培养8 d(Wakatake et al., 2018)。
1.3 试验设计
1.3.1 蔗糖和DMBQ对两种根部半寄生植物吸器发生的差异为对比DMBQ和蔗糖对半寄生植物吸器发生的诱导差异,我们设置了2%蔗糖、10 μmol·L1 DMBQ(用量参照Ishida et al., 2016)和0.1% DMSO(二甲基亚砜,有机物溶剂)3个处理,其中蔗糖和DMBQ为处理组,DMSO为对照组。蔗糖和DMBQ均溶解于0.1% DMSO溶液中,配制好的试剂于超净工作台过滤灭菌后,分别滴加于0.8%水琼脂培养基表面,每皿4~7 mL。选取长势一致的萌发11 d的甘肃马先蒿和14 d的松蒿幼苗,并将幼苗转接于上述3种培养皿中,每皿5~7株植株,重复5次。培养皿用封口膜封好后水平放置于25 ℃恒温培养室中,光周期为22.2 μmol·m2·s1,12 h光照和12 h黑暗。转接后第2天和第5天于体式显微镜下观察并统计吸器数。
1.3.2 蔗糖和寄主对根部半寄生植物吸器发生的诱导
以紫花苜蓿为甘肃马先蒿寄主,拟南芥为松蒿寄主,探究寄主植物存在时,蔗糖添加前后两种根部半寄生植物吸器发生情况。以0.8%水琼脂培养基中添加20 g·L1蔗糖为处理组,空白培养基为对照组。选取长势一致的11 d苗龄的甘肃马先蒿和6~8 d的紫花苜蓿,以及14 d苗龄的松蒿和10 d的拟南芥;将上述植物组合转接于处理组与对照组中,并保证植株的根尖紧密贴合。每皿两对植物组合,重复30次,培养条件同上。松蒿和拟南芥共培养7 d以及甘肃马先蒿和紫花苜蓿共培养14 d后,于体式显微镜下统计吸器数,并进行透明处理统计功能性吸器数。
1.3.3 不同蔗糖浓度对根部半寄生植物吸器发生和植株发育影响共设置0、2%、4%和8% 4个蔗糖浓度梯度,其中蔗糖浓度为0的处理为对照组。由于松蒿种子萌发培养基(1/2 MS)中添加了蔗糖,因此将萌发7 d的松蒿幼苗转至0.8%水琼脂培养基培养饥饿处理6 d以避免干扰。随后,将11 d苗龄的甘肃马先蒿幼苗与松蒿幼苗分别转接至不同蔗糖浓度的培养基中,每皿10株幼苗,重复10次,培养条件同上。
1.4 染色方法与数据采集分析
1.4.1 吸器染色方法参考Wakatake等(2018)的方法,主要观察吸器是否形成木质桥,若有,则该吸器为成熟吸器(mature haustorium)。具体步骤如下:(1)将样品用流水进行清理后,放置于组织包埋盒内,先用10%的KOH溶液于90 ℃水浴锅中加热15 min,再用PBS溶液(pH 7.2)冲洗3遍。(2)冲洗后移入0.1%番红溶液(溶剂为30%的乙醇)中常温浸泡5 min,用PBS溶液多次冲洗以洗去多余染液。(3)将包埋盒置于30%乙醇溶液脱色4 h(松蒿脱色时间为1 h)。(4)利用体式显微镜对吸器进行观察并拍照。
1.4.2 数据收集与处理吸器数和侧根数均在体式显微镜(Olympus DP74)下进行统计,发紫植株统计标准为地上部分(幼茎、幼叶)均呈紫色。吸器发生率(percentage of plants with haustoria, PH),单株吸器数(number of haustoria per plant, NH),单株侧根数(number of lareral roots per plant, NLH),紫色植株率(percentage of purple plants, PP)。计算公式如下:
PH=产生吸器植株数/处理植株数×100%;
NH=吸器总数/产生吸器的植株数;
NLH=侧根总数/处理植株数;
PP=发紫植株数/处理植株数×100%。
采用SPSS 16.0软件进行独立样本T检验和单因素方差分析(Oneway ANOVA),用LSD法进行多重比较,方差不齐的采用Tamhane’s T2法进行比较。利用Adobe Illustrator CC 2018对图片进行调整和排版。
2结果与分析
2.1 蔗糖和DMBQ处理下甘肃马先蒿和松蒿的吸器发生情况
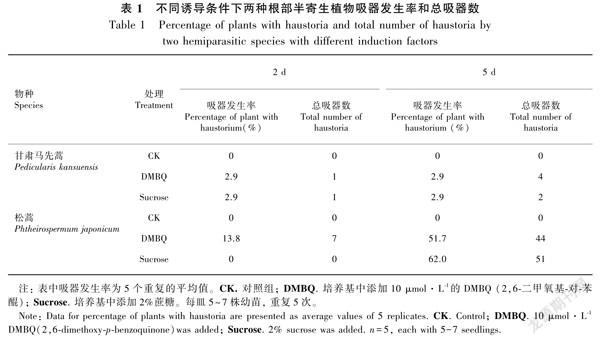
对于甘肃马先蒿,蔗糖和DMBQ的诱导效应是一致的。转接2 d后,对照中无吸器发生,但蔗糖和DMBQ处理植株中有2.9%产生吸器,且吸器数相同。诱导5 d后,所有处理的吸器发生率无变化,但总吸器数增加。这说明已经产生吸器的甘肃马先蒿不能诱导周围的植株产生吸器。虽然DMBQ和蔗糖均只诱导2.9%的甘肃马先蒿植株产生吸器,但DMBQ诱导产生的吸器数多于蔗糖(表1)。
虽然蔗糖和DMBQ均能诱导松蒿产生吸器,但诱导效应不一致,且松蒿吸器发生受诱导时间影响。DMDQ诱导2 d后,有13.8%的松蒿产生吸器,而相同条件下蔗糖诱导的松蒿吸器发生率为0。处理5 d后,蔗糖诱导的松蒿吸器发生率由0增至62.0%,而DMBQ诱导的松蒿吸器发生率增加2.7倍,吸器数增加5.3倍(表1)。
2.2 寄主植物存在时,蔗糖对两种根部半寄生植物吸器发生的影响
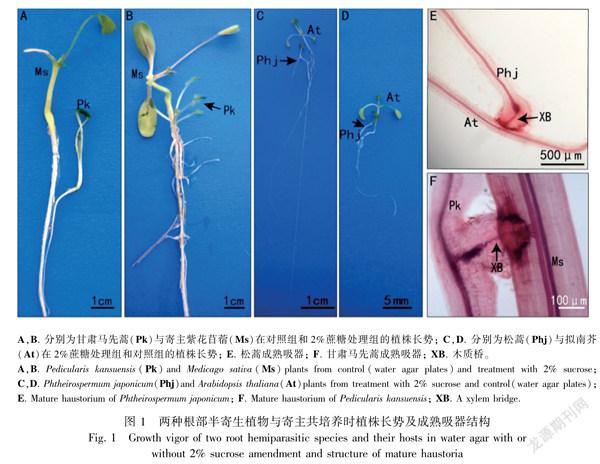
蔗糖添加有利于植株生长。甘肃马先蒿和寄主紫花苜蓿在无糖培养基中的长势相对含糖培养基要弱,相同生长条件下含糖培养基中甘肃马先蒿和紫花苜蓿长出2~4片真叶,且根系发达,侧根多(图1:A);而无糖培养基中植株侧根少,真叶尚未展开(图1:B)。同样,松蒿和拟南芥共培养7 d后,含糖培养基中植株主根较長,但无糖处理中植株长势弱、真叶较小(图1:C,D)。
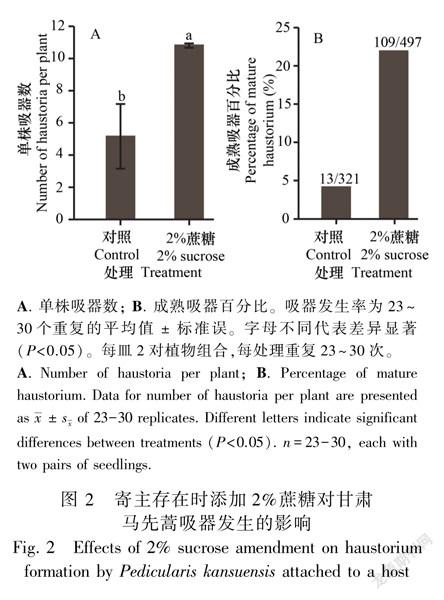
寄主存在时,添加蔗糖更有利于甘肃马先蒿和松蒿的吸器发生和吸器中木质桥的分化。甘肃马先蒿和紫花苜蓿共培养14 d后,对照中单株吸器数5.21个/株,而蔗糖处理的甘肃马先蒿单株吸器数是对照的2倍(图2:A)。在松蒿和拟南芥共培养1 d后,对照中20%的松蒿形成吸器;而含糖处理中87.5%的松蒿形成吸器,是对照的4.4倍;培养7 d后对照中23.3%的植株产生吸器,但含糖处理中全部植株均产生吸器,且总吸器数为对照的24.7倍(表2)。寄生植物与寄主建立木质桥连接是吸器发育成熟的标志,通过对吸器进行透明染色观察发现,对照中甘肃马先蒿处理产生了321个吸器, 其中有4%的吸器与寄主紫花苜蓿建立了
木质桥连接的功能性吸器;添加蔗糖后,甘肃马先蒿共产生497个吸器,具有木质桥的吸器比例为22%,是对照的5.5倍(图1:F;图2:B)。对于松蒿,培养7 d后对照处理产生7个吸器,经透明染色处理后发现这些吸器均无木质桥形成;而蔗糖处理后有12.7%的吸器与寄主建立木质桥连接的吸器(图1:E;表3)。
此外,寄主植物存在时,松蒿吸器发生表现出随诱导时间增加而增多的趋势。蔗糖诱导第1天,松蒿吸器发生率为87.5%,总吸器数为35个;而在第7天松蒿吸器发生率为100%,总吸器数约为第1天的5倍(表2)。
2.3 不同蔗糖浓度下两种根部半寄生植物吸器和侧根发生情况
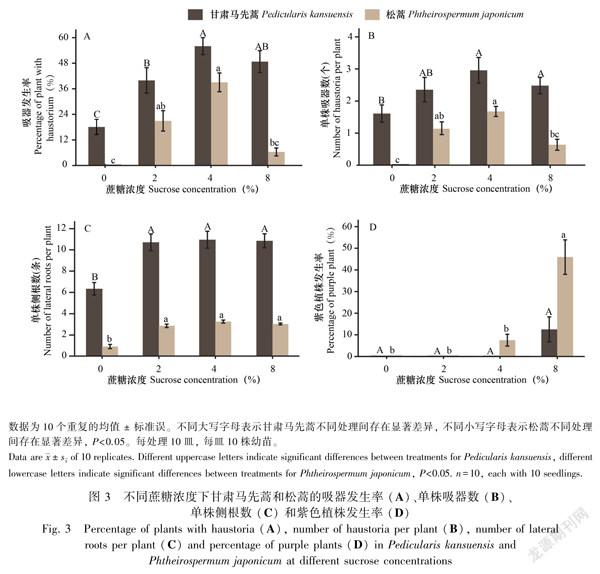
蔗糖显著促进甘肃马先蒿和松蒿吸器发生。在所有蔗糖浓度中,甘肃马先蒿的吸器发生率和吸器数均高于对照,其中4%的蔗糖处理时吸器发生率最高为56%,是对照的3.1倍(图3:A,B)。对照处理中松蒿无吸器产生,而在蔗糖添加的所有处理中,松蒿吸器发生率和吸器数均高于对照。4%蔗糖处理中松蒿吸器发生率最高,为37.9%(图3:A,B)。
蔗糖影响两种根部半寄生植物的侧根发育。对照中甘肃马先蒿单株侧根数为6.3条/株,添加蔗糖的所有处理中单株侧根数显著高于对照,均大于10条/株,但各处理间无显著差异。对于松蒿,对照中单株侧根数为0.9条/株,添加蔗糖后单株侧根数分别为2.7条/株、3.1条/株、2.9条/株,显著高于对照(图3:C)。
虽然蔗糖影响寄生植物的吸器发生,但两种根部半寄生植物对蔗糖浓度的响应不同。在蔗糖浓度为8%时,甘肃马先蒿的吸器发生率和吸器数均显著高于对照,而此浓度下松蒿的吸器发生率与对照相比无显著差异。在培养过程中我们发现高浓度蔗糖处理的植株会积累紫色色素。通过对地上部分呈紫色的植株进行统计发现,4%蔗糖处理中有7.5%的松蒿植株出现紫色,当浓度升高至8%时,46.1%的松蒿出现发紫现象。甘肃马先蒿仅在8%蔗糖处理时出现发紫现象,发紫率为12.5%,为相同条件下松蒿发紫率的27%,表明甘肃马先蒿耐受的蔗糖浓度高于松蒿(图3:D)。
3讨论与结论
3.1 蔗糖促进寄主对两种根部半寄生植物吸器发生的诱导
作为寄生植物的特征器官,吸器的发生与调控一直以来是人们关注的重点(Yoshida et al., 2016)。本研究结果表明,蔗糖在列当科根部半寄生植物的吸器发生过程中发挥着重要作用,不仅促进甘肃马先蒿和松蒿单独培养时的吸器发生,而且显著提高了寄生于寄主时的吸器发生水平。虽然之前报道过蔗糖可促进甘肃马先蒿自发性吸器形成(Xiang et al., 2018),但寄主存在时蔗糖对寄生植物吸器发生的影响未得到关注。本研究中,当甘肃马先蒿和松蒿分别与各自的寄主共培养时,蔗糖提高了具有木质桥的吸器比例,说明蔗糖影响吸器发生的全过程,既影响吸器发生又影响吸器的进一步分化。这与之前的一些研究结果是相反的。在对列当科两种全寄生植物多枝列当和圆齿列当(Orobanche crenata)的研究中发现,蔗糖对其种子萌发、吸器发生及吸器侵入寄主均表现出强烈的抑制作用(GonzálezVerdejo et al., 2008;
Nadal et al., 2009)。同样,全寄生植物和根部半寄生植物在吸器诱导物的响应方面存在差异,
数据为10个重复的均值 ± 标准误。不同大写字母表示甘肃马先蒿不同处理间存在显著差异, 不同小写字母表示松蒿不同处理间存在显著差异, P<0.05。每处理10皿, 每皿10株幼苗。
即使是能够诱导多数根部半寄生植物产生吸器的醌类、黄酮类诱导物也不能诱导全寄生植物的吸器发生(Goyet et al., 2019)。由于相关研究十分有限,因此目前还无法确定这种完全相反的效应是与寄生类型相关,还是种间差异所致。张静等(2018)认为施肥处理使寄主生物量增加,进而间接促进南方菟丝子的生长和吸器形成。本研究中,蔗糖对两种根部半寄生植物及各自寄主植物的生长均有明显的促进作用,添加蔗糖的处理中植株长势及侧根数均强于无蔗糖的处理,推测蔗糖作为碳源物质对植株生长的促进作用是其促进两种根部半寄生植物吸器发生和木质桥分化的一个重要原因。此外,蔗糖可影响植物体内生长素合成,对生长素的运输和信号传导有诱导作用(Stokes et al., 2013)。而生长素是列当科根部半寄生植物吸器发生和分化过程的重要激素(Tomilov et al., 2005; Ishida et al., 2016; Wakatake et al., 2019)。由此我们推测,蔗糖可能通过影响生长素的合成、运输和信号传导而调控吸器的发生和分化。
3.2 蔗糖對两种根部半寄生植物吸器发生的影响不同于吸器诱导物DMBQ
DMBQ是一种具有高效诱导能力的醌类化合物,被广泛应用于多种根部半寄生植物的吸器诱导试验(Yoder, 1997; Ishida et al., 2016, Goyet et al., 2019)。本研究中,DMBQ诱导2 d就能使松蒿和甘肃马先蒿产生吸器,这与Ishida等(2016)的研究结果一致。诱导时间影响根部半寄生植物吸器发生(Xiang et al., 2018)。随着诱导时间的增加,两种根部半寄生植物吸器发生率和吸器数虽然均有增加,但与DMBQ相比,蔗糖诱导2 d不能使松蒿产生吸器,说明蔗糖发挥吸器诱导作用的时间长于DMBQ。因此,今后在开展蔗糖诱导吸器发生的相关试验中,应适当延长诱导时间。
3.3 两种根部半寄生植物吸器发生对蔗糖浓度的响应不一致
高浓度蔗糖处理时植株会出现胁迫反应,其中花青素积累是胁迫表现之一(王立光等,2019)。本研究中,松蒿在蔗糖浓度为4%时便积累花青素,而甘肃马先蒿在8%时才会有花青素的积累,说明不同植物对蔗糖的耐受能力存在差异(赵长星和刘成连,2001)。虽然有关蔗糖对寄生植物吸器发生影响的研究较少,但在其他植物的研究中已经明确了蔗糖影响植物生长发育的作用机制。蔗糖可作为信号分子调控大麦的果聚糖合成(Nagaraj et al., 2001)以及拟南芥花青素合成过程(Solfanelli et al., 2006)。此外,蔗糖还可以充当渗透压调节剂影响拟南芥侧根形成(Deak & Malamy, 2005)。然而,由于蔗糖是作为信号分子还是作为渗透压调节剂来影响根部半寄生植物吸器发生尚不清楚,因此进一步的研究将有利于阐明该问题。
参考文献:
ALBRECHT H, YODER J, PHILLIPS D, 1999. Flavonoids promote haustoria formation in the root parasite Triphysaria versicolor [J]. Plant Physiol, 119(2): 585-591.
ATSATT P, HEARN T, NELSON R, et al., 1978. Chemical induction and repression of haustoria in Orthocarpus purpurascens (Scophulariaceae) [J]. Ann Bot, 42(181): 1177-1184.
BAIRD W, RIOPEL J, 1984. Experimental studies of haustorium initiation and early development in Agalinis purpurea (L.) raf. (Scrophulariaceae) [J]. Amer J Bot, 71(6): 803-814.
CLERMONT K, WANG Y, LIU S, et al., 2019. Comparative metabolomics of early development of the parasitic plants Phelipanche aegyptiaca and Triphysaria versicolor [J]. Metabolites, 9(6): e114.
CUI S, WAKATAKE T, HASHIMOTO K, et al., 2016. Haustorial hairs are specialized root hairs that support parasitism in the facultative parasitic plant Phtheirospermum japonicum [J]. Plant Physiol, 170 (3): 1492-1503.
DEAK K, MALAMY J, 2005. Osmotic regulation of root system architecture [J]. Plant J, 43 (1): 17-28.
GONZLEZVERDEJO CI, DITA MA, NADAL S, et al.,2008. Sucrose applocation suppresses infection of the parasitic plant Orobanche ramosa in tomato (Lycopersicon esculentum) [J]. Agrociencia, 42 (5): 513-517.
GOYET V, WADA S, CUI S, et al., 2019. Haustorium inducing factors for parasitic Orobanchaceae [J]. Front Plant Sci, 10: e1056.
ISHIDA J, WAKATAKE T, YOSHIDA S, et al., 2016. Local auxin biosynthesis mediated by a YUCCA flavin monooxygenase regulates haustorium development in the parasitic plant Phtheirospermum japonicum [J]. Plant Cell, 28 (8): 1795-1814.
ISHIDA J, YOSHIDA S, SHIRASU K, 2017. Haustorium induction assay of the parasitic plant Phtheirospermum japonicum [J]. BioProtoc, 7 (9): e2260.
JOEL DM, GRESSEL J, MUSSELMAN LJ, 2013. Parasitic Orobanchaceae [M]. Heidelberg: Springer: 2.
KOKLA A, MELNYK C, 2018. Developing a thief: haustoria formation in parasitic plants [J]. Dev Biol, 442(1): 53-59.
NADAL S, GONZLEZVERDEJO CI, GUZMN JR, et al., 2009. Sucrose effect on broomrape (Orobanche crenata) development on narbon bean (Vicia narbonensis L.) [J]. Afr J Biotechnol, 8 (13): 3027-3030.
NAGARAJ V, RIEDL R, BOLLER T, et al., 2001. Light and sugar regulation of the barley sucrose: fructan 6fructosyltransferase promoter [J]. Plant Physiol, 158 (12): 1601-1607.
NOEL G, TOGNETTI J, PONTIS H, 2001. Protein kinase and phosphatase activities are involved in fructan synthesis initiation mediated by sugars [J]. Planta, 213 (4): 640-646.
SOLFANELLI C, POGGI A, LORETI E, et al., 2006. Sucrosespecific induction of the anthocyanin biosynthetic pathway inArabidopsis [J]. Plant Physiol, 140 (2): 637-646.
STOKES M, CHATTOPADHYAY A, WILKINS O,et al., 2013. Interplay between sucrose and folate modulates auxin signalling in Arabidopsis [J]. Plant Physiol, 162(3): 1552-1565.
TOMILOV A, TOMILOVA, N, ABDALLAH I, et al., 2005. Localized hormone fluxes and early haustorium development in the hemiparasitic plant Triphysaria versicolor [J]. Plant Physiol, 138(3): 1469-1480.
WAKATAKE T, YOSHIDA S, SHIRASU K, 2018. Induced cell fate transitions at multiple cell layers configure haustorium development in parasitic plants [J]. Development, 145(14): dev164848.
WAKATAKE T, YOSHIDA S, SHIRASU K, 2019. Auxin transport network underlies xylem bridge formation between the hemiparasitic plant Phtheirospermum japonicum and host Arabidopsis [J]. Development, 147(14): dev187781.
WANG LG,LI JW,YE CL, et al., 2020. Effect of light regulator HY5 and HYH on sucrosespecific induction of anthocyanin accumulation [J]. Gansu Agric Sci Technol, 517(1): 25-29.[王立光, 李靜雯, 叶春雷, 等, 2019. 光调控因子HY5及HYH在蔗糖诱导花青素[J]. 甘肃农业科技, 517(1): 25-29.]
WESTWOOD J, YODER J, TIMKO M, et al., 2010. The evolution of parasitism in plants [J]. Trends Plant Sci, 15(4): 227-235.
XIANG L, LI YM, SUI XL, et al., 2018. Fast and abundant in vitro spontaneous haustorium formation in root hemiparasitic plant Pedicularis kansuensis Maxim. (Orobanchaceae) [J]. Plant Divers , 14 (5): 226-231.
YODER J, 1997. A speciesspecific recognition system directs haustorium development in the parasitic plant Triphysaria (Scrophulariaceae) [J]. Planta, 202(4): 407-413.
YOSHIDA S, CUI SK, ICHIHASHI Y, et al., 2016. The haustorium, a specialized invasive organ in parasitic plants [J]. Ann Rev Plant Biol, 67: 643-667.
YOSHIDA S, SHIRASU K, 2009. Multiple layers of incompatibility to the parasitic witchweed, Striga hermonthica [J]. New Phytol, 183 (1): 180-189.
ZHANG J, LI JM, YAN M, 2013. Effects of nutrients on the growth of the parasitic plant Cuscuta australis R. Br. [J]. Acta Ecol Sin, 33(8): 2623-2631.[張静, 李钧敏, 闫明, 2013. 基质养分对寄生植物南方菟丝子生长的影响[J]. 生态学报, 33(8): 2623-2631.]
ZHAO CX, LIU CL, 2001. Elemntary studies on measuration of lifeability of fruit tree pollen [J]. Hebei J For Orchard Res, 16(3): 44-47.[ 赵长星, 刘成连, 2001. 培养基种类及蔗糖浓度对部分果树花粉发芽率的影响[J]. 河北林果研究, 16(3): 44-47.]
(责任编辑蒋巧媛)
收稿日期:2020-10-18
基金项目:国家自然科学基金(31971536, 31872686); 中国科学院青年创新促进会优秀会员项目(2011276); 云南省万人计划青年拔尖人才项目(YNWRQNBJ2018092)
第一作者: 李艳梅(1994-),硕士研究生,研究方向为根际生态与植物多样性保护,(Email)liyanmei@mail.kib.ac.cn。
通信作者:李爱荣,博士,研究员,主要从事根部半寄生植物的根际过程及其调控研究,(Email)airongli@mail.kib.ac.cn。
