NAT2基因多态性与抗结核药物血药浓度相关性分析*
2022-06-17李星星
张 敏,徐 娜,李星星,张 雪,何 霞△
1.成都中医药大学附属医院 药剂科(成都 610071);2.成都中医药大学 药学院(成都 611137);3.四川省医学科学院·四川省人民医院 药学部(成都 610072);4.电子科技大学医学院·个体化药物治疗四川省重点实验室(成都 610072)
肺结核是一种慢性呼吸道传染疾病,研究[1]数据显示,全球每年死于肺结核的人数高达200万人,我国每年新增肺结核患者约100万人,且全球患病率呈逐年上升趋势,肺结核已成为严重危害人类健康的传染病之一。相关研究[2]报道,抗结核药物不良反应中肝损伤可达5.17%(60/1 160),肝损伤不仅影响结核患者治疗持续性和药物疗效,甚至会危及患者生命。现有研究[3]表明,应用常用的一线抗结核药物联合治疗的患者相较于其他抗结核治疗方案的患者,被诊断为肝损伤的概率更高。常用一线抗结核药物主要有吡嗪酰胺(pyrazinamide,PZA)、利福平(rifampicin,RFP)、异烟肼(isoniazid,INH)、乙胺丁醇(ethambuto,EMB)等,其中PZA、RFP和INH均具有肝脏毒性[4]。当肺结核患者治疗过程中出现肝功能异常时可影响治疗效果,甚至中断治疗、产生耐药性[5]。因此,在治疗肺结核患者的标准方案实施时,尽量减轻或避免肝损伤的发生对于提高抗结核药物临床疗效和改善患者预后具有重要意义。N-乙酰基转移酶2(N-acetyltransferase 2,NAT2)是人体内重要的Ⅱ相代谢酶,为INH、RFP的代谢酶,其基因的多态性与患者肝损伤、结核治疗药物代谢形式间存在联系[6]。由于NAT2基因多态性导致乙酰化能力的不同,可分为慢乙酰化型(slow acetylator,SA)、中乙酰化型(intermediate acetylator,IA)和快乙酰化型(rapid acetylator,RA)[7]。近年越来越多研究[8-9]表明,NAT2基因多态性与抗结核药物性肝损伤(druginduced liver injury during anti-TB treatment,AT-DILI)易感性存在密切联系。本研究旨在分析经标准治疗方案治疗后,患者抗结核药物血药浓度与NAT2基因多态性间的相关性,为后续进一步研究NAT2基因多态性与AT-DILI相关性提供更多的临床基础数据。
1 资料与方法
1.1 临床资料
纳入2019年1月至2021年6月于四川省人民医院和成都中医药大学附属医院诊断为肺结核的住院患者55例为研究对象。纳入标准:1)根据痰涂片阳性、痰培养阳性、病理学报告阳性和临床诊断确诊的结核患者或《抗结核药物性肝损伤诊治指南(2019年版)》[10]确诊为肺结核的患者;2)年龄16~85岁。排除标准:1)不使用INH、PZA等一线抗结核药物标准治疗方案的患者;2)不能获取患者抗结核药物前后完整相关生化指标数据的病例;3)入组前肝功能异常或合并患病毒性肝炎、脂肪肝等对肝功能影响较大的患者;4)服用化疗药物、部分抗菌药物、大剂量对乙酰氨基酚等有明显肝毒性药物患者[11]。
研究在四川省人民医院和成都中医药大学附属医院伦理委员会批准下进行。根据乙酰化能力的不同,55例患者被分为RA组19例(34.5%)、IA组29例(52.7%)和SA组7例(12.7%);其中男39例(70.9%),女16例(29.1%);汉族52例(94.5%),藏族2例(3.6%),羌族1例(1.8%);年龄17~84岁,体重37~75 kg,体重指数(body mass index,BMI)15.37~26.22 kg/m2;血药浓度:INH 0.25~2.11 mg/L,RFP 0.25~19.79 mg/L,PZA 1.00~51.81 mg/L。
1.2 观察指标
基本信息:患者性别、年龄、疾病诊断、体重、民族、开始抗结核治疗日期、吸烟史、饮酒史、既往史、抗结核治疗药物及其剂量。检测与肝毒性有关的INH、RFP和PZA药物血药浓度[12]。
1.3 给药方案
采用世界卫生组织推荐标准治疗方案:INH、RFP、PZA和EMB 2个月强化治疗;INH+RFP 4个月巩固治疗[10,13]。
1.4 检测方法
在接受抗结核治疗前,应用荧光定量PCR探针法测定NAT2基因6个位点(rs1799929、rs1799930、rs1041983、rs1799931、rs1208、rs1801280)的基因型。应用超高效液相色谱串联质谱法(ultra performance liquid chromatography-MS/MS,UPLC-MS/MS)测定抗结核治疗开始后7 d患者的抗结核药物浓度,分析NAT2基因多态性与标准方案治疗后抗结核药物血药浓度间的关系。DNA的提取、保存按照DNA提取试剂盒说明进行,应用NAT2Taqman SNP 基因分型试剂盒检测NAT2基因位点。反应条件:60 ℃ 20 s,95 ℃ 5 min,95 ℃ 5 s,60 ℃ 60 s,共40个循环;60 ℃延伸5 min,详见参考文献[14]。
1.5 药品、试剂与仪器
药品:PZA(100 mg/支,批号:100178-201104),RFP(100 mg/支,批号:130496-201403),INH(100 mg/支,批号:100578-200401),均来源于中国食品药品检定研究院[11]。试剂:血液基因组离心柱型DNA提取试剂盒(北京天根生化科技有限公司);NAT2Taqman SNP 基因分型试剂盒(美国AppliedBiosystem公司);NAT2基因分型试剂盒(美国Thermo Fisher Scientific公司)。仪器:NanoDrop 2000型核酸浓度测定仪、实时定量PCR仪ABI7500(美国Thermo Fisher Scientific公司);NAT2primer(美国 Invitrogen公司);实时荧光定量PCR仪LightCycler©480 Ⅱ(德国Roche公司)。
1.6 统计学方法
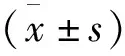
2 结果
2.1 3组患者一般资料比较
RA组、IA组和SA组3组患者性别、年龄、体重和BMI一般资料比较,差异无统计学意义(P>0.05),具有可比性(表1)。
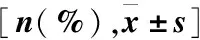
表1 3组患者一般资料比较
2.2 NAT2基因多态性位点分型结果
55例患者检测NAT2 6种基因型:NAT2*4*4、NAT2*4*6A、NAT2*4*7B、NAT2*4*5B、NAT2*6A*7B和NAT2*6A*6A,基因型分布分别为34.5%、32.7%、18.2%、1.8%、7.3%和5.5%(表2)。
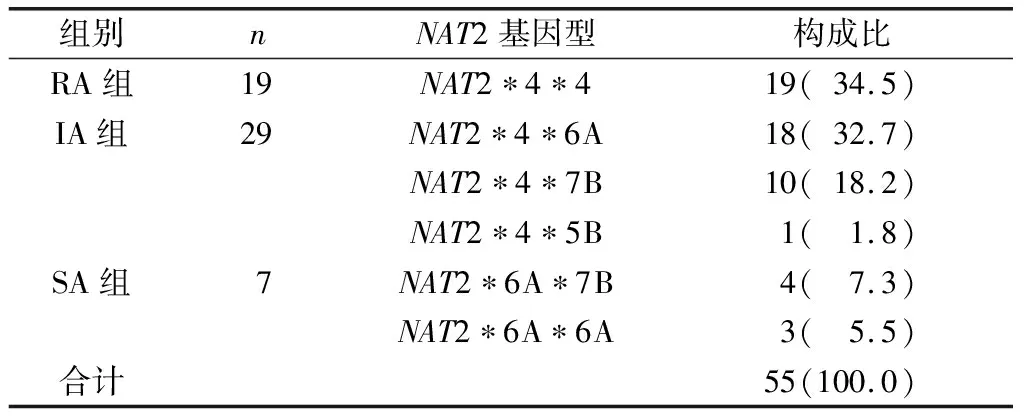
表2 3组患者NAT2基因型分析结果[n(%)]
2.3 NAT2基因位点HWE遗传平衡检验
应用χ2检验对NAT2基因6个单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点的基因型分布进行统计分析,6个SNPs基因型在患者人群中的分布均符合HWE,所选研究对象具有代表性(P>0.05)(表3)。
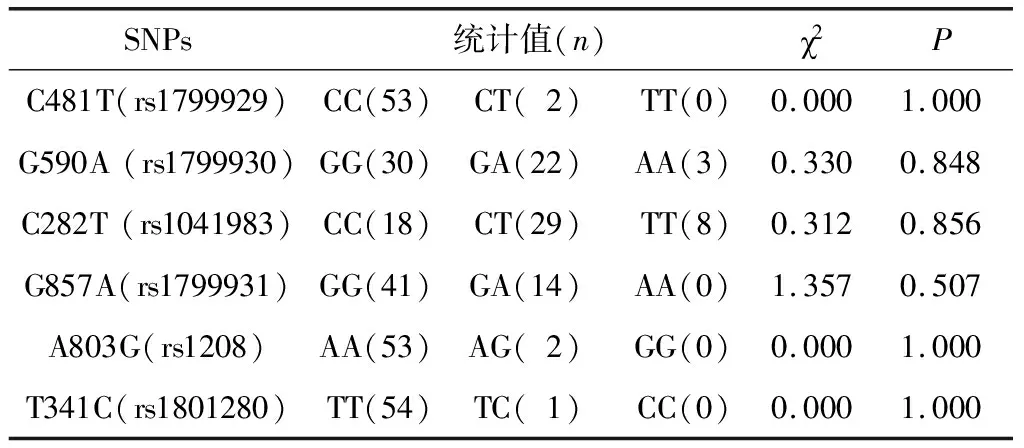
表3 患者NAT2基因型Hardy-weinberg遗传平衡检验结果
2.4 方法学验证
2.4.1 精密度实验 对PZA、INH和RFP进行低、中、高浓度(PZA 4.0、20.0、160.0 mg/L;INH和RFP 1.0、5.0、40.0 mg/L)的精密度实验,批内、批间精密度CV值≤15%满足要求。
2.4.2 稳定性实验 对PZA、INH和RFP进行低、中、高浓度(PZA 4.0、20.0、160.0 mg/L;INH和RFP 1.0、5.0、40.0 mg/L)室温、-80 ℃的稳定性实验,PZA、INH和RFP在室温下存放2、4、8 h的相对偏差均<15%,各目标物在室温下可维持8 h的稳定性,三者在-80 ℃下3次冻融检测结果仍稳定。
2.5 3组NAT2基因型间血药浓度比较
NAT2基因型4*4组、4*5B组、4*6A组、4*7B组、6A*6A组及6A*7B组与PZA、INH、RFP血药浓度间相关系数比较,差异无统计学意义(P>0.05),不存在相关关系(表4)。
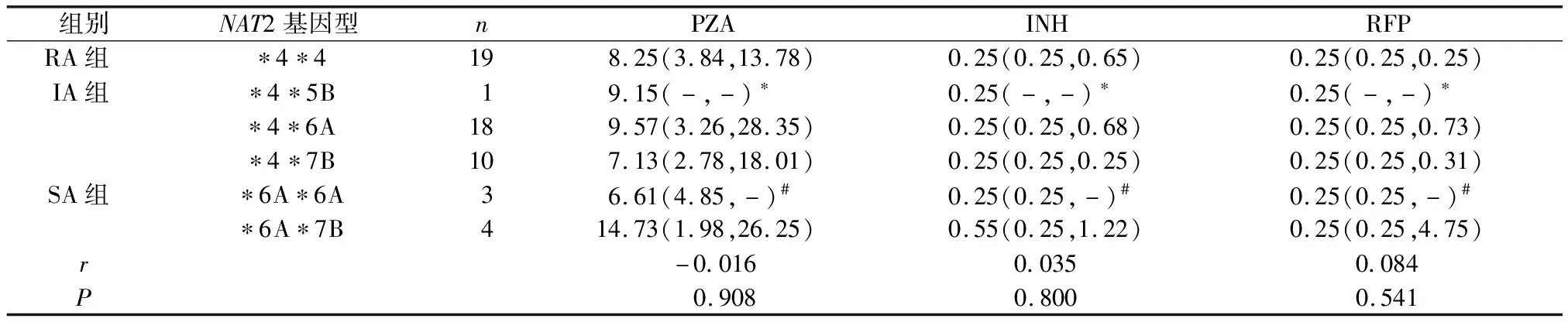
表4 3组NAT2基因型间血药浓度比较[mg/L,M(P25,P75)]
2.6 3组NAT2基因各乙酰化类型间血药浓度比较
NAT2基因不同乙酰化类型:RA组、IA组、SA组与PZA、INH、RFP血药浓度间相关系数比较,差异无统计学意义(P>0.05),不存在相关关系(表5)。

表5 3组NAT2基因不同乙酰化类型的血药浓度比较[mg/L,M(P25,P75)]
3 讨论
NAT2在肝脏中参与了INH、RFP等抗结核药物的代谢[16],其乙酰化作用是INH不同代谢途径中最重要的途径[17]。由于NAT2基因多态性造成的乙酰化能力不同,RA型较SA型转化INH为乙酰肼的速度更快,使具有肝毒性的乙酰肼不易蓄积,解毒效率增加,在SA型患者中乙酰肼生成无毒物质的过程可能受阻,最终生成具有肝脏损害作用的毒性物质[18],因而导致INH药代动力学的个体化差异。此外,研究[19-20]表明,RFP与INH联合用药时,虽用药时间越久药物疗效越高,但肝损伤发生率越高、造成的肝脏损害也越大。王金河等[21]研究表明,携带SA型基因型的结核患者在经INH和RFP治疗后发生肝功能异常的可能性更高。因此,RFP与INH合用所引发的肝脏毒性与NAT2基因多态性间密切相关。
目前,国内外已有关于NAT2基因多态性与抗结核药物血药浓度及AT-DILI关系的研究。刘诚诚等[22]研究表明,相对于RA型和IA型,SA型INH浓度最高,且易导致患者发生肝损伤。许飞虹[23]报道,RA型和SA型患者INH药物血浆浓度差异有统计学意义(P<0.05)。Singh等[24]报道55例印度结核病患者服用INH 1、2 h后的药物血浆浓度结果显示,RA型、IA型和SA型之间血浆浓度差异有统计学意义(P<0.05)。上述研究说明NAT2基因型与INH血药浓度具有一定相关性。Chen等[25]采用反向斑点杂交法测定NAT2基因型,柱前衍生化高效液相色谱法检测药物血药浓度实验结果显示,NAT2基因RA型、IA型与SA型PZA、INH和RFP血药浓度比较,差异无统计学意义(P>0.05),暂不能说明二者具有相关性。导致上述结论不一致的原因可能有:研究所针对的群体不同。研究[26-27]表明,NAT2基因多态性在不同民族、种族间分布有明显差异,患者所采用的抗结核治疗方案有所差异,研究对象纳、排标准存在差异等。
本研究采用荧光定量PCR探针法测定NAT2基因的基因型,应用UPLC-MS/MS法测定患者的抗结核药物血药浓度。数据分析显示,NAT2基因RA型、IA型、SA型与INH血药浓度间相关关系比较,差异无统计学意义(P>0.05),这一结果与国内外大多数研究结论不一致,但仍有研究结论与本研究结论一致,因此二者有无关联性的结论仍需进一步深入研究。此外,3种基因型间RFP、PZA的血药浓度比较差异无统计学意义(P>0.05),推测NAT2基因多态性并非RFP和PZA血药浓度的主要影响因素。但本研究存在一定局限性:1)样本量太少,这可能是造成研究结果出现偏差的主要原因;2)药物血药浓度的变化受多个因素的影响,但本研究仅探讨了NAT2基因多态性与INH、RFP和PZA血药浓度的单因素;3)藏族群体样本量不足,无法进行不同民族间的研究。因此,在后续的研究中应进一步扩大样本量,对不同民族、种族及更多的药物血药浓度影响因素,如患者体重、年龄、白蛋白水平和并发症等[28-29]进行讨论,使研究更加科学、有效。
综上所述,本研究结果表明,NAT2基因多态性与INH、RFP和PZA可能均不存在直接关联。因此,关于NAT2基因型与结核患者标准治疗方案治疗后药物血药浓度的关系,尚需进一步研究探索,为肺结核患者的临床个体化用药治疗提供参考。
