3-苯甲酰基香豆素的合成及抗肿瘤活性研究
2022-06-15孙小雅王晓静
孙小雅,刘 腾,孙 捷,王晓静
(山东第一医科大学(山东省医学科学院) 药物研究所,山东 济南250000)
目前,癌症是全球第二大死亡原因[1],中国的新增癌症病例数和癌症死亡人数均居世界首位。癌症是由正常细胞的异常增殖引起的,大多数抗癌药物通过促进细胞凋亡[2-3]来杀死癌细胞。香豆素类化合物是一种具有苯并α-吡喃核的天然化合物,被广泛报道具有抗菌[4-5]、抗凝血[6]、抗炎[7]、抗氧化[8]等活性,近年来也逐渐发现其在抗肿瘤方面有活性[9-12],特别是对结肠癌、胃癌、乳腺癌、卵巢癌和非小细胞肺癌细胞[13-15],抗肿瘤活性较好。例如2018年,Guo等[16]设计合成了一个香豆素类化合物A(图1),发现A对Hela、SKOV3、A549、OVCA429、OVCA433、A2780、MDA-MB-231、MCF-7、KB 等细胞株都表现出较强的抗增殖活性,IC50值为0.5 ~ 143 nmol·L-1,它能够明显诱导A2780细胞早期凋亡,对细胞周期影响较小,具有显著的抗癌活性。2018年,Gomha课题组[17]设计合成了3-苯甲酰基香豆素B(图2),发现其对肝细胞癌(HepG2)细胞具有较好的抑制活性。
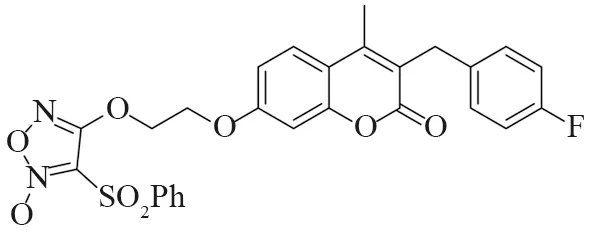
图1 化合物A的结构Fig.1 Structure of compound A
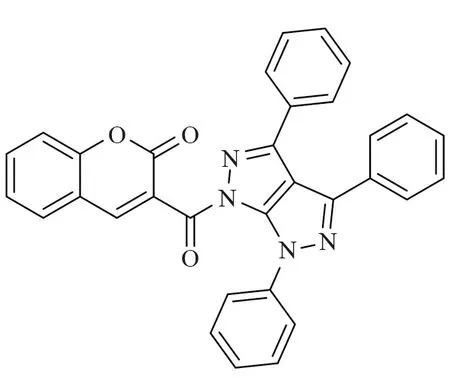
图2 化合物B的结构Fig.2 Structure of compound B
本文改进了课题组原有的合成3-苯甲酰基香豆素的合成方法[18],以4-甲基哌啶替代吡啶,与原方法相比,反应速度加快且更加符合绿色化学的要求,并采用MTT法对合成的化合物进行了抗癌活性研究。
1 实验部分
1.1 仪器与试剂
DF101S 型集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;旋转蒸发仪BUCHIR-200, 瑞士Bruker公司; 真空干燥箱DZF-6050,上海精宏实验设备有限公司; 循环水式多用真空泵,郑州长城科工贸有限公司;ZF-6型三用紫外线分析仪,上海嘉鹏科技有限公司;Bruker AM-600核磁共振仪,瑞士Bruker公司;DLZ-100多功能酶标仪,南京迪乐嘉生物科技有限公司。
4-氟苯甲醛,苯甲醛,5-羟基苯甲醛, 2-羟基-5-甲氧基苯甲醛,3-甲氧基苯甲醛,4-甲基苯甲醛,6-甲氧基苯甲醛,3,5-二叔丁基苯甲醛,3-氟苯甲醛, 4羟基苯甲醛, 3,4-二甲氧基苯甲酰乙酸乙酯,2,3,4,5-四氟苯甲酰乙酸乙酯,3-甲基苯甲酰乙酸乙酯,4-氟苯甲酰乙酸乙酯,2-氟苯甲酰乙酸乙酯,4-三氟甲基苯甲酰乙酸乙酯,甲醇,乙酸乙酯,石油醚,二氯甲烷。除非另有说明,所有溶剂和试剂均可在市场上获得,使用时无需进一步纯化。
1.2 步骤
化合物1-21的合成路线如图3所示,所合成的化合物如表1所示:其中化合物1、2、5、7、9、10、11、12、13、15、16、17、18、19、20等15个化合物均为新化合物。
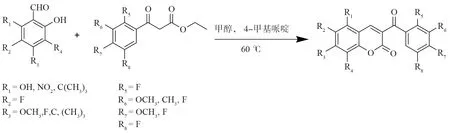
图3 3-苯甲酰基香豆素衍生物的合成反应式Fig.3 General synthetic route of 3-benzoylcoumarin derivatives
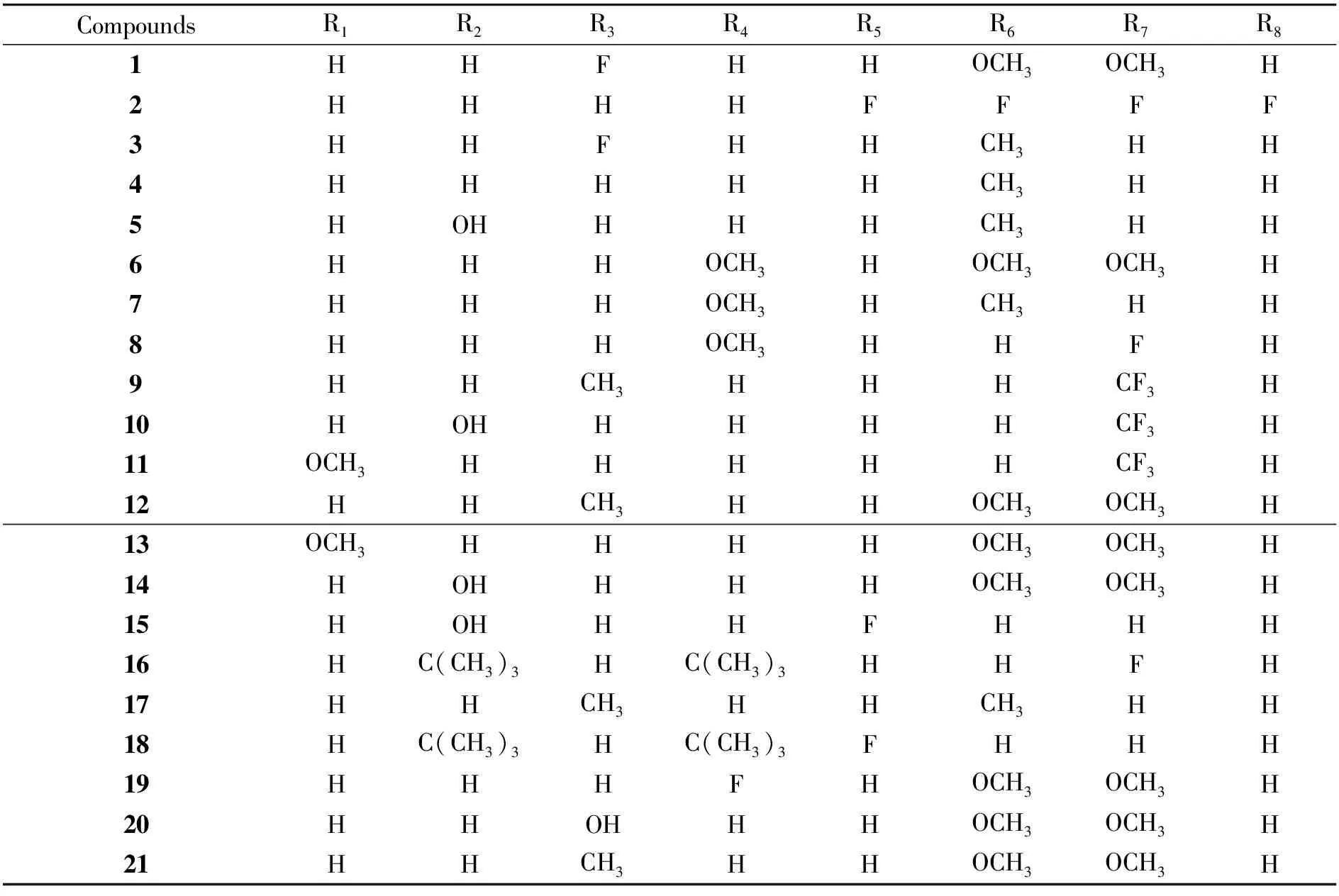
表1 3-苯甲酰基香豆素衍生物
1.2.1 目标化合物1-21的合成
以3-(3′,4′-二甲氧基苯甲酰基)-7-氟香豆素(化合物1)的合成为例:100 mL的三口反应瓶中,加入1.4 g (10 mmol) 4-氟水杨醛,2.52 g (10 mmol) 3 , 4-二甲氧基苯甲酰乙酸乙酯,30 mL甲醇,加2-3滴4-甲基哌啶作为催化剂,然后60 ℃加热回流搅拌2 h。TLC 监测反应进程,反应液倒在冰水中(100 mL)。固体析出,抽滤,用冷水冲洗几次,得粗品。粗产物用二氯甲烷或甲醇重结晶,真空干燥箱干燥。采用相同的方法得到化合物2-21。
3-(3′,4′-二甲氧基苯甲酰基)-7-氟香豆素(1): 淡黄色固体, 产率: 85.36%;1H NMR (600 MHz, DMSO-d6)δ8.33 (s, 1H), 7.91 (dd,J= 8.7, 6.3 Hz, 1H), 7.57 (dd,J= 8.4, 2.0 Hz, 1H), 7.48 (dt,J= 4.8, 2.6 Hz, 2H), 7.32 (td,J= 8.7, 2.5 Hz, 1H), 7.06 (d,J= 8.5 Hz, 1H), 3.84 (d,J= 28.0 Hz, 6H);13C NMR (150 MHz, DMSO-d6)δ189.64 (s), 164.52 (s), 157.61 (s), 155.24 (s), 153.91 (s), 148.75 (s), 145.75 (s), 131.64 (s), 131.57 (s), 128.67 (s), 125.40 (s), 115.35 (s), 112.78 (s), 112.62 (s), 111.04 (s), 103.9 (s), 55.8 (s), 55.64 (s); MS:m/z:[M+H]+329.080 6 [M+Na]+351.062 7。
3-(2′,3′,4′,5′-四氟苯甲酰基)-香豆素(2): 淡黄色固体,产率: 63.98%;1H NMR (600 MHz, DMSO-d6)δ8.69 (s, 1H), 7.96 (dd,J= 7.7, 1.4 Hz, 1H), 7.92~7.83 (m, 1H), 7.83~7.74 (m, 1H), 7.51 (d,J= 8.4 Hz, 1H), 7.49~7.42 (m, 1H);13C NMR (150 MHz, DMSO-d6)δ185.07 (s), 157.64 (s), 154.51 (s), 148.27 (s) ,134.75 (s) , 130.6 (s) , 125.4 (s) , 124.84 (s) , 118.03 (s) , 116.31 (s) , 112.48 (s), 112.34 (s);MS:m/z:[M+H]+323.029 1 [M+Na]+345.009 9。
3-(3′-甲基苯甲酰基)-7-氟香豆素(3): 淡黄色固体,产率: 85.82%;1H NMR (600 MHz, DMSO-d6)δ8.40 (s, 1H), 7.94 (dd,J= 8.7, 6.4 Hz, 1H), 7.76~7.69 (m, 2H), 7.52~7.46 (m, 2H), 7.43 (t,J= 7.6 Hz, 1H), 7.32 (td,J= 8.7, 2.5 Hz, 1H), 2.38 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ191.49 (s), 163.83 (s), 157.56 (s), 144.59 (s), 138.11 (s), 136.05 (s), 134.38 (s), 131.87 (s), 131.80 (s), 129.68 (s), 128.47 (s), 126.65 (s), 125.21 (s), 115.3 (s), 112.76 (s), 103.93 (s), 20.61 (s); MS:m/z:[M+H]+283.046 2 [M+Na]+305.027 6.
3-(3′-甲基苯甲酰基)-香豆素(4) 淡黄色固体,产率: 83.3%;1H NMR (600 MHz, DMSO-d6)δ8.40 (s, 1H), 7.86 (dd,J= 7.7, 1.4 Hz, 1H), 7.77~7.72 (m, 3H), 7.52~7.48 (m, 2H), 7.45~7.41 (m, 2H), 2.38 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ191.68 (s), 157.87 (s), 154.04 (s), 144.84 (s), 138.14 (s), 136.07 (s), 134.42 (s), 133.38 (s), 129.69 (s), 129.65 (s), 128.51 (s), 126.66 (s), 126.49 (s), 124.76 (s), 118.18 (s), 116.23 (s), 20.62 (s); MS:m/z:[M+H]+265.057 9 [M+Na]+287.039 2。
3-(3′-甲基苯甲酰基)-6-羟基香豆素(5) 淡黄色固体,产率: 81.43%;1H NMR (600 MHz, DMSO-d6)δ9.85 (s, 1H), 8.30 (s, 1H), 7.76~7.65 (m, 2H), 7.50 (d,J= 7.5 Hz, 1H), 7.43 (d,J= 7.6 Hz, 1H), 7.36~7.30 (m, 1H), 7.19~7.12 (m, 2H), 2.37 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ192.02 (s), 158.26 (s), 154.09 (s), 147.51 (s), 144.78 (s), 138.24 (s), 136.22 (s), 134.51 (s), 129.75 (s), 128.63 (s), 126.74 (s), 126.66 (s), 121.60 (s), 118.76 (s), 117.25 (s), 113.52 (s), 20.75 (s); MS:m/z:[M+H]+281.051 4 [M+Na]+303.033 7。
3-(3′,4′-二甲氧基苯甲酰基)-8-甲氧基香豆素(6) 淡黄色固体,产率: 87.05%;1H NMR (600 MHz, DMSO-d6)δ8.31 (s, 1H), 7.56 (dd,J= 8.4, 2.0 Hz, 1H), 7.48 (d,J= 2.0 Hz, 1H), 7.43~7.40 (m, 1H), 7.39~7.34 (m, 2H), 7.07 (d,J= 8.5 Hz, 1H), 3.95 (s, 3H), 3.85 (d,J= 28.6 Hz, 6H);13C NMR (150 MHz, DMSO-d6)δ189.86 (s), 157.65 (s), 153.93 (s), 148.76 (s), 146.41 (s), 144.24 (s), 143.31 (s), 128.66 (s), 126.91 (s), 125.38 (s), 124.66 (s), 120.54 (s), 118.78 (s), 115.44 (s), 111.16 (s), 110.90 (s), 56.18 (s), 55.82 (s), 55.65 (s); MS:m/z:[M+H]+341.034 5 [M+Na]+363.015 5。
3-(3′-甲基苯甲酰基)-8-甲氧基香豆素(7) 淡黄色固体,产率: 88.44%;1H NMR (600 MHz, DMSO-d6)δ8.37 (s, 1H), 7.78~7.68 (m, 2H), 7.51 (d,J= 7.5 Hz, 1H), 7.44~7.33 (m, 4H), 3.95 (s, 3H), 2.37 (s, 3H)。13C NMR (150 MHz, DMSO-d6)δ191.71 (s), 157.61 (s), 146.40 (s), 145.05 (s), 143.44 (s), 138.14 (s), 136.04 (s), 134.43 (s), 129.71 (s), 128.51 (s), 126.67 (s), 126.62 (s), 124.69 (s), 120.69 (s), 118.72 (s), 115.64 (s), 56.17 (s), 20.61 (s); MS:m/z:[M+H]+295.065 3 [M+Na]+317.047 8。
3-(4′-氟苯甲酰基)-8-甲氧基香豆素(8) 淡黄色固体,产率: 79.86%;1H NMR (600 MHz, DMSO-d6)δ8.40 (s, 1H), 8.03 (dd,J= 8.6, 5.6 Hz, 2H), 7.43~7.34 (m, 5H), 3.95 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ190.17 (s), 166.18 (s), 164.50 (s), 157.63 (s), 146.40 (s), 145.51 (s), 143.52 (s), 132.51 (s), 132.45 (s), 126.3 (s), 124.7 (s), 120.74 (s), 118.71 (s), 115.79 (s), 115.76 (s), 115.51 (s), 56.19 (s); MS:m/z:[M+H]+299.041 0 [M+Na]+321.022 1。
3-(4′-(3-氟甲基)苯甲酰基)-7-甲基香豆素(9) 淡黄色固体,产率: 85.12%;1H NMR (600 MHz, DMSO-d6)δ8.51 (s, 1H), 8.10 (d,J= 8.1 Hz, 2H), 7.90 (d,J= 8.2 Hz, 2H), 7.79 (d,J= 7.9 Hz, 1H), 7.37~7.25 (m, 2H), 2.48 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ191.05 (s), 157.99 (s), 154.51 (s), 146.95 (s), 145.44 (s), 139.87 (s), 129.88 (s), 129.73 (s), 126.00 (s), 125.43 (s), 125.41 (s), 124.06 (s), 116.27 (s), 115.77 (s), 21.34 (s);MS:m/z:[M+H]+333.037 7 [M+Na]+355.019 6。
3-(4′-(3-氟甲基)苯甲酰基)-6-羟基香豆素(10) 淡黄色固体, 产率: 88.8%;1H NMR (600 MHz, DMSO-d6)δ9.90 (s, 1H), 8.46 (s, 1H), 8.10 (d,J= 8.1 Hz, 2H), 7.89 (d,J= 8.3 Hz, 2H), 7.35 (d,J= 8.8 Hz, 1H), 7.19 (d,J= 3.3 Hz, 2H);13CNMR (150 MHz, DMSO-d6)δ191.22 (s), 158.15 (s), 154.04 (s), 147.75 (s), 146.59 (s), 139.71 (s), 129.95 (s), 125.56 (s), 125.48 (s), 122.11 (s), 118.63 (s), 117.20 (s), 113.66 (s); MS:m/z:[M+H]+335.020 0 [M+Na]+357.000 9。
3-(4′-(3-氟甲基)苯甲酰基)-5-甲氧基香豆素(11) 淡黄色固体,产率: 75.6%;1H NMR (600 MHz, DMSO-d6)δ8.47 (s, 1H), 8.08 (d,J= 8.1 Hz, 2H), 7.89 (d,J= 8.2 Hz, 2H), 7.72 (d,J= 1.0 Hz, 1H), 7.08~7.02 (m, 2H), 3.96 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ190.96 (s), 157.76 (s), 155.28 (s), 141.31 (s), 139.99 (s), 135.33 (s), 129.88 (s), 125.4 (s), 125.38 (s), 124.57 (s), 123.48 (s), 108.51 (s), 108.42 (s), 106.41 (s), 56.47 (s); MS:m/z:[M+H]+349.033 3 [M+Na]+371.015 7。
3-(3′,4′-二甲氧基苯甲酰基)-7-甲基香豆素(12) 淡黄色固体,产率: 90.1%;1H NMR (600 MHz, DMSO-d6)δ8.29 (s, 1H), 7.72 (d,J= 7.9 Hz, 1H), 7.53 (dd,J= 8.4, 2.0 Hz, 1H), 7.47 (d,J= 2.0 Hz, 1H), 7.32 (s, 1H), 7.25 (dd,J= 7.9, 0.7 Hz, 1H), 7.06 (d,J= 8.5 Hz, 1H), 3.86 (s, 3H), 3.82 (s, 3H), 2.46 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ189.94 (s), 158.05 (s), 154.07 (s), 153.82 (s), 148.73 (s), 144.42 (s), 144.21 (s), 129.18 (s), 125.85 (s), 125.46 (s), 125.28 (s), 116.25 (s), 115.82 (s), 111.14 (s), 110.85 (s), 55.80 (s), 55.62 (s), 21.28 (s); MS:m/z:[M+H]+325.074 5 [M+Na]+347.056 9。
3-(3′,4′-二甲氧基苯甲酰基)-5-甲氧基香豆素(13) 淡黄色固体,产率: 89.3%;1H NMR (600 MHz, DMSO-d6)δ8.23 (s, 1H), 7.68 (t,J= 8.4 Hz, 1H), 7.53 (dd,J= 8.4, 2.0 Hz, 1H), 7.46 (d,J= 2.0 Hz, 1H), 7.06 (d,J= 8.4 Hz, 2H), 7.01 (d,J= 8.3 Hz, 1H), 3.93 (s, 3H), 3.87 (s, 3H), 3.82 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ189.83 (s), 157.73 (s), 156.66 (s), 154.88 (s), 153.78 (s), 148.71 (s), 138.66 (s), 134.42 (s), 128.87 (s), 125.25 (s), 124.88 (s), 111.22 (s), 110.82 (s), 108.41 (s), 106.30 (s), 56.41 (s), 55.79 (s), 55.64 (s); MS:m/z:[M+H]+341.067 4 [M+Na]+363.050 2。
3-(3′,4′-二甲氧基苯甲酰基)-6-羟基香豆素(14) 淡黄色固体,产率: 78.77%;1H NMR (600 MHz, DMSO-d6)δ9.84 (s, 1H), 8.23 (s, 1H), 7.52 (dd,J= 8.4, 2.0 Hz, 1H), 7.47 (d,J= 1.8 Hz, 1H), 7.38~7.26 (m, 1H), 7.21~7.08 (m, 2H), 7.06 (d,J= 8.5 Hz, 1H), 3.86 (s, 3H), 3.82 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ190.05 (s), 158.19 (s), 153.95 (s), 153.89 (s), 148.77 (s), 147.26 (s), 143.84 (s), 128.72 (s), 126.77 (s), 125.37 (s), 121.21 (s), 118.7 (s), 117.11 (s), 113.27 (s), 111.06 (s), 110.88 (s), 55.81 (s), 55.63 (s); MS:m/z:[M+H]+327.054 9 [M+Na]+349.036 0。
3-(2′-氟苯甲酰基)-6-羟基香豆素(15) 淡黄色固体,产率: 83.1%;1H NMR (600 MHz, DMSO-d6)δ9.93 (s, 1H), 8.50 (s, 1H), 7.79 (td,J= 7.6, 1.7 Hz, 1H), 7.69 (dt,J= 7.3, 5.6 Hz, 1H), 7.56~7.24 (m, 3H), 7.26~6.95 (m, 2H);13C NMR (150 MHz, DMSO-d6)δ188.76 (s), 160.29 (s), 159.66 (s), 154.66 (s), 148.22 (s), 146.58 (s), 135.64 (s), 135.58 (s), 131.12 (s), 127.35 (s), 125.33 (s), 122.93 (s), 117.76 (s), 116.78 (s), 116.63 (s), 114.48 (s); MS:m/z:[M+H]+285.026 8 [M+Na]+307.008 4。
3-(4′-氟苯甲酰基)-6,8-二叔丁基香豆素(16) 淡黄色固体,产率: 62.53%;1H NMR (600 MHz, DMSO-d6)δ8.40 (s, 1H), 8.07~8.00 (m, 2H), 7.74 (d,J= 2.3 Hz, 1H), 7.66 (d,J= 2.3 Hz, 1H), 7.38 (t,J= 8.8 Hz, 2H), 1.49 (s, 9H), 1.33 (s, 9H);13C NMR (150 MHz, DMSO-d6)δ190.18 (s), 166.13 (s), 164.46 (s), 157.54 (s), 150.82 (s), 146.73 (s), 146.51 (s), 136.11 (s), 132.86 (s), 132.85 (s), 132.56 (s), 132.50 (s), 128.07 (s), 124.89 (s), 124.49 (s), 118.10 (s), 115.78 (s), 115.63 (s), 34.58 (s), 34.35 (s), 30.94 (s), 29.53 (s); MS:m/z:[M+H]+381.147 0 [M+Na]+403.132 7。
3-(3′-甲基苯甲酰基)-7-甲基香豆素(17) 淡黄色固体,产率: 77.69%.1H NMR (600 MHz, DMSO-d6)δ8.35 (s, 1H), 7.73 (d,J= 8.0 Hz, 2H), 7.69 (d,J= 7.7 Hz, 1H), 7.50 (d,J= 7.6 Hz, 1H), 7.42 (t,J= 7.6 Hz, 1H), 7.33 (s, 1H), 7.26 (d,J= 7.9 Hz, 1H), 2.46 (s, 3H), 2.37 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ191.81 (s), 158.03 (s), 154.23 (s), 145.11 (s), 134.32 (s), 129.63 (s), 129.40 (s), 128.49 (s), 126.63 (s), 125.92 (s), 116.28 (s), 115.79 (s), 21.32 (s), 20.65 (s); MS:m/z:[M+H]+279.072 1 [M+Na]+301.054 0。
3-(2′-氟苯甲酰基)-6,8-二叔丁基香豆素(18) 淡黄色固体,产率: 64.21%;1H NMR (600 MHz, DMSO-d6)δ8.57 (s, 1H), 7.84 (d,J= 2.3 Hz, 1H), 7.79 (d,J= 1.7 Hz, 1H), 7.69 (dd,J= 10.1, 5.2 Hz, 2H), 7.41~7.31 (m, 2H), 1.47 (s, 9H), 1.34 (s, 9H);13C NMR (150 MHz, DMSO-d6)δ188.59 (s), 161.90 (s), 158.00 (s), 151.59 (s), 148.27 (s), 147.33 (s), 136.72 (s), 135.47 (s), 131.14 (s), 129.38 (s), 125.97 (s), 125.74 (s), 125.36 (s), 118.69 (s), 116.81 (s), 116.66 (s), 35.17 (s), 34.98 (s), 31.50 (s); MS:m/z:[M+H]+381.072 1 [M+Na]+403.034 4。
3-(3′,4′-二甲氧基苯甲酰基)-8-氟香豆素(19) 淡黄色固体,产率:92.68%;1H NMR (600 MHz, DMSO-d6)δ8.36 (d, J = 0.8 Hz, 1H), 7.70~7.63 (m, 2H), 7.61 (dd,J= 8.4, 2.0 Hz, 1H), 7.50 (d,J= 2.0 Hz, 1H), 7.43~7.38 (m, 1H), 7.07 (d,J= 8.5 Hz, 1H), 3.87 (s, 3H), 3.83 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ189.48 (s), 156.81 (s), 154.05 (s), 148.79 (s), 147.45 (s), 143.48 (s), 143.47 (s), 128.49 (s), 127.62 (s), 125.55 (s), 124.91 (s), 124.76 (s), 119.04 (s), 110.89 (s), 55.84 (s), 55.68 (s); MS:m/z:[M+H]+329.050 3[M+Na]+351.032 3。
3-(3′,4′-二甲氧基苯甲酰基)-7-羟基香豆素(20) 淡黄色固体,产率: 84.66%;1H NMR (600 MHz, DMSO-d6)δ10.88 (s, 1H), 8.24 (s, 1H), 7.68 (d,J= 8.6 Hz, 1H), 7.49 (dd,J= 8.4, 2.0 Hz, 1H), 7.44 (d,J= 2.0 Hz, 1H), 7.06 (d,J= 8.5 Hz, 1H), 6.86 (dd,J= 8.5, 2.3 Hz, 1H), 6.79 (d,J= 2.2 Hz, 1H), 3.84 (d,J= 27.8 Hz, 6H);13C NMR (150 MHz, DMSO-d6)δ190.14 (s), 162.81 (s), 158.26 (s), 156.25 (s), 153.52 (s), 148.61 (s), 145.34 (s), 131.15 (s), 129.18 (s), 124.93 (s), 121.67 (s), 113.67 (s), 111.29 (s), 110.77 (s), 110.66 (s), 101.98 (s), 55.74 (s), 55.58 (s); MS:m/z:[M+H]+327.055 8 [M+Na]+349.037 4。
3-(3′,4′-二甲氧基苯甲酰基)-6-甲基香豆素(21) 淡黄色固体,产率: 83.33%;1H NMR (600 MHz, DMSO-d6)δ8.25 (s, 1H), 7.62 (s, 1H), 7.54 (dd,J= 8.4, 1.8 Hz, 2H), 7.47 (d,J= 2.0 Hz, 1H), 7.39 (d,J= 8.5 Hz, 1H), 7.06 (d,J= 8.5 Hz, 1H), 3.30 (s, 6H), 2.39 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ189.90 (s), 158.05 (s), 153.91 (s), 152.06 (s), 148.77 (s), 143.89 (s), 134.05 (s), 134.02 (s), 128.99 (s), 128.68 (s), 126.65 (s), 125.39 (s), 117.94 (s), 116.00 (s), 110.87 (s), 55.82 (s), 55.64 (s), 20.12 (s); MS:m/z:[M+H]+325.074 4 [M+Na]+347.056 7。
1.3 抗癌活性测定
1.3.1 MTT法测试化合物的细胞毒性
MTT法[19]的检测原理是活细胞线粒体中的琥珀酸脱氢酶能将外源的MTT还原为不溶于水的蓝紫色结晶甲瓒并沉积在细胞内,而死细胞则没有这种功能。二甲基亚砜(DMSO)能将蓝紫色结晶甲瓒溶解,用酶标仪在490 nm波长下测定其吸光度值(OD值),可间接反映活细胞数量。OD值越大,细胞活力越强,毒性越低。
选取H1299细胞进行抗癌活性实验,实验过程如下:收集贴壁细胞,调整细胞悬液浓度,96孔板,每孔加100 μL 细胞悬液,铺板使每孔中待测细胞密度为7 000个左右。前一天晚上铺板,次日上午加化合物,化合物设置6个浓度梯度,3个重复孔。加完药后,将96孔板放入细胞培养箱中培养48 h。48 h后,取出96孔板,每孔加入10 μL MTT,加完后用锡纸包好孔板避光,放入培养箱中继续培养4 h。4 h后,取出96孔板,用1 mL注射器将板中上层液体吸出,过程中尽量避免吸掉底部结晶。然后每孔加入150 μL DMSO,酶标仪中低速振荡10 min使晶体充分溶解。在酶标仪490 nm处测量各孔OD值,根据公式计算细胞存活率。
细胞存活率(%)=A1/A2×100%,其中A1为样本组OD值,A2为空白组OD值。
1.3.2 急性毒性试验
根据细胞水平的测定结果,对化合物2、8、15进行小鼠体内的急性毒性测试。根据Myran的研究方法[20],并选定KM小鼠进行实验(老鼠从济南朋悦实验动物养殖有限公司购买,执照号码:SCXK(陆)20190003)。在恒温室喂养小鼠,用含吐温-80的生理盐水制备化合物2、8、15,吐温-80起到可溶性助溶作用。灌胃用药量为0.2 mL/10 g,实验分为1 000 mg/kg和2 000 mg/kg两个浓度组,每组小鼠5只,灌胃给药1次。24 h后观察小鼠行为模式的变化及死亡情况,连续观察7 d后处死小鼠。
2 结果与讨论
2.1 合成方法
本文以4-甲基哌啶为催化剂,苯甲酰乙酸乙酯与取代水杨醛化合物在甲醇中反应,合成了21个取代3-苯甲酰基衍生物。与原方法相比,可将反应温度由80 ℃降至60 ℃,催化剂由哌啶改为4-甲基哌啶,反应时间由原来的4 h变为2 h,缩短了反应时间,使反应过程更加安全,更符合绿色化学的要求。
2.2 化合物对H1299细胞的细胞毒性
化合物对非小细胞肺癌细胞(H1299)的细胞毒性及形态改变如图4所示。以常用的抗肿瘤药物拓扑替康(Topotecan,TPT)作为对照药物,MTT法测定对照品和化合物的生物活性, IC50值如表2所示。抗癌实验结果表明,化合物2、8和15对H1299细胞系表现出明显的抗增殖活性,其中化合物2的抗癌活性比TPT还要好。
为了确定化合物2、8、15对非小细胞肺癌细胞的细胞毒性,我们用不同浓度的化合物2、8、15处理H1299细胞。由表2可以看出,阳性药物拓扑替康作用于H1299细胞时,IC50值为(16.053±0.750) μmol·L-1,而化合物2的IC50值为(9.151±0.669) μmol·L-1,小于拓扑替康,表现出比拓扑替康更好的抗癌作用。其中化合物8和15的药效略低于阳性药物。MTT结果显示,该化合物在测试范围内呈剂量依赖性,显著降低了细胞活力(图5)。此外,显微镜下的形态学分析也证实了类似的结果。向细胞中加入化合物共同作用后,观察到明显的细胞形态的改变,包括细胞收缩、破裂、数量减少(图4)。综上所述,化合物对H1299细胞具有明显的生长抑制和形态变化,表明化合物2、8和15具有细胞毒性。
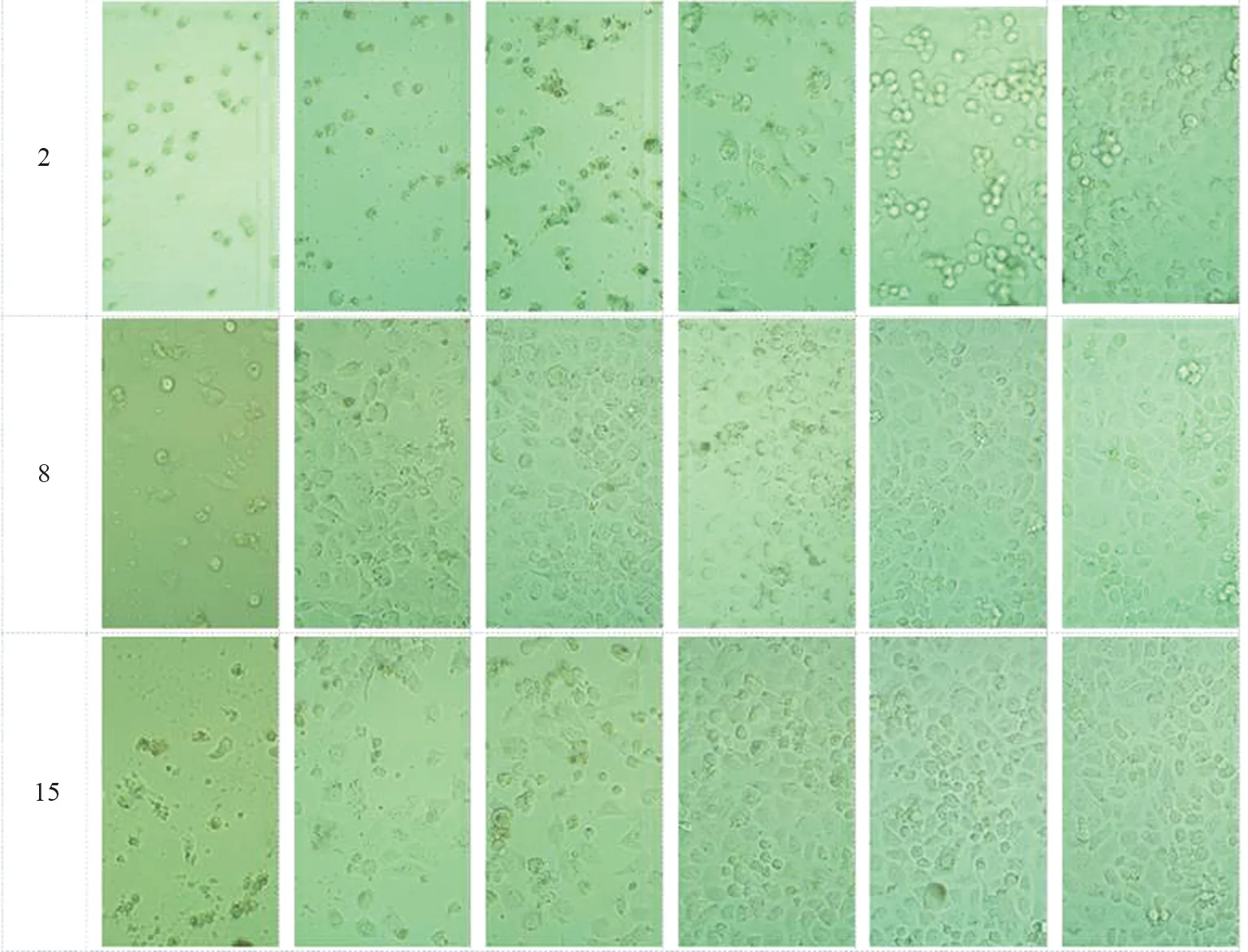
图4 不同浓度的化合物2、8和15处理H1299细胞48 h后的细胞状态图(从左到右的浓度分别为50、25、12.5、6.25、3.125、1.56 μmol·L-1)Fig.4 Cell state diagram of H1299 cells treated with different concentrations of compounds 2, 8 and 15 for 48 h (the concentrations from left to right are 50,25,12.5,6.25,3.125,1.56 μmol·L-1)

表2 化合物2、8、15 和TPT在H1299细胞中的IC50测定
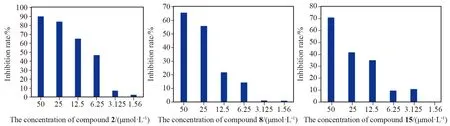
图5 化合物2、8、15 在不同浓度下的抑制率(*P<0.05,**P<0.01)Fig.5 Inhibition rates of compound 2,8,15 at different concentrations (*P<0.05,**P<0.01)
2.3 急性毒性试验
根据细胞水平的活性评价结果,参照Myran等[18]的研究方法,对化合物2、8、15进行小鼠急性毒性试验。给药后观察小鼠的情况,结果如表3所示,小鼠活动正常,食欲无明显变化,精神状态良好,大小便无异常,体重未下降,未出现死亡。与对照组比较,无显著性差异,小鼠未发生死亡及异常反应,说明短期内口服该化合物是安全的,无明显急性毒副作用。
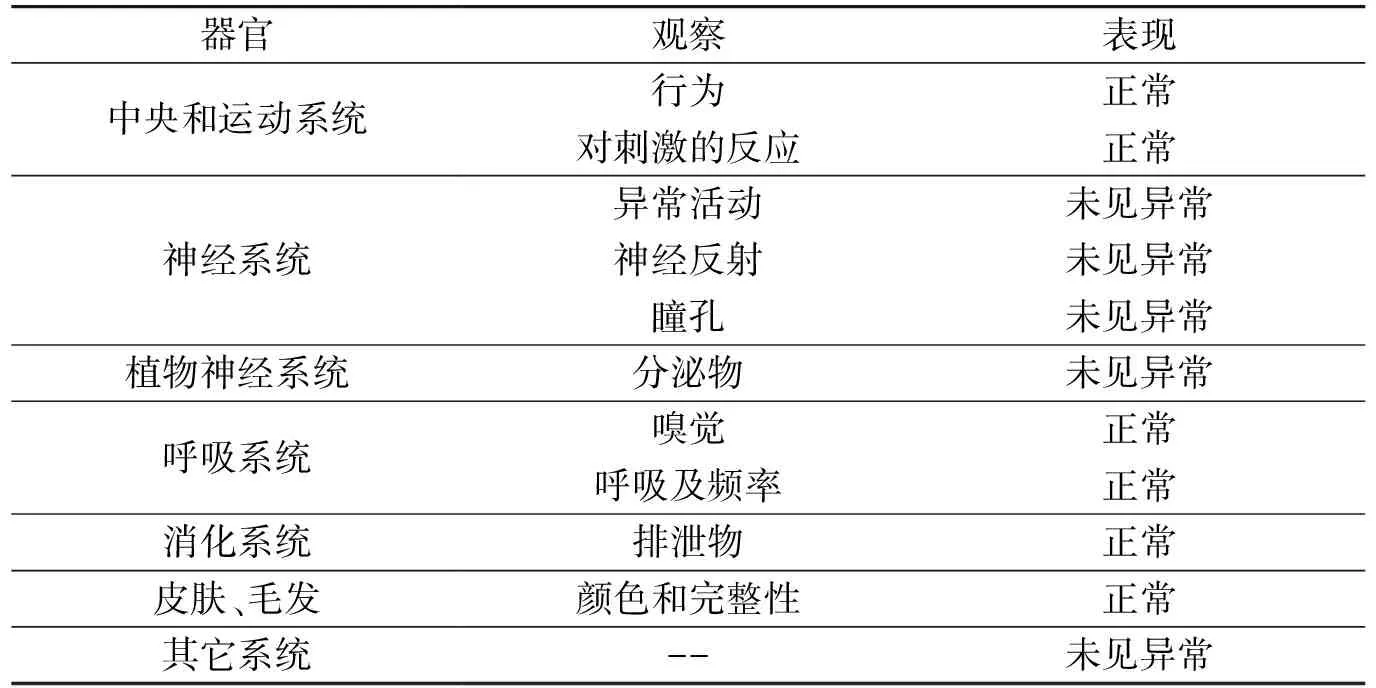
表3 小鼠灌胃给药后行为模式的改变
2.4 ADMET性能分析
通过细胞试验筛选出3个活性较好的化合物2、8、15,采用ADMET预测综合分析化合物的HIA、BBB、PPB、CYP2D6、溶解度和肝毒性,分析结果如图6、表4所示。HIA分析表明,2、8和15均具有良好的吸附能力(HIA= 0), BBB渗透性分析发现,3种化合物均具有良好的渗透性。PPB参数表明,这些化合物都不能与血液中的载体蛋白高度结合,游离状态下的化合物具有更好的生物利用度。根据细胞色素P4502D6 (CYP2D6)结果分析,所有化合物均为CYP2D6酶的非抑制剂(得分< 0.161),表明化合物在肝脏中代谢良好。通过溶解度参数分析,四种化合物的溶解度均为2,具有良好的溶解度。在肝毒性方面,化合物几乎没有肝毒性。总的来说,化合物符合ADMET制备的相关要求,为进一步进行化合物体外毒性检测奠定了基础。
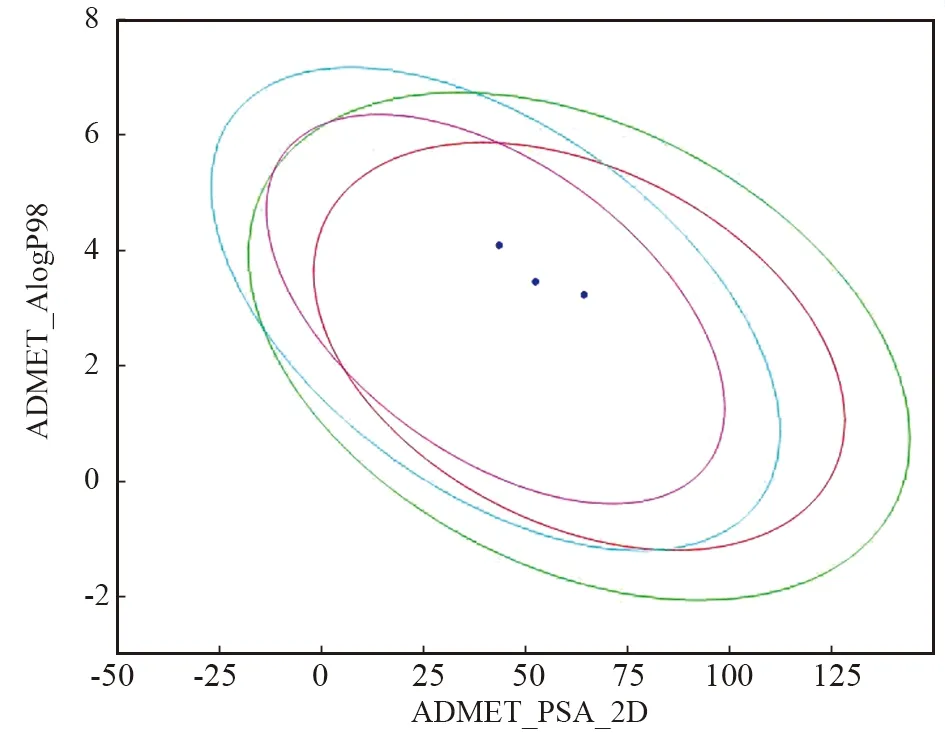
图6 四种化合物的肠吸收(HIA)和血脑屏障(BBB)特性预测(红色和绿色椭圆分别代表HIA的95%和99%的置信区间,紫红色和蓝色椭圆分别代表血脑屏障的95%和99%的置信区间,深蓝色的点是3种化合物)Fig.6 Prediction of intestinal absorption (HIA) and blood brain barrier (BBB) properties by four compounds(Red and green ellipses represent 95% and 99% confidence intervals of HIA, respectively; the amaranthand blue ellipses represent 95% and 99% confidence intervals of BBB, respectively; the dark blue dots are 3 compounds)
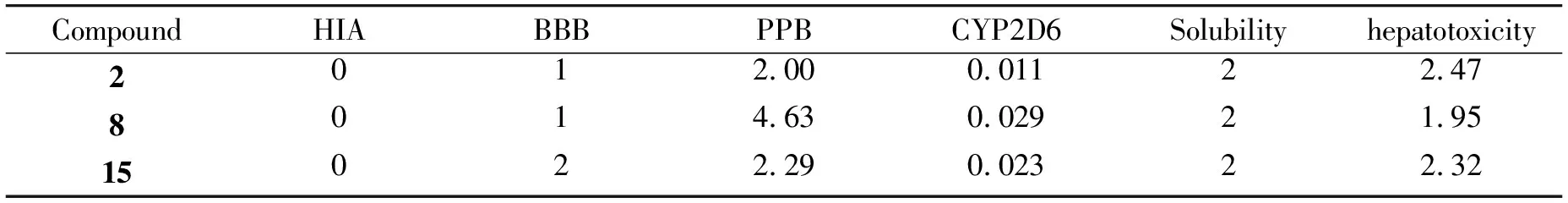
表4 3-苯甲酰基香豆素的ADMET性质
3 结论
合成了一系列3-苯甲酰基香豆素类化合物,并对其抗癌活性进行了评价。选择4-甲基哌啶作为催化剂,降低了反应温度,缩短了反应时间,使反应更符合绿色化学的要求。化合物2、8和15对H1299细胞系具有较强的广谱抗癌活性。其中,化合物2具有最佳的抗癌活性,IC50为(9.151±0.669) μmol·L-1,低于阳性药物TPT的IC50(16.053±0.750) μmol·L-1)。化合物8(IC50= (27.137±0.128) μmol·L-1)和15(IC50= (26.8±1.921) μmol·L-1)也表现出较好的抗癌活性。对小鼠的急性毒性试验结果表明,化合物对小鼠基本无毒。这些结果均表明,此类化合物是进一步开发强效抗癌药物的有希望的先导分子,为后续研究开发抗癌药物的新骨架结构提供一定的理论依据。
