2-溴丁酰氯与8-羟基喹诺酮在无水三氯化铝催化下的反应研究
2022-06-15段怡静蔡林林刘雨婷罗贵琴余镜瑶王启卫刘治国
段怡静,蔡林林,刘雨婷,罗贵琴,余镜瑶,钟 柳,王启卫,刘治国
(1. 西华大学 理学院,四川 成都 610039; 2. 小分子手性化学药物研究与应用宜宾市重点实验室,四川 宜宾 644002)
丙卡特罗化学名是5-(1-羟基-2-异丙胺基丁基)-8-羟基喹诺酮,结构如图1 所示,它的盐酸盐是目前治疗哮喘的有效药物之一。1976年,Nakagaza等报道了丙卡特罗的合成路线[1],其中5-(2-溴丁酰基)-8-羟基喹诺酮如图1的合成是工艺中的关键步骤,另外化合物3还是合成1-氢-2-羰基-5-(L-亮氨酸甲酯)-8-羟基-喹诺酮的中间体[2]。
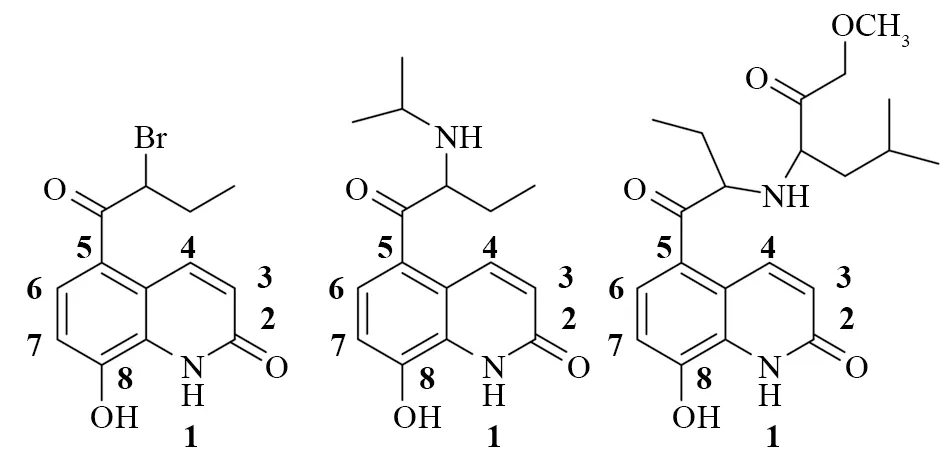
图1 丙卡特罗及其中间体的结构Fig.1 Structure of Procaterol and its intermediates
化合物3属于酚酮衍生物。酚酮通常采用酚与酰氯在无水三氯化铝等路易斯酸催化下经Friedel-Crafts反应制备[3-5],或酚与酰氯在碱性条件下(如在三乙胺、碳酸钾等)合成酚酯[6-7],然后酚酯在三氯化铝等路易斯酸催化下经Fries重排反应得到羟基芳酮。文献报道3的合成路线如图2所示,即2与1[1,8 ]或2′与1[9]在无水三氯化铝催化下经Friedel-Crafts反应合成。
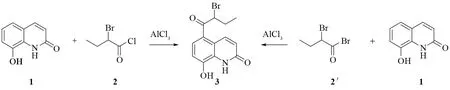
图2 5-(2-溴丁酰基)-8-羟基喹诺酮的合成路线Fig.2 Synthetic route of 5-(2-bromobuyl-8-hydroxyquinolone
由于2′价格较贵,稳定性差,因此作者选择2与1为原料合成3。研究发现在-10 ℃~40 ℃范围2与1几乎不能发生Friedel-Crafts反应,而主要是酯化反应,且伴有少量氯替代溴的酯化产物,得不到目标化合物3。大于40 ℃时,比如70 ℃时2与1发生了Friedel-Crafts反应,但同时发生了消除反应,也得不到目标化合物3。因此,本文采用核磁共振氢谱(1H NMR)和液质联用(LC-MS)研究了2与1在无水三氯化铝催化下的反应。为了验证在-10 ℃~40 ℃范围2与1在无水三氯化铝存在下主要是酯化反应,利用LC-MS将2与1在碳酸钾存在下进行的酯化反应产物与在三氯化铝存在下的反应产物进行了对比。
1 实验部分
1.1 仪器和试剂
安捷伦1100高效液相色谱仪;Bruker AVANCE 400核磁共振仪(DMSO-d6为溶剂,TMS为内标);T6新世纪紫外分光光度计;安捷伦1290 Infinity II/6470 Tripe Quad液质联用。
1.2 反应过程
于干燥反应瓶中依次加入1,2-二氯乙烷(40 mL)、1(3.22 g,20 mmol)、2(8.90 g,24 mmol)和无水三氯化铝(8.01 g,60 mmol),搅拌下于一定温度下反应3 h。将反应物缓慢加入冰水中猝灭,分液,水层用二氯甲烷(3×50 mL)萃取,合并有机层,常温下浓缩,残余物用冰甲醇洗涤,过滤,滤饼干燥得白色固体。
2 结果与讨论
2.1 反应温度对反应结果影响
按1.2反应过程,固定物料量不变,考察了反应温度-10、10、20、40和70 ℃对反应结果的影响,以高效液相色谱(HPLC)检测产物相对出峰面积大小作标准,针对性地分析相对含量较高的产物。HPLC检测条件:色谱柱类型为Inertsil ODS-3,柱尺寸为46×250 mm,4 μm,流动相包括A和B,A为水(含0.05 %三氟乙酸),B为乙腈,检测波长为259 nm,流速为1.0 mL/min,色谱柱温度是30 ℃,洗脱时间(min)0、10、15、16、25、26和35,B泵的比例(%)分别为20、60、60、70、70、20和20。主要产物出峰时间与相对含量如表1所示。

表1 反应温度对反应结果的影响
表1所示,在40 ℃以下甚至于-10 ℃时,1和2在无水三氯化铝存在下能顺利反应,生成的产物中主次较分明,主产物出峰时间为9.8 min。40 ℃以上时产物较复杂,70 ℃时9.8 min处的产物基本消失,而分别于12.6 min和16.5 min出现两个面积相对较大的峰。下面分别对出峰时间分别为9.8、12.6和16.5 min的产物进行分析。
2.2 低温下反应主要产物的结构分析
将40 ℃以下反应得到的主要产物(出峰时间9.8 min)进行分离纯化,采用1H NMR分析其结构。1H NMR (DMSO-d6):δ11.66 (s,1H),7.98-7.96 (d,J= 8.0 Hz,1H),7.62 (d,J= 8.0 Hz,1H),7.30-7.20 (m,2H),6.58-6.56 (d,J= 8.0 Hz,1H),4.98-4.93 (dd,J= 4.0 Hz,1H),2.31-1.93 (m,2H),1.10 (t,J= 8.0 Hz,3H)。产物δ在7.98-6.56之间共有5个不饱和C-H,这一结果与3的结构不一致,而与8-羟基喹诺酮的骨架相似,由此可以判断生成的主要是酯化产物8-(2-溴丁酰氧基)喹诺酮。
此外,在核磁谱图中,除了4.98~4.93处CHBr-中氢的化学位移外,于5.08处还有一信号较弱的峰,可能是1和2在无水三氯化铝存在下反应生成的主要杂质。为了分析这个杂质,对反应的产物进行了LC-MS分析,结果如图3所示。
从图3中可以看出,产物的LC-MS出峰时间分别为3.60和3.47 min。3.60 min时的组分,其[M+H]+的m/z为310.0,该峰与[M+2+H]+的m/z为312.0的峰几乎等高,可以判断该分子结构中含溴,结合核磁数据可以判定其结构为酯化物4(见图4)。出峰时间为3.47 min化合物的[M+H]+的m/z为266.0,该峰与m/z为267.9峰高之比接近3∶1,说明该组分结构中含氯,结合核磁图谱中化学位移为5.08处的峰,可判断生成了少量杂质5(见图4),即发生了氯和溴的交换反应。
为了验证上述推测,在碳酸钾催化下将2与1进行酯化反应(见图4),并将其产物与在三氯化铝存在下的反应产物进行了对比分析。直接酯化反应的产物的LC-MS结果与图3基本吻合,即生成了化合物4和5的混合物,且在碱性条件下生成了更多的氯替代物5。
2.3 高温反应产物的LC-MS分析
高于40 ℃时,1和2在无水三氯化铝催化下生成产物组分比较复杂。当反应升高到70 ℃时,HPLC分析表明产物中于9.8 min处的峰消失,分别在12.6和16.5 min出现两个相对含量较高的峰。对其进行LC-MS分析,结果如图5所示。
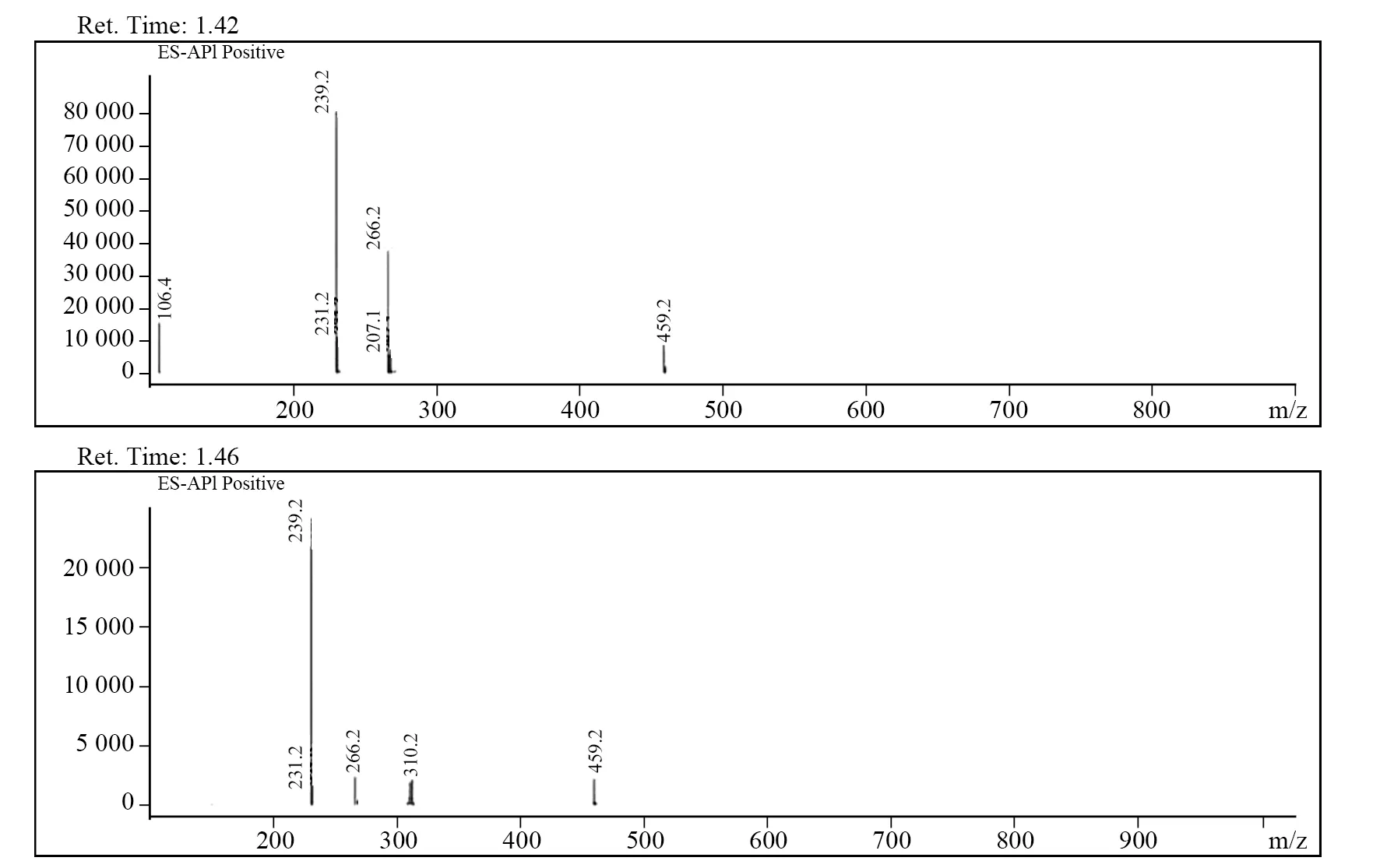
图5 70 ℃时1 和2 在三氯化铝催化下主要反应产物的LC-MSFig.5 LC-MS of main reaction products 1 and 2 catalyzed by aluminum trichloride at 70 ℃
从图5可以看出,两个化合物的[M+H]+都是230.2。从相对分子质量上判定应该是4消除卤化氢后的同分异构体,即1和2在无水三氯化铝催化下于高温时发生了Friedel-Crafts反应,并消除HBr或HCl,生成了6和7,其结构见图6。
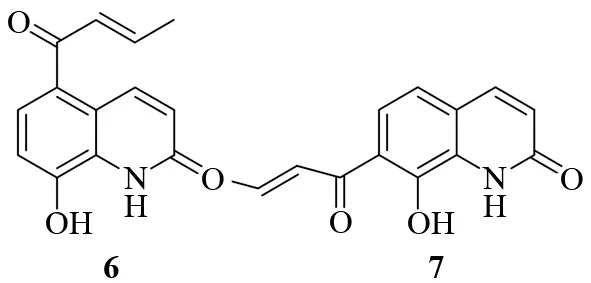
图6 70 ℃时1 和2 在三氯化铝催化下的反应产物Fig.6 Reaction products of 1 and 2 catalyzed by aluminum chloride at 70 ℃
3 结论
在无水三氯化铝存在下,2-溴丁酰氯与8-羟基喹诺酮于-10~40 ℃反应生成的产物主要是8-(2-溴丁酰氧基) 喹诺酮和少量的8-(2-氯丁酰氧基) 喹诺酮。在70 ℃反应时,2-溴丁酰氯与8-羟基喹诺酮在无水三氯化铝存在下发生了Friedel-Crafts反应,同时发生了消除一分子卤化氢的反应,主要是5-(2-丁烯酰基) 喹诺酮和7-(2-丁烯酰基) 喹诺酮的混合物。
