钩藤碱对人绒毛膜滋养层细胞增殖、迁移和侵袭的影响
2022-06-15肖艳平付久园王晓华葛永梅朱艳菊
肖艳平, 付久园, 王晓华, 葛永梅, 朱艳菊
(承德医学院附属医院,河北 承德 067000)
子痫前期是妊娠相关综合征,其特征在于妊娠20周后出现高血压和蛋白尿,影响约4%的妊娠,占全世界孕产妇死亡率的15%以上[1]。人胎盘滋养层细胞的正常增殖和迁移对于维持胎盘的正常功能极为重要[2]。研究发现,滋养细胞浸润和迁移不足会导致血管重塑受损和胎盘早期循环减少,从而导致妊娠20周后引起胎盘缺血,促进子痫前期的发生和进展[3]。因此,有效抑制滋养层细胞增殖、迁移和侵袭对子痫前期的临床治疗具有重要意义。目前治疗子痫前期的主要方法包括解痉、镇静,有指征的降压、利尿[4]。钩藤是茜草科钩藤属植物,以带钩的茎枝入药,具有清热、定惊和降压的功效,常用于治疗头痛眩晕、惊痫抽搐、妊娠子痫等[5-6]。目前研究显示,钩藤在重度子痫前期的临床治疗中能够明显减轻患者的症状,且疗效确切[7]。因此,本实验探究钩藤中有效活性成分钩藤碱对滋养层细胞增殖、迁移和侵袭的影响及其可能的机制。
1 材料与方法
1.1 细胞 人绒毛膜滋养层细胞HTR-8/SVneo购自美国模式培养物集存库。
1.2 试剂与药物 钩藤碱对照品(纯度≥98%,批号A0318)购自成都曼思特生物科技有限公司;RPMI-1640培养基购自美国Gibco公司;青霉素、链霉素购自美国Sigma公司;胎牛血清购自美国HyClone公司;CCK-8检测试剂购自江苏凯基生物技术股份有限公司;细胞周期检测试剂盒购自北京索莱宝科技有限公司;孔径为8 μm的Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司;Trizol试剂购自美国Invitrogen公司;逆转录试剂盒购自宝生物工程(大连)有限公司;SYBR Premix Ex Taq试剂盒购自日本TaKaRa公司;NF-κB p65、IκBα、p-IκBα抗体和HRP标记的二抗购自美国CST公司;BCA蛋白浓度检测试剂盒、ECL化学发光试剂购自上海碧云天生物技术有限公司;实验所用引物均由生工生物工程(上海)股份有限公司合成。
1.3 细胞培养和分组 HTR-8/SVneo细胞培养在含10%胎牛血清及100 U/mL青-链霉素双抗的RPMI-1640培养基中,培养条件为37 ℃、5% CO2、饱和湿度,及时观察细胞生长状态,每2 d换液1次,细胞呈单层融合时,使用0.25%胰蛋白酶消化传代。对数期的HTR-8/SVneo细胞分为空白对照组、钩藤碱低剂量组和钩藤碱高剂量组,其中钩藤碱低、高剂量组分别加入100、400 μmol/L的钩藤碱(根据预实验结果选择加药标准浓度),空白对照组HTR-8/SVneo细胞不做处理。
1.4 CCK-8检测细胞增殖率 对数期的HTR-8/SVneo细胞接种于96孔板中,每孔2×104个细胞,于37 ℃培养箱培养,细胞单层融合度至50%时,按照“1.3”项下分组和处理,分别在24、48、72 h时向每孔细胞中加入20 μL CCK-8溶液,继续孵育4 h,使用多功能酶标仪在450 nm波长处检测光密度值(OD),并计算细胞增殖率。
1.5 流式细胞术检测细胞周期 对数期的HTR-8/SVneo细胞接种于96孔板中,按照“1.3”项下分组和处理,48 h后收集各组HTR-8/SVneo细胞,用预冷的PBS洗涤细胞3次,加入70%乙醇固定细胞,随后用PI染色液在37 ℃下避光染色30 min,通过流式细胞仪分析染色细胞的细胞周期分布情况。
1.6 划痕实验检测细胞迁移率 对数期的HTR-8/SVneo细胞接种于6孔板中,按照“1.3”项下分组和处理,待细胞呈单层汇合时,使用灭菌的枪头进行划痕,用PBS洗去细胞及碎片,放置在37 ℃培养箱继续培养48 h,分别在0、48 h获取图像,计算各组HTR-8/SVneo细胞迁移率。
1.7 Transwell实验检测细胞侵袭能力 对数期的HTR-8/SVneo细胞按照“1.3”项下分组和处理,将细胞悬浮于含1%胎牛血清的RPMI-1640培养液中,将细胞悬液加入孔径为8 μm的Transwell小室上室(上室经Matrigel基质胶包被),在下室加入500 μL含10%胎牛血清的RPMI-1640培养液,在37 ℃培养箱孵育24 h,细胞穿膜至Transwell小室的下层,以多聚甲醛固定,结晶紫染色,通过倒置显微镜观察并统计,每个小室随机选择5个视野进行计数。
1.8 RT-qPCR检测细胞相关基因表达 对数期的HTR-8/SVneo细胞按照“1.3”项下分组和处理48 h后,收集各组细胞并采用Trizol试剂抽提总RNA,经超微量核酸蛋白检测仪检测RNA的纯度和浓度,选取合格的RNA作模板,按照逆转录试剂盒使用说明将RNA逆转录合成cDNA,使用SYBR Premix Ex Taq试剂盒进行PCR扩增反应,分别获取目的基因和内参基因的CT值,以GAPDH为内参,采用2-ΔΔCT法计算目的基因的相对表达量。Vimentin正向引物序列5′-AGTCCACTGAGTACCGGAGAC-3′,反向引物序列5′-CATTTCACGCATCTGGCGTTC-3′;E-cadherin正向引物序列5′-CTGCCAATCCCGATGAAATTG-3′,反向引物序列5′-TCCTTCATAGTCAAACACGAGC-3′;N-cadherin正向引物序列5′-TGGGAATCCGACGAATGG-3′,反向引物序列5′-GCAGATCGGACCGGATACTG-3′;GAPDH正向引物序列5′-CGCTCTCTGCTCCTCCTGTTC-3′,反向引物序列5′-ATCCGTTGACTCCGACCTTCAC-3′。
1.9 Western blot实验检测细胞目的蛋白的表达 对数期的HTR-8/SVneo细胞按照“1.3”项下分组和处理48 h后,收集各组细胞,加入适量RIPA细胞裂解液,于冰上裂解细胞,离心收集蛋白样品,使用BCA检测试剂盒对蛋白进行定量,制备10%的SDS-PAGE凝胶,取等量蛋白样品上样,电泳分离蛋白,采用湿转法进行转膜,将膜放置在含5%胎牛血清的封闭液中孵育1 h,加入相应一抗,4 ℃孵育过夜,次日用TBST洗膜,再加入相应二抗(1∶2 000)孵育,采用ECL化学发光显影,以β-actin为内参蛋白,采集图像,采用Image J软件计算目的蛋白的相对表达。
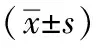
2 结果
2.1 钩藤碱促进HTR-8/SVneo细胞增殖 如表1所示,与空白对照组比较,钩藤碱低剂量组细胞在48、72 h时增殖率均升高(P<0.01),钩藤碱高剂量组细胞在24、48、72 h时增殖率均升高(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组细胞在48、72 h时增殖率升高(P<0.01)。

表1 钩藤碱对HTR-8/SVneo细胞增殖率的影响
2.2 钩藤碱促进HTR-8/SVneo细胞周期进程 如表2、图1所示,与空白对照组比较,钩藤碱各剂量组G0/G1期细胞比例减少(P<0.01),S期细胞比例增加(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组G0/G1期细胞比例减少(P<0.01),S期细胞比例增加(P<0.01)。

表2 钩藤碱对HTR-8/SVneo细胞周期的影响
2.3 钩藤碱增强HTR-8/SVneo细胞迁移能力 如表3、图2所示,与空白对照组比较,钩藤碱各剂量组细胞迁移率均升高(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组细胞迁移率升高(P<0.01)。
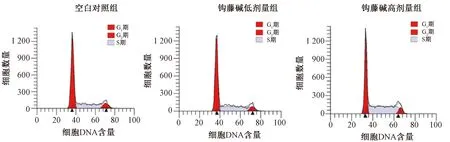
图1 各组HTR-8/SVneo细胞周期细胞比例

图2 各组HTR-8/SVneo细胞迁移能力

表3 钩藤碱对HTR-8/SVneo细胞迁移能力的影响
2.4 钩藤碱增强HTR-8/SVneo细胞侵袭能力 如图3、表4所示,与空白对照组比较,钩藤碱各剂量组侵袭细胞数增加(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组侵袭细胞数增加(P<0.01)。
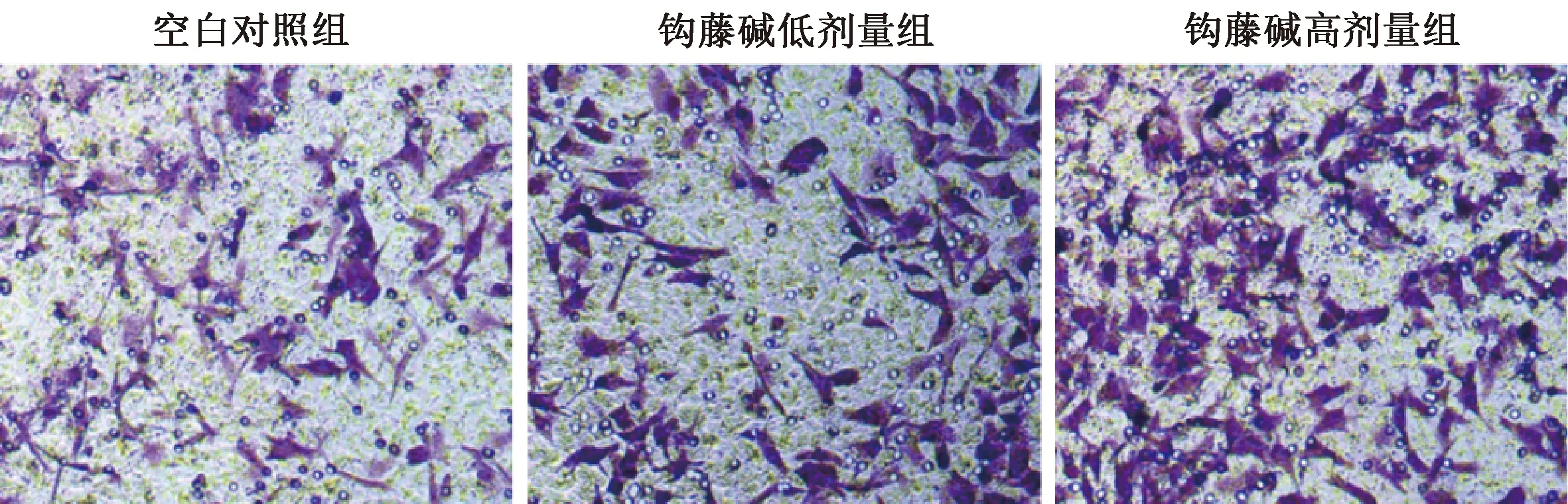
图3 各组HTR-8/SVneo细胞侵袭能力

表4 钩藤碱对HTR-8/SVneo细胞侵袭能力的影响
2.5 钩藤碱诱导HTR-8/SVneo细胞发生上皮间质转化 如图4、表5所示,与空白对照组比较,钩藤碱各剂量组细胞中E-cadherin表达降低(P<0.01),N-cadherin、Vimentin表达升高(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组细胞中E-cadherin表达降低(P<0.01),N-cadherin、Vimentin表达升高(P<0.01)。

图4 各组HTR-8/SVneo细胞中E-cadherin、N-cadherin和Vimentin蛋白表达
2.6 钩藤碱激活HTR-8/SVneo细胞中NF-κB信号通路 如图5、表6所示,与空白对照组比较,钩藤碱各剂量组细胞中NF-κB p65和IκBα磷酸化表达均升高(P<0.01),IκBα表达降低(P<0.01);与钩藤碱低剂量组比较,钩藤碱高剂量组细胞中NF-κB p65和IκBα磷酸化表达均升高(P<0.01),IκBα表达降低(P<0.01)。

表5 钩藤碱对HTR-8/SVneo细胞EMT标志分子表达量的影响
图5 各组HTR-8/SVneo细胞中NF-κB p65、IκBα和p-IκBα蛋白表达

表6 钩藤碱对HTR-8/SVneo细胞中NF-κB p65、IκBα和p-IκBα蛋白表达的影响
3 讨论
子痫前期是一种妊娠并发症,是导致孕产妇和胎儿死亡率增加的主要原因之一[8],是由遗传和环境因素共同作用引起的疾病[9]。目前关于子痫前期的发病机制尚不明确,有学者认为,胎盘中滋养层细胞增殖和侵袭能力不足与该病发病有关[10]。滋养层细胞的增殖对于维持胎盘正常功能具有至关重要的作用,研究显示,子痫前期伴随滋养层细胞的增殖能力明显降低[11]。本实验采用低、高剂量钩藤碱干预人滋养层HTR-8/SVneo细胞,结果发现钩藤碱能促进HTR-8/Svneo细胞增殖,且高剂量效果优于低剂量。此外,本实验结果显示,钩藤碱可促进G0/G1期细胞向S期转化,表明钩藤碱能够促进HTR-8/Svneo细胞周期进程。以上实验结果提示,钩藤碱能够增强滋养层细胞增殖活力,促进细胞周期进程,对子痫前期的发病可能具有抑制作用。
上皮间质转化(EMT)相关分子如E-cadherin、N-cadherin和Vimentin,与滋养细胞的迁移和侵袭能力密切相关[12-13],研究表明EMT在子痫前期胎盘中被抑制[14]。在绒毛顶端或附近的绒毛膜滋养层细胞失去上皮表型,并获得间充质表型,从而赋予了细胞迁移和侵袭的能力[15]。本实验结果显示,钩藤碱干预后HTR-8/Svneo细胞中E-cadherin表达降低,而N-cadherin和Vimentin表达升高,表明钩藤碱可促进EMT过程的发生。钩藤碱处理HTR-8/Svneo细胞后,细胞迁移和侵袭能力均升高,表明钩藤碱能够促进滋养层细胞的侵袭和迁移。滋养层细胞在女性怀孕期间生理上侵入子宫,并且滋养层细胞的侵袭与肿瘤细胞的侵袭行为相似[16]。以上结果表明,钩藤碱可能通过促进EMT的发生促进滋养细胞的侵袭和迁移。多项研究表明,NF-κB信号转导途径参与了滋养层细胞侵袭和迁移[17-19]。在本实验中,钩藤碱处理后,滋养层细胞HTR-8/Svneo中IκBα的磷酸化和NF-κB信号亚基p65的表达均升高,提示钩藤碱能够促进NF-κB信号通路的激活。此外,研究还发现NF-κB信号通路调节EMT过程。本实验结果表明NF-κB信号可能参与了钩藤碱对滋养层细胞侵袭和迁移的促进作用。
综上所述,低、高剂量钩藤碱均可促进滋养层HTR-8/Svneo细胞的增殖,并且能够促进细胞从G0/G1期细胞向S期转化,促进细胞周期进程;此外,钩藤碱还可促进EMT发生,促进HTR-8/Svneo细胞迁移和侵袭,其作用机制可能与促进NF-κB信号通路激活有关。
