河南地区1 182例经典型骨髓增殖性肿瘤患者群体特征及实验室检查结果回顾性分析
2022-06-14唐婉王小乐袁小庚韩雪莹张暋
唐婉,王小乐,袁小庚,韩雪莹,张暋
(郑州金域临床检验中心有限公司,河南 郑州 450016)
骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN)是一组起源于造血干细胞的恶性克隆性疾病,特征表现为一系或多系成熟髓系细胞过度增殖,常伴有肝、脾肿大和出血倾向、血栓形成及髓外造血[1]。根据2016年第4版WHO造血与淋巴系统肿瘤分类目录,经典的MPN包括费城染色体(philadelphia chromosome,Ph)阴性的真性红细胞增多症(polycythemia vera,PV)、原发性血小板增多症(essential thrombocythemia,ET)、原发性骨髓纤维化(primary myelofibrosis,PMF)和BCR-ABL融合阳性的慢性髓细胞性白血病(chronic myelogenous leukaemia,CML)[2];临床诊断分型除血常规检验外,还依赖细胞形态学、免疫学、细胞遗传学和分子生物学检测技术,即MICM诊断体系。骨髓活检和骨髓涂片用于辨别骨髓细胞形态和病理特征,流式细胞术用于辨识骨髓血细胞免疫表型,而染色体核型分析和驱动基因突变检测则有助于疾病分型及预测预后[3]。
本研究整理回顾所收集的经典型MPN确诊病例的基本信息和各项检查结果,按疾病亚型分组,分析MICM框架下多种检测方法联合应用在MPN诊断、分型、预后中的临床价值。
1 资料与方法
1.1 资料收集2019年1月至2021年5月河南省辖各市县(包括17个地级市和1个省直辖县级市)医疗机构送检郑州金域临床检验中心有限公司的已确诊或疑诊为MPN的病例,结合临床信息及在本公司实验室获得的骨髓病理及分子检测结果,排除诊断为其他或疾病未明的,最终筛选出1 182例可确诊为MPN的病例,患者年龄1~89岁,中位年龄63岁,其中男560例,女622例。
1.2 方法实验室检测方案依据MICM诊断体系,结合骨髓形态学、免疫学、细胞遗传学和分子生物学等多技术平台检测优势,为MPN的诊断分型提供客观依据。
1.2.1 骨髓活检和骨髓涂片法 采用骨髓活检和骨髓涂片法辨别骨髓细胞形态和病理特征。骨髓活检组织标本经预处理后包埋并制成切片,采用苏木精-伊红染色法和网状纤维染色法进行常规染色,光镜下观察并描述镜下所见;骨髓涂片标本进行瑞氏吉姆萨染色,低倍镜下观察200个有核细胞,对所观察的细胞进行分类并计数。
1.2.2 流式细胞术 采用流式细胞术识别骨髓血细胞免疫表型,检测抗体包括CD2、CD3、CD4、CD5、CD8、CD10、CD11b、CD13、CD14、CD15、CD16、CD19、CD20、CD33、CD34、CD36、CD45、CD56、CD7、CD64、CD117、CD71、CD41、HLA-DR、IgG1、Kappa、Lambda、CD38、CD138等,取EDTA抗凝骨髓100μL分别加入相应的抗体组合试管中,充分混匀、孵育、裂解红细胞、洗涤及固定,在FC500-MXP流式细胞仪上进行检测并分析。
1.2.3 核型分析 采用G显带法核型分析观察染色体异常,应用短期培养法培养骨髓细胞,制成染色体分析标本并应用G显带技术显带,根据《人类细胞遗传学国际命名体制(ISCN,2009)》进行核型描述。
1.2.4 基因突变检测 采用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)、荧光原位杂交(fluorescence in situ hybridization,FISH)、毛细管电泳、下一代测序(next generation sequencing,NGS)等检测基因突变。采用Qiagen 51106 QIAamp DNA Blood Mini Kit和52304 QIAamp RNA Blood Mini kit试剂盒分别提取骨髓样本中DNA和RNA。
1.2.4.1 实时荧光定量PCR 应用ABI 7500实时荧光PCR仪定量分析JAK2 V617F突变及BCR-ABL融合基因。JAK2定量分析采用Qiagen 673613 JAK2 RGQ PCR Kit试剂盒分别对V617F突变型和野生型DNA拷贝数进行定量检测,通过计算V617F突变型所占百分比,判断患者JAK2基因V617F突变状态。
BCR-ABL融合基因定性检测需从骨髓或外周血样本中提取RNA,使用上海源奇白血病相关融合基因突变检测试剂盒进行检测,以ABL基因为内参对照,报告BCR-ABL融合基因与内参ABL基因的拷贝数比值,并以百分数的形式表示。检测范围覆盖p190、p210、p230融合型。
1.2.4.2 毛细管电泳 采用毛细管电泳片段分析法检测CALR基因9号外显子的插入/缺失突变,下机数据使用GENEMAPPER V5.0分析;Sanger测序法检测MPL基因W515位点及JAK2基因12、13号外显子突变,应用Sequencher软件分析测序峰图,依据人类基因组变异协会(Human Genome Variation Society,HGVS)规则命名变异,毛细管电泳和Sanger测序所用基因分析仪型号为ABI 3500xL Dx。
1.2.4.3 NGS 定制探针靶向捕获MPN相关基因(ABL1、ASXL1、ATG2B、BLM、CALR、CBL、CDKN2A、CSF3R、DNMT3A、EGLN1、EZH2、IDH1、IDH2、JAK2、KRAS、MPL、MYC、NRAS、PDGFRA、PDGFRB、RUNX1、SETBP1、SF3B1、SH2B3、SRSF2、TET2、TP53、U2AF1)外显子区域,KAPA 试剂构建文库,应用illumina Novaseq仪器上机测序,可检测的突变类型有点突变、小片段插入/缺失、剪切子变异等,测序深度可达1 000X以上。
2 结果
2.1 河南地区经典MPN患者群体特征在1 182例确诊为MPN的病例中,患者年龄范围为1~89岁,其中男560例(47.3%)、女622例(52.7%);经综合分析临床信息和实验室检查结果,共有1 134例(95.9%)确诊为经典型MPN,性别和年龄段分布见表1。
数据显示,总体上50~79岁的患者人数最多,占比76.5%。按亚型分类,分别有28.2%、43.2%、16.2%和12.3%的病例确诊为PV、ET、PMF和CML。从年龄分布来看,PV和PMF的发病年龄均不早于30岁,ET可在10岁以后发病,而CML发病年龄可提早至1~10岁。统计分析各亚型患者性别比例,PV和PMF组男、女患者占比相当;ET和CML中男、女患者占比均不同,ET组男、女比例约为2∶3,而CML组为3∶2。对比疾病最高发年龄段发现PV和PMF男、女均为60~69岁;而ET和CML有所不同,ET女性患者为70~79岁,较男性患者晚,CML男性患者为50~59岁,较女性患者早。
在确诊为PV的病例中,临床多描述有红细胞增多、全血细胞增多、三系升高等血象,个别有白细胞增高,其中7例确诊为隐匿性PV,1例伴有脑梗死,1例有慢性乙肝病史。ET患者最显著的特征有血小板、白细胞升高,个别病例有头痛、脾大、消化道出血;1例有脑梗死和高血压,1例伴有冠心病,2例伴有贫血。PMF患者特征多为白细胞升高、全血细胞减少以及骨髓纤维化,部分患者临床表现有发热、脾大或贫血;CML血象多数表现为白细胞显著升高,5例有血小板升高表现,81例诊断为慢性期,1例诊断为急性期。其余48例MPN因现有临床证据不足或检测结果不全无法分型,未进行群体特征分析。
2.2 实验室检查结果统计
2.2.1 骨髓活检及骨髓涂片检测结果 本研究中,PV、ET、PMF和CML组分别有293例(91.6%)、477例(97.4%)、172例(93.5%)、116例(82.9%)的患者接受了骨髓活检检查;分别有218例(68.1%)、264例(53.9%)、94例(51.1%)、76例(54.3%)的患者选择了骨髓涂片检查。经典MPN 4种亚型中,骨髓活检检出率均高于骨髓涂片。见表2。此外,骨髓活检结果提示了7例隐匿性PV。在PMF中提示了疾病分级,诊断44例为纤维化前期、10例MF-1级、29例MF-2级和25例MF-3级;在CML中,81例依据活检结果诊断为慢性期。

表2 PV、ET、PMF、CML骨髓活检和骨髓涂片检出率(%)
2.2.2 常见驱动基因突变检测结果 经典型MPN常见的驱动突变为JAK2基因V617F、JAK2基因外显子12/13、CALR基因外显子9的缺失/插入突变、MPL基因W515位点突变以及BCR-ABL基因融合。在Ph阴性的MPN中检出率最高的为V617F突变,在PV中可达90%以上,在ET和PMF中的检出率约为70%。JAK2外显子12/13突变罕见,在PV中检出率最高,但不及3%。CALR缺失/插入突变仅在ET和PMF中检出且检出率相近,主要为缺失52碱基的L367fs*46突变,插入5碱基的K385fs*4突变次之,其他突变类型少见。MPL基因W515同样仅在ET和PMF中检出,检出率均小于5%,氨基酸改变形式以W515L居多,其次为W515K/A/R。CML中仅检出BCR-ABL基因融合,检出率为100%。见表3。
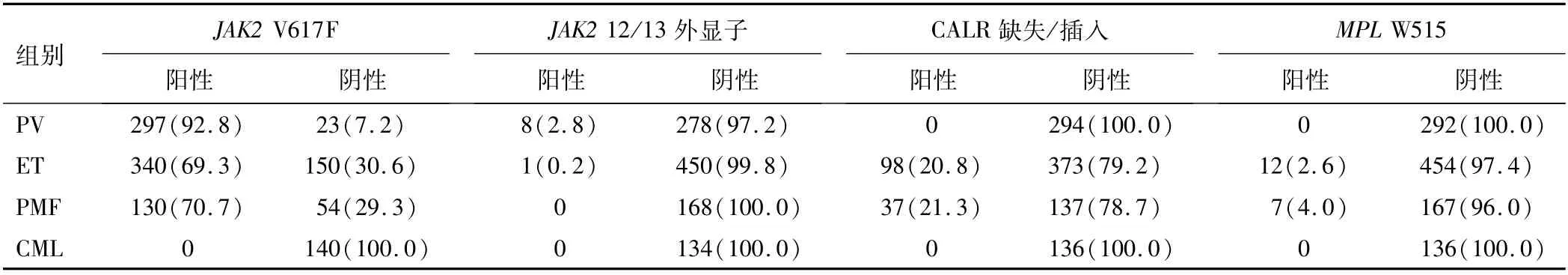
表3 常见驱动基因突变位点检出率比较[n(%)]
PV、ET和PMF组中分别有284、449和167例检测了上述4种驱动突变,大部分Ph阴性MPN病例仅检测到1种驱动突变,即“单阳型”;少部分病例未检测到上述任一变异,简称为“三阴性”Ph阴性MPN;有极少数病例检测到2种驱动突变,即“双阳型”。PV组中,有1例JAK2基因V617与12号外显子共突变;ET组中,有10例JAK2基因V617与CALR基因共突变,1例JAK2基因V617与MPL基因W515共突变,PMF组中发现2例JAK2基因V617与MPL基因W515突变双阳性。较PV和PMF组,ET单阳型的比例略低,而三阴型和双阳型比例略高。见表4。
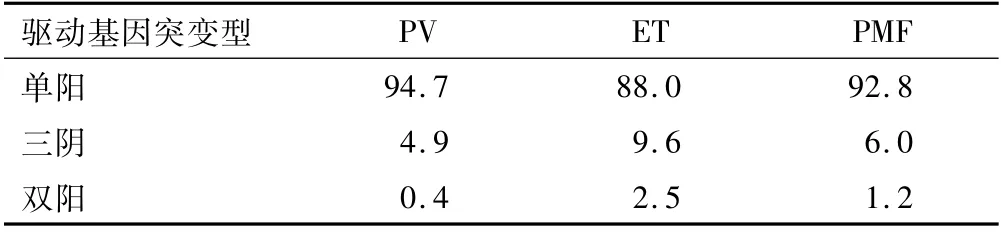
表4 Ph阴性MPN驱动突变类型频率比较(%)
2.2.3 核型分析结果 经典型MPN的核型异常均以结构异常为主,主要有缺失、插入、重复、倒位等。4种亚型相比,CML异常核型检出率最高,结构异常检出率超过95%,所有结构异常的病例均检测到t(9;22)(q34;q11.2),其中2例伴有数目异常。PV中检测到+9、-12、-22等数目异常,ET和PMF中以+8最常见。见表5。
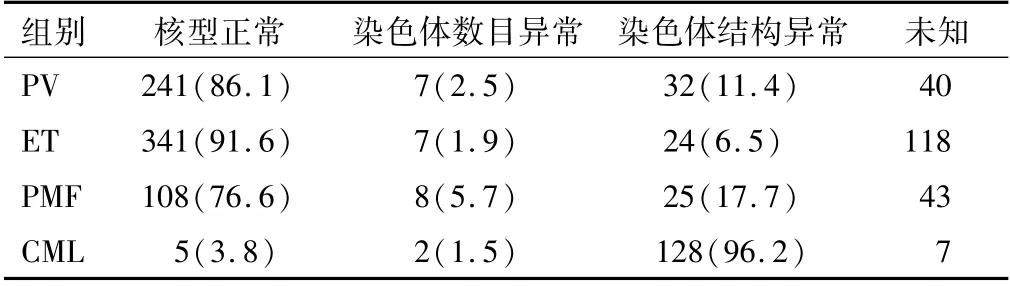
表5 核型异常检出率比较[n(%)]
2.3 MPN相关基因突变统计在PV、ET、PMF和CML中分别有32例、38例、21例和13例MPN相关基因检测NGS套餐检测结果,分别占各组全部确诊患者的10.0%、7.8%、11.4%和9.3%。
在PV组中,32例均检测到JAK2 V617F突变,其中20例单有V617突变(占比62.5%),4例伴有ASXL1基因突变,6例伴有TET2基因突变,2例伴有ATG2B基因突变,分别各有1例伴有DNMT3A、BLM和IDH2基因突变。在ET组中,22例检测到JAK2 V617F突变,其中10例单有V617突变,伴有TET2和DNMT3A基因突变的各有3例,另外3例分别伴有BLM、CBL、SF3B1和SRSF2基因突变;7例CALR突变,4例伴有DNMT3A、TET2、SH2B3基因突变中的1种或2种;1例MPL基因突变,其中1例伴有DNMT3A和TET2突变。与PV相比,ET组基因突变谱较复杂,2~3基因共突变的有18例,占比约50%。在PMF组中,有16例检测到JAK2 V617F突变,除3例外,其余还伴有其他基因突变,其中9例伴ASXL1基因突变,其他伴随出现的突变基因有IDH1(2例)、ATG2B(1例)、SF3B1(2例)、KRAS(1例)、DNMT3A(1例)、CSF3R(1例);有4例检测到CALR突变,其中3例伴TET2,1例伴DNMT3A;1例单独检测到MPL突变。共有17例有2种及以上基因突变,其中JAK2伴ASXL1突变最多。在CML组中,仅有5例检测结果为阳性,分别为2例ASXL1、1例CBL、1例MYC和1例STAG2单独突变,基因突变谱较为单一。
3 讨论
本研究所收集的1 182例河南地区经典型MPN病例覆盖地区广,入组人群年龄范围较大,具有一定的代表意义。在临床信息和检测结果充分的基础上95%以上的病例得以确诊分型。按照疾病亚型、性别和年龄分组统计有益于辨识不同亚型患者的特征,从而为疾病的预防和诊疗提供参考。河南地区经典型MPN高发年龄为50~79岁,按照发病率高低排序依次为ET、PV、PMF、CML。PV和PMF男女患者比例相当,ET女性患者较多,CML可累及婴幼儿。目前尚未发现河南或国内其他地区大规模MPN群体特征统计数据的其他报道,无法进行比较,本研究所涉及的病例数及时间范围毕竟有限,仅供参考。
本研究表明,详细的临床信息和全面的实验室检查结果对于MPN的诊断分型必不可少。血常规等检查结果作为临床信息通常由送检的医疗机构提供,流式细胞术检测快速,可用于分析骨髓血细胞免疫表型,分析原始细胞占比,是辅助诊断重要的技术之一。骨髓活检和骨髓涂片是诊断血液病最常用的细胞形态学检测手段,对疾病的诊断、分型和分期具有重要的参考价值。统计数据显示,接受骨髓活检检查的患者人数占比较骨髓涂片高30% ~40%,骨髓活检在4种疾病亚型的检出率普遍在80%以上,PMF中最高,可达到92%,而骨髓涂片仅能提示10%的PMF。同样地,PV组骨髓活检的检出率高于骨髓涂片。此外,骨髓活检还有助于CML分期。由此可见,在经典型MPN中骨髓活检更具诊断价值。但仍然建议在条件许可的情况下两者兼用,避免漏诊其他髓系疾病[4-7]。
随着实验室和临床研究的进展,越来越多的MPN相关基因及其诊断预后意义被列入国内外指南和共识。本研究中入组病例MPN驱动基因的检测率达90%以上,JAK2 V617F和BCR-ABL融合基因最高,二者变异检出率也最高,CML中染色体核型异常检出率达95%,与BCR-ABL融合基因检出率基本一致,两者结合可作为CML主要诊断依据。JAK2 V617因在PV、ET和PMF中均有检出不能作为分型的依据;但根据目前的研究结果,携带CALR和MPL基因突变的MPN基本可排除PV[8]。Sanger测序及NGS结果均显示JAK2 12、13外显子突变检出率最低,针对经济状况稍差的患者,可在其他诊断证据不足时再考虑检测。CALR和MPL基因突变有助于确诊MPN,但在鉴别诊断ET和PMF时需结合其他检查结果,如骨髓活检。约90%以上的MPN仅携带1种驱动基因突变,与PV和PMF相比,ET驱动基因单阳频率略低,而三阴性和驱动突变双阳性的频率略高,结合NGS检测结果分析,ET的基因突变谱可能最为复杂,PMF次之。本次研究未在PV中发现JAK2与CALR或MPL共突变的情况,NGS结果也显示JAK2突变占主导地位,是基因突变谱较为“单纯”的亚型。CML组NGS结果多为阴性,而其驱动突变的高检出率证实其突变谱较为单一,但此次入组病例较少,还需更多数据加以证实。有文献报道了JAK2、CALR、MPL单驱动基因突变及三阴型在PV、ET和PMF中的检出率[9],本次研究结果与之对比,基本符合。
据统计,绝大多数疑诊为MPN的患者优先选择了快速的驱动突变检测小套餐,仅有约10%的患者选择了NGS检测的MPN相关基因套餐。但最新的NCCN指南提示,除经典的驱动基因外,某些基因突变对预后有重要影响,如在PMF中,CALR突变而ASXL1未突变的类型预后最好(平均生存期10.4 a),反之最差(平均生存期2.3 a),两者同时突变或不突变的预后中等(平均生存期5.8 a)。本研究中有42.9%的PMF患者为ASXL1+/CALR-型,提示预后较差。在PV中,ASXL1、IDH1/2、RUNX1、SRSF2、SF3B1也是预后预测的重要因子。本次研究发现DNMT3A和TET2突变频率也较高,在PV、ET及PMF中都有检出,有文献报道TET2、DNMT3A为DNA甲基化调节因子,可能先于JAK2 V617突变,在推动疾病进展中起作用[10]。临床应推荐已初步确诊分型的患者进一步接受NGS检测以明确预后和后续监测。
各种检测技术各有优劣,相辅相成。qPCR、毛细管电泳等技术检测速度快,但检测的基因突变位点有限,通量不高,Sanger测序较NGS快速,但仅能检测已知突变,灵敏度低,突变频率低于10%时极大概率漏检,不适用于疗效监测。有研究报道,应用全外显子二代测序技术发现了三阴性MPN患者存在非典型驱动突变和非驱动基因突变,有助于解释其发病机制[11]。此外,在临床实践中NGS对于残留病灶或疾病进展的监测以及靶向治疗效果预测方面具有积极作用,可使患者收益[12]。针对经济条件较好的患者,应推广NGS检测,有助于发现更多与疾病相关的基因突变信息,从而不断完善疾病数据库,促进靶向药物的开发及更多的临床转化应用。综上,全面的实验室检查对疾病的确诊、分型及预后具有重要的意义,临床需要结合疾病的特征及技术的优劣势选择合适的检查项目,以期快速精准地获得诊疗依据。
本研究基于现有数据对河南地区MPN患者的群体特征及实验室检查结果做了一个回顾性统计分析,以期为临床诊疗提供一些参考,但碍于临床信息有限,结论存在一定局限性,需更多数据加以佐证。
