子宫内膜癌中EME1基因表达及潜在机制的生物信息学分析
2022-06-14李瑞张文艺应彦祺鲁笑钦
李瑞,张文艺,应彦祺,鲁笑钦
(郑州大学第二附属医院 妇产科,河南 郑州 450014)
子宫内膜癌是发达国家最常见的妇科恶性肿瘤,发病率呈上升趋势。尽管子宫内膜癌患者总生存率相对较高,并且约50%的高危患者不会复发,但是仍有10%~15%的低危患者会复发[1]。肿瘤的病理分型、分级、患者的临床因素都会影响到疾病预后。即使是同一组织类型,也会存在不同的疾病预后。随着精准医学推进,研究者们越发关注子宫内膜癌在分子层面的改变。2013年基于美国癌症基因图谱(The Cancer Genome Atlas,TCGA)数据,子宫内膜癌分为POLE突变型、微卫星不稳定型、低拷贝型、高拷贝型[2]。现今基于转录组学、基因组学和蛋白质组学将子宫内膜癌分类为POLE突变型、错配修复缺陷型、非特异型、p53突变型[3]。研究者们越来越关注子宫内膜癌分子层面的差异,旨在进一步对癌症进行分类,为患者带来更为精准且个体化的治疗方案。
基因组不稳定性(genomic instability,GI)是癌症进化的基础,与耐药性和预后不良有关[4]。染色体不稳定可导致细胞的基因组改变,从而无限制地促进细胞增殖[5]。DNA错配修复(mismatch repair,MMR)基因在维持基因组稳定方面起着重要作用。MMR基因突变破坏了其错配修复功能,导致基因组不稳定,并导致以林奇综合征为代表的基因突变携带者患癌症的风险增加[6]。林奇综合征与子宫内膜癌的遗传易感性相关,因为由于DNA错配修复基因突变导致相应蛋白质表达差异,影响基因组的稳定性[7]。
减数分裂结构特异性核酸内切酶1(essential meiotic structure-specific endonuclease 1,EME1)基因对于维持基因组稳定性起到重要作用,EME1缺失可导致DNA损伤后姐妹染色单体的交换增加[4]。有研究发现对于EME1缺失的胚胎干细胞其姐妹染色单体交换是野生型胚胎干细胞的2倍,EME1在胃癌中高表达,其表达水平与胃癌的分化水平和淋巴转移相关,敲降EME1表达显著抑制胃癌的增殖、迁移和侵袭能力,促进细胞凋亡和细胞周期阻滞[8]。在乳腺癌中,EME1高表达与患者不良预后相关[9]。但是EME1目前与子宫内膜癌的关系尚不明确。本研究通过生物信息学技术分析EME1在子宫内膜癌中的表达、与患者预后的关系及潜在作用机制,拟为深入研究奠定基础。
1 资料与方法
1.1 EME1在子宫内膜癌中的表达及预后分析使用在线工具UALCAN(http://ualcan.path.uab.edu/index.html)分析EME1 mRNA表达水平,该网站收录了子宫内膜癌样本546例,正常子宫内膜样本35例。使用Kaplan Meier plotter数据库(http://kmplot.com/analysis/)对EME1进行生存分析,该网站收录子宫内膜癌样本543例,依据EME1 mRNA表达水平中位值进行分组,分为高表达组和低表达组,进行总生存率(overall survival,OS)及无复发生存率(relapse-free survival,RFS)分析。
1.2 EME1相关基因使用在线工具STRING(https://cn.string-db.org/)进行蛋白质互作(proteinprotein interaction,PPI)分析,寻找与EME1蛋白紧密关联的基因,设置物种为智人,选择最高关联度0.900,选取与EME1关系最为密切的前10位基因。
1.3 EME1及相关基因的富集分析使用DAVID网站(https://david.ncifcrf.gov/)对EME1及10位相关基因进行富集分析,探索EME1及其相关基因的生物学功能。选取包含EME1的富集结果,当P<0.05且FDR<0.05被认为是显著富集,差异有统计学意义。
1.4 EME1的甲基化水平及拷贝数使用在线工具UALCAN(http://ualcan.path.uab.edu/index.html)分析EME1基因启动子甲基化水平。使用cBioPortal数据库(https://www.cbioportal.org/)对EME1基因进行拷贝数变异分析。
1.5 EME1潜在转录因子使用hTFtarget在线工具(http://bioinfo.life.hust.edu.cn/hTFtarget/#!/)预 测基因潜在的转录因子及结合位点,组织限定为子宫内膜。使用在线工具UALCAN分析转录因子的表达水平,使用Kaplan Meier plotter数据库对转录因子进行生存分析,使用cBioPortal数据库(https://www.cbioportal.org/)对EME1与潜在转录因子进行相关性分析。
2 结果
2.1 EME1在子宫内膜癌中高表达且不利预后通过在线工具UALCAN分析EMEI在子宫内膜癌中的表达,结果表明相较于正常子宫内膜组织,EME1在子宫内膜癌中高表达(P<0.001)(图1A)。临床病理分析发现,EME1的表达与肿瘤分期无关(图1B),与肿瘤病理分型有关(图1C)。EME1在浆液性癌(P<0.001)及混合型癌(P=0.044)中的表达水平高于子宫内膜样癌。通过Kaplan-Meier plotter数据库绘制EME1生存曲线,发现EME1与子宫内膜癌患者总生存率(图2A)及无复发生存率(图2B)相关,可作为潜在的不良预后因子。EME1表达水平越低,患者总生存率(P=0.001)及无复发生存率(P=0.018)越高。

图1 EME1在子宫内膜癌中的表达情况
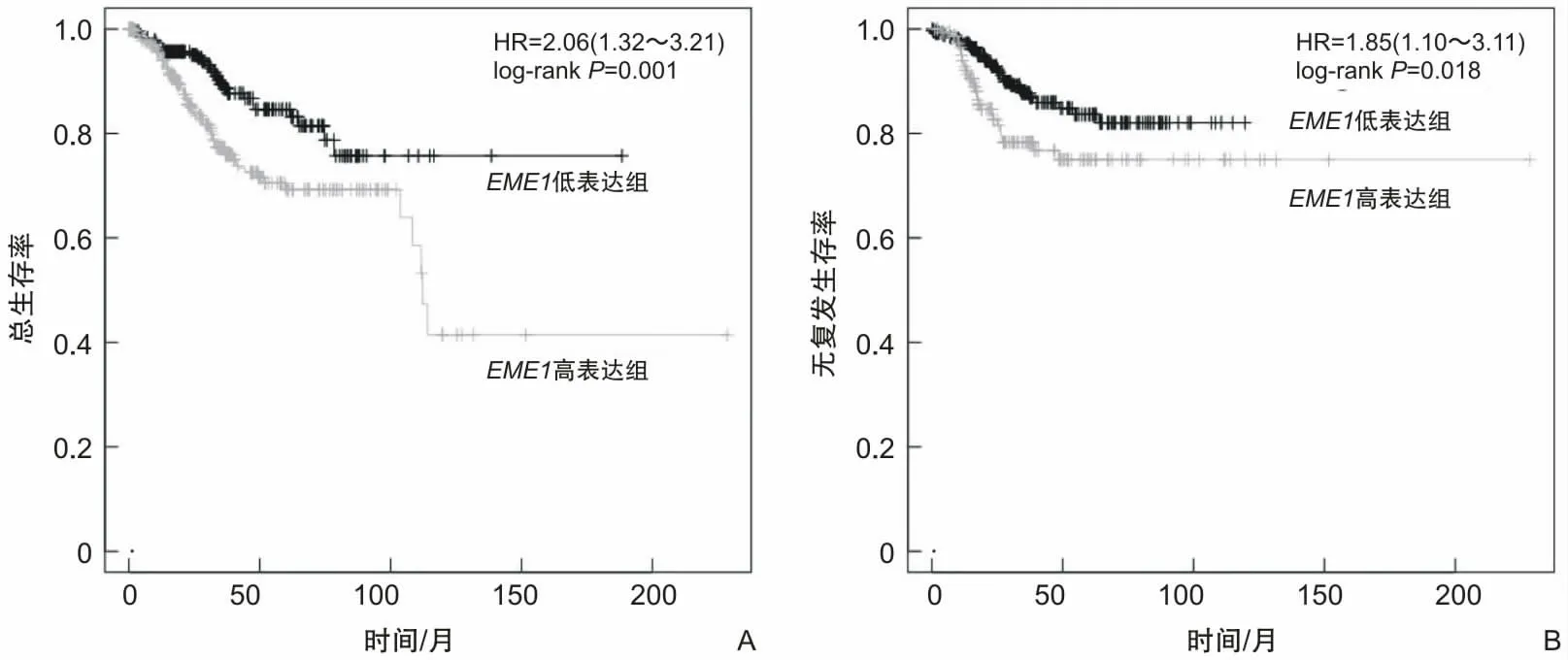
图2 EME1与子宫内膜癌患者生存率关系
2.2 EME1及其相关基因EME1基因可以翻译成蛋白质行使生物学功能。因此,通过STRING数据库对EME1进行蛋白质互作分析查找最密切相关的前10位蛋白,其基因名分别为BRCA1、TOP3A、RAD51、SLX4、ERCC4、MUS81、EXO1、RMI1、RMI2、BLM(图3)。对EME1及10位相关基因共同进行GO富集分析和KEGG通路富集分析发现,这些基因集中在“核质”“霍利迪连接体解离酶复合物”等细胞组分,涉及“DNA结合”“脱氧核糖核酸内切酶”等分子功能,“DNA修饰”“链间交联损伤修复”等生物过程,“范可尼贫血途径”“同源重组”等信号通路(表1)。

表1 EME1的GO和KEGG富集分析
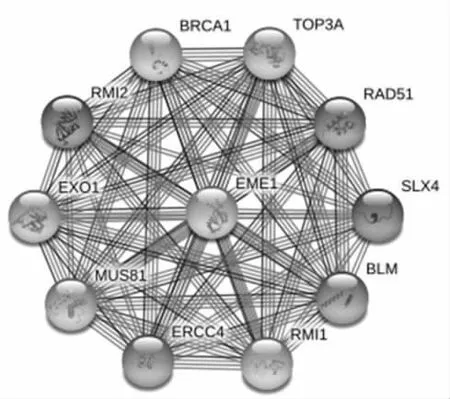
图3 EME1密切相关的10个蛋白
2.3 EME1机制探索为了进一步探索子宫内膜癌中EME1高表达的潜在机制,使用UALCAN数据库对EME1基因启动子甲基化分析,发现正常子宫内膜与子宫内膜癌的甲基化水平差异无统计学意义(P=0.160)(图4A)。但是通过cBioPortal数据库分析发现,在子宫内膜癌患者中,当EME1基因拷贝数值越大,EME1 mRNA表达量越高(r=0.260,P<0.001)(图4B)。
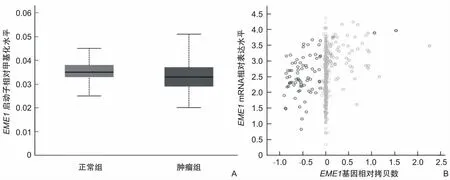
图4 EME1基因表达状态
使用hTFtarget预测EME1潜在转录因子,发现目标转录因子ESR1。ESR1蛋白与EME1 DNA序列存在潜在结合位点,该位点位于17号染色体,范围50 372 893~50 373 256,峰位于启动子区域,峰富集分数为17.4,距离EME1转录起始位点上游327碱基对(图5)。通过UALCAN表达分析发现,ESR1在子宫内膜癌中低表达(P<0.001)(图6A)。对ESR1进行预后分析发现,ESR1高表达与子宫内膜癌患者总生存率高相关(P<0.001)(图6B),与无复发生存率高相关(P=0.031)(图6C)。使用cBioPortal数据库对EME1与ESR1进行相关性分析发现,ESR1 mRNA与EME1 mRNA二者在子宫内膜癌中呈现负相关(r=-0.280,P<0.001)(图6D)。

图5 EME1潜在转录因子预测
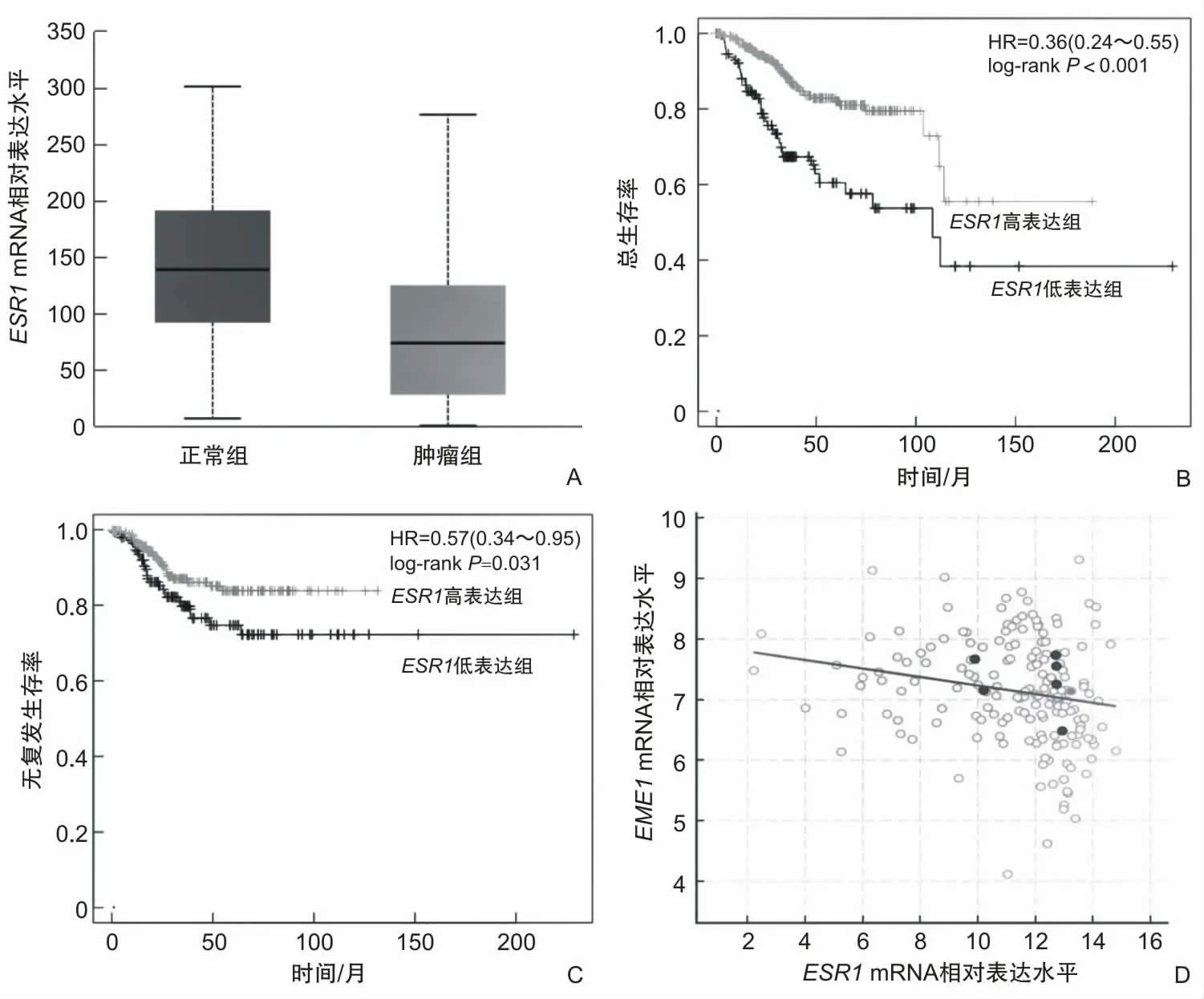
图6 ESR1 mRNA表达水平、对生存率的影响及其与EME1 mRNA表达水平的关系
3 讨论
EME1位于17q21.33(第17号染色减数分裂结构体长臂2区1带3亚带3次亚带),可编码蛋白质。EME1蛋白可以与特定的DNA结构相互作用,例如霍利迪连接体、3’末端翘翼(3’flap)结构、异常复制叉结构[10-11],该蛋白可能影响DNA损伤修复并保持基因组稳定性[4]。Weinandy等[12]发现原发性人胶质细胞瘤中西妥昔单抗可以通过提高EME1的表达水平促进DNA修复,进而达到抗癌效用。EME1自身外显子突变影响体内EME1表达水平,中国南方女性的EME1 Ile350Thr变异与乳腺癌的易感性和早发显著相关,其过度表达可导致乳腺癌的顺铂耐药[13]。然而,目前EME1在子宫内膜癌中的作用机制目前尚不明确。本研究利用生物信息学探索EME1与子宫内膜癌的相关性,为未来的机制探索提供研究基础。
Tomoda等[14]对多种癌细胞株检测发现,EME1低表达的肿瘤对化疗药敏感性更强,子宫内膜癌细胞株AN3CA中EME1是高表达,但是并未检测人子宫内膜癌组织中EME1的表达状况。UALCAN网站汇集了TCGA数据库546例人子宫内膜癌和35例人正常子宫内膜样本的mRNA测序数据,经生物信息分析发现EME1 mRNA在子宫内膜癌患者中高表达,其中浆液性子宫内膜癌与混合型子宫内膜癌中EME1 mRNA的表达水平高于子宫内膜样癌。进行预后分析发现,EME1基因高表达与子宫内膜癌不良预后相关。利用蛋白质相互作用原理,寻找与EME1蛋白关系最为密切的10个蛋白,进行富集分析。10个蛋白分别是BRCA1、TOP3A、RAD51、SLX4、ERCC4、MUS81、EXO1、RMI1、RMI2、BLM。BRCA1是一种同源重组修复蛋白,维持染色体稳定性。Nahshon等[15]研究发现在BRCA1/2突变的人群中子宫内膜癌发病风险增加2~3倍,子宫内膜浆液性癌发病风险增加12~13倍。BLM-TOP3A-RMI1/2溶解酶复合物与端粒延长替代通路中C环形成有关[16]。子宫内膜癌患者BLM Ash杂合突变率高于正常人群[17]。EME1蛋白可以与MUS81蛋白组合成异源二聚体,发挥核酸内切酶活性[18]。RAD51可抑制MUS81-EME1对DNA 3’末端翘翼的切割作用[19]。RAD51在各种肿瘤中过表达导致错误的DNA双链修复,可促进肿瘤的进展与转移。RAD51基因多态性与子宫内膜癌的发生有关[20]。SLX4蛋白是用于组装SLX1-SLX4-MUS81-EME1-XPF-ERCC1(SMX)三核酸酶复合物的支架,SMX促进DNA 同源重组修复[21]。SLX4也可与XPFERCC4核酸内切酶复合体的亚基结合,奠定DNA链间交联损伤修复的基础[22]。EXO1是一种DNA核酸外切酶,与双链断裂修复、错配修复、端粒维持有关[23]。富集分析结果显示它们主要涉及霍利迪连接体、DNA修复、范可尼贫血途径等。富集分析的结果与EME1现有研究所揭露的功能是相符的。上述分析结果可为探索子宫内膜癌中EME1的作用机制铺垫基础。
利用生物信息技术对EME1作用机制进行上游追溯,发现子宫内膜癌细胞基因拷贝数增加与EME1高表达水平相关,同时发现EME1启动子的潜在转录因子ESR1。ESR1可编码雌激素受体α,经生物信息分析发现,ESR1在子宫内膜癌中低表达,与EME1表达呈负相关。根据现有分析结果进行推测:(1)高表达的ESR1可能对EME1启动子有负性调控作用,抑制EME1的表达,当ESR1低表达时,对EME1的抑制减少;(2)生物信息分析结果基于现有研究,具有一定的局限性,可能ESR1与其他转录因子竞争性结合,进而抑制EME1的表达。未来可以借助染色质免疫共沉淀测序技术探索EME1的潜在转录因子。
综上所述,围绕EME1进行了生物信息学分析,挖掘了10个相关基因,1个潜在转录因子,为接下来EME1具体作用机制的研究奠定了基础。同时也肯定了EME1与子宫内膜癌的相关性、重要性,展现了继续深入研究的价值,为未来子宫内膜癌患者的精准治疗提供研究基础。
