LSD1体外促进子宫内膜癌细胞的增殖、迁移和侵袭
2022-06-14陈柯冰任琛琛杨立朱远航赵昕玥
陈柯冰,任琛琛,杨立,朱远航,赵昕玥
(1.郑州大学第三附属医院 妇科,河南 郑州 471000;2.郑州市子宫内膜疾病防治重点实验室,河南 郑州 471000)
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,与宫颈癌、卵巢癌一起被称为女性生殖系统最常见的恶性肿瘤,严重威胁成年女性的生命健康[1]。肥胖和雌激素增加是子宫内膜癌发病的两个重要原因。不同的研究表明,肥胖和内源性或外源性雌激素的增加在子宫内膜癌的发生中起重要作用[2]。虽然子宫内膜癌的诊断大多在早期就已确定,可以进行手术干预,但仅靠良好的手术预后并不能准确判断复发风险,仍需个体化辅助治疗[3-4]。因此,明确子宫内膜癌细胞转移过程中的关键因素,探索子宫内膜癌转移的机制可能为治疗子宫内膜癌提供有前景的治疗方法。
赖氨酸特异性去甲基酶1(lysine specific demethylase 1,LSD1)又称KDM1A,是第1个被发现具有组蛋白去甲基酶活性的蛋白,在哺乳动物生物学中发挥着重要作用[5]。它在许多癌症中异常表达,起着阻止癌细胞分化、促进癌细胞增殖、转移和侵袭的作用,并且与预后不良有关。在过去的十年中,越来越多的证据表明LSD1通过介导多种信号通路参与了多种癌症的进展,包括胃癌、白血病、前列腺癌、膀胱癌、卵巢癌、肾癌等[6-12]。迄今为止,LSD1在癌症中的作用机制仍不完全清楚。最近的研究表明,LSD1可能通过调控四跨膜蛋白CD9的表达来影响肿瘤的转移[13]。
四跨膜蛋白是具有4个跨膜结构域的细胞表面糖蛋白,可以与其他细胞表面蛋白形成聚合物复合物。四膜蛋白有33种,在恶性肿瘤、免疫系统、细胞信号转导、增殖和侵袭中发挥关键作用[14]。CD9作为四跨膜蛋白家族的成员,与多种细胞表面分子相互作用,影响细胞增殖、凋亡和肿瘤转移[14-15]。有研究表明,抗CD9mAb能显著增强子宫内膜癌细胞系的侵袭能力,但不影响细胞增殖能力,提示CD9参与调节子宫内膜癌细胞的侵袭性[16]。
本研究将验证LSD1的缺失会抑制子宫内膜癌细胞的增殖和迁移,而LSD1可能通过靶向抑制CD9促进子宫内膜癌细胞的转移。本研究结果将为子宫内膜癌细胞的转移机制提供新的研究思路,为LSD1作为子宫内膜癌的治疗靶点提供更多依据。
1 材料与方法
1.1 细胞系与主要试剂人子宫内膜癌细胞株HEC1A(北纳创联生物技术研究所),人子宫内膜癌细胞株HEC1B(中桥新周生物技术研究所),人子宫内膜癌细胞株KLE(普诺赛生命科学技术研究所);Ishikawa细胞株由郑州大学第一附属医院妇产科赠送。Dulbecco’s Modified Eagle Medium杜氏改良培养基(DMEM),青-链霉素双抗(中国赛默飞世尔科技公司);DMEM/F12培养基(美国HyClone公司);胎牛血清(杭州四季青公司);TRIzon试剂(康为世纪公司);Rfect质粒DNA转染试剂盒(常州百代生物科技有限公司);Hieff Qpcr SYBR Green Master Mix(上海翊圣生物科技有限公司);Cell Counting Kit-8(CCK-8)试剂盒,增强型灵敏化学发光检测(enhanced chemiluminescence,ECL)试剂盒(苏州宇恒生物科技有限公司);Giemsa染液,结晶紫染液,放射免疫沉淀法缓冲液(RIPA裂解液)(北京索莱宝科技有限公司);抗CD9抗体,抗KDM1A(LSD1)抗体,二抗(武汉三鹰生物技术公司)。
1.2 细胞转染与分组将Ishikawa细胞和HEC1A细胞使用DMEM完全培养基培养,置于37℃、体积分数为5% CO2条件的培养箱中,待细胞生长密度达80%时,分别用LSD1干扰表达载体慢病毒及其阴性对照慢病毒、LSD1过表达载体质粒及其阴性对照质粒感染细胞株。分别记为LSD1-KD组及NC组、LSD1-OE组及NC组。
1.3 RNA提取和定量逆转录聚合酶链反应提取细胞的总RNA,按照逆转录试剂盒说明书将其逆转录为cDNA后,再按照Hieff Qpcr SYBR Green Master Mix说明书进行实时荧光定量PCR。使用StepOne Plus实时PCR系统进行检测,β-actin作为内参对照。相对表达量采用2-ΔΔCt法计算。引物序列见表1。
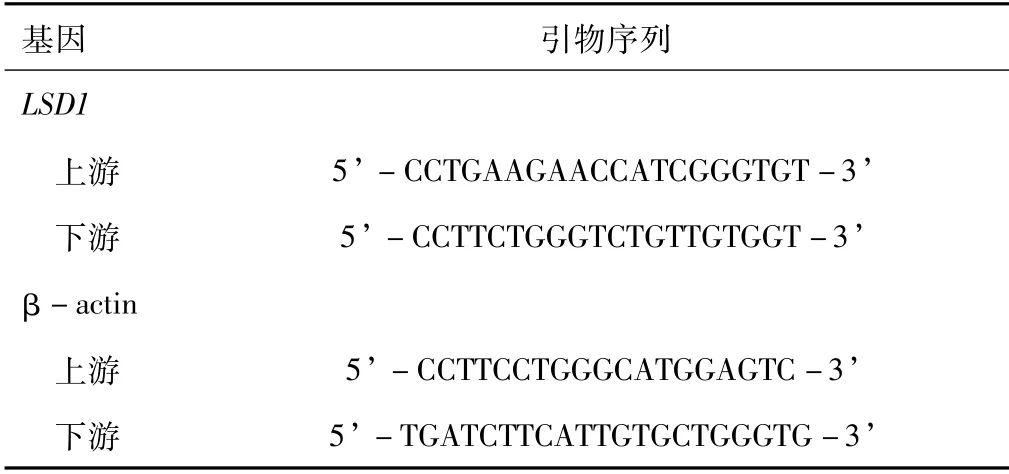
表1 引物序列
1.4 蛋白质印迹法(westernblot,WB)用RIPA裂解液提取细胞总蛋白,BCA试剂盒进行蛋白定量,加入上样缓冲液并进行金属浴使蛋白变性后,每组取30μg进行SDS-PAGE电泳,随后转至PVDF膜上,用50 g·L-1的脱脂牛奶进行封闭2 h,加入目标蛋白和GAPDH的一抗在4℃条件下过夜后,用TBST溶液洗膜5次,每次6 min,然后加入二抗室温孵育1 h,ECL试剂盒显影。
1.5 CCK-8实验将细胞按照每孔2 000个接种于96孔板,过夜培养。按照顺序在每天同一时间点加入CCK-8试剂,放入培养箱避光培养2 h后,用酶标仪检测450 nm处的吸光度。
1.6 集落形成实验将各组细胞按照每孔500个接种于6孔板中,连续培养2周,期间视情况换液。2周后用40 g·L-1多聚甲醛溶液固定,吉姆萨溶液染色,光学显微镜下计数>50个细胞的集落。
1.7 伤口愈合实验将各组细胞接种于六孔板中,过夜培养至密度达到90%时,用200μL的移液枪头形成划痕,将培养基更换为无血清培养基,动态观察。36 h后置于显微镜下观察并拍照。
1.8 transwell侵袭实验提前将基质胶均匀铺在transwell小室的上室中,然后将各组细胞用无血清培养基稀释为每200μL为5×104个接种于上室,下室中加入含体积分数为20%胎牛血清的完全培养基,放置培养箱中48 h,随后擦去上室内表面的细胞,用40 g·L-1多聚甲醛溶液固定下表面上的细胞,再用结晶紫染液染色,放置显微镜下观察并拍照。
1.9 免疫组化染色将石蜡切片进行脱蜡、抗原修复、血清封闭、抗体孵育,然后进行DAB染色、复染细胞核,最后脱水封片,于显微镜下镜检,采集图像。
1.10 异种肿瘤移植实验从斯贝福(北京)生物技术有限公司购买雌性BALB/c-nude小鼠(3~4周龄)10只,随机分为两组,将处理后的细胞悬液充分吹打混匀后,分别将2株细胞的实验组和对照组接种于小鼠皮下两侧腋窝,小鼠左侧腋窝接种实验组,右侧腋窝接种对照组,每周观察并测量小鼠皮下肿块的长径和短径,4周后处死小鼠,剥离肿瘤组织,测量瘤质量,用多聚甲醛固定,以备进一步检测。
1.11 统计学分析使用GraphPad Prism 8软件进行统计学分析与绘图;使用t检验作为统计学方法,数据用均数±标准差(±s)表示。所有的细胞实验均重复3次。以P<0.05为差异有统计学意义。
2 结果
2.1 LSD1在子宫内膜癌中高表达首先通过UALCAN生物信息数据库分析了LSD1的蛋白表达,数据显示LSD1在子宫内膜癌组织中的表达水平高于正常组织(图1A)。LSD1在3级子宫内膜癌组织中的表达水平高于2级子宫内膜癌组织(图1B)。此外,LSD1在晚期子宫内膜癌组织中的表达水平高于1期和3期子宫内膜癌组织(图1C)。随后,为了进一步评估LSD1对晚期患者生存的影响,基于TCGA数据库使用Kaplan-Meier Plotter进行meta分析,结果显示LSD1水平高的患者晚期生存结局较差(图1E)。另一方面,根据临床蛋白质组学肿瘤分析协会(Clinical Proteomic Tumor Analysis Consortium,CPTAC)的数据,LSD1与子宫内膜癌中的 WNT 通路密切相关(图1D)。
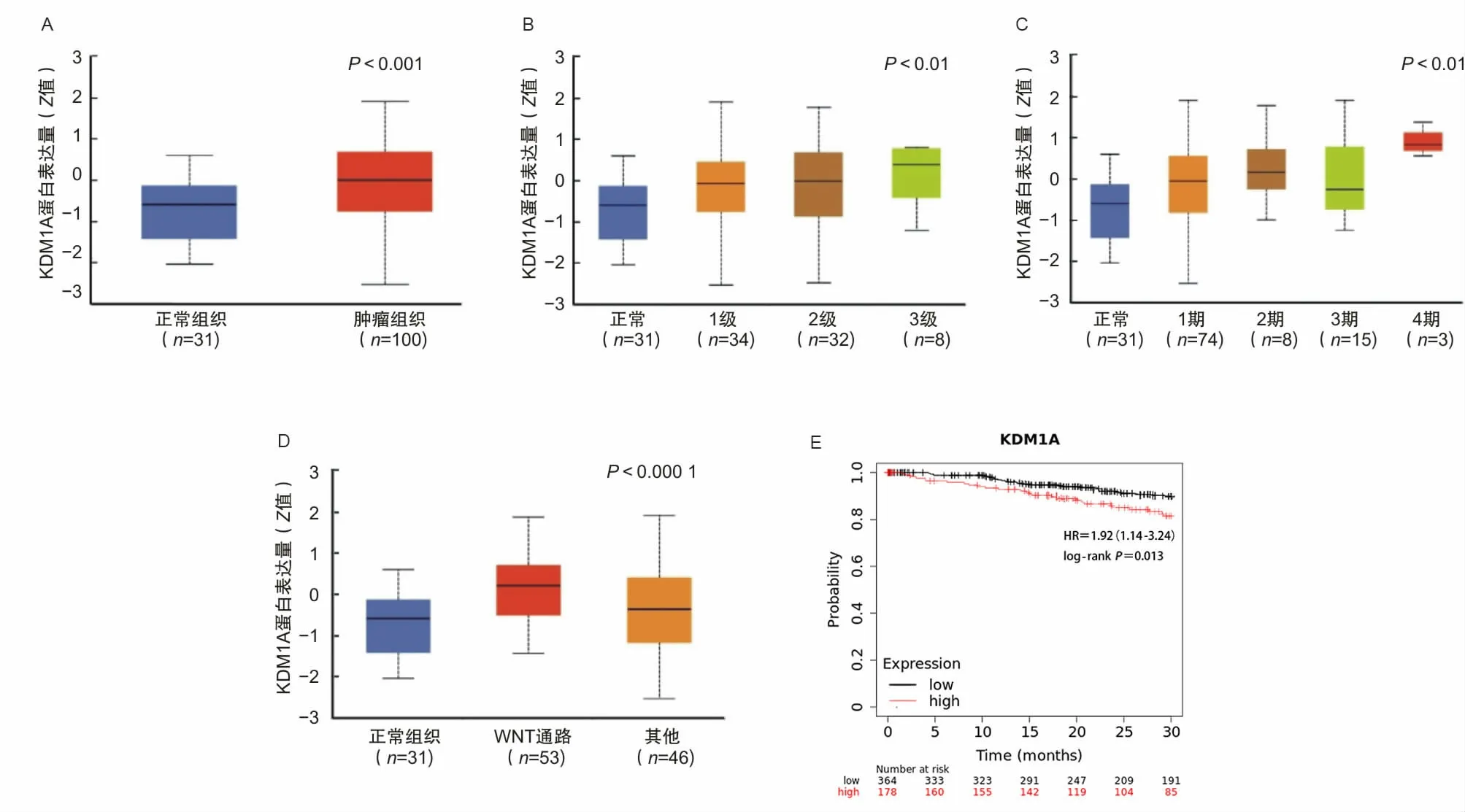
图1 生物信息学分析LSD1在子宫内膜癌中的表达情况和对预后的影响
2.2 LSD1在4种子宫内膜癌细胞系中的表达水平采用WB检测了LSD1在4株子宫内膜癌细胞(Ishikawa,HEC1A,HEC1B,KLE)中的表达水平,经统计分析,LSD1在Ishikawa细胞和HEC1A细胞中的表达水平较高(图2A-B)。

图2 筛选出4株子宫内膜癌细胞中LSD1表达水平最高的2株
2.3 细胞转染效果在Ishikawa细胞和HEC1A细胞中,用过表达质粒和干扰慢病毒分别上调和下调LSD1(图3A)。采用RT-qPCR和WB方法验证转染效率。转染后,与对照组相比,敲减组的LSD1水平低于其对照组,而过表达组的 LSD1 水平高于对照组(图3B-C)。

图3 细胞转染效果及验证结果
2.4 LSD1促进子宫内膜癌细胞增殖分别用2株细胞的KD组及对应NC组、OE组及对应NC组进行CCK-8实验和集落形成实验,研究LSD1对子宫内膜癌细胞增殖的影响。结果显示,与对照组相比,上调LSD1后子宫内膜癌细胞增殖率升高,下调LSD1后子宫内膜癌细胞增殖率降低(图4A)。在2株细胞系的集落形成实验中,LSD1-KD组的集落形成率低于其对照组,而LSD1-OE组的集落形成率高于阴性对照组(图4B)。
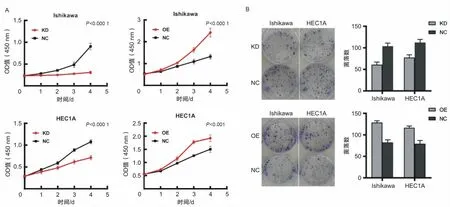
图4 在体外LSD1促进子宫内膜癌细胞的增殖
2.5 LSD1促进子宫内膜癌细胞迁移和侵袭为了证实LSD1与EC细胞迁移和侵袭能力之间的正相关关系,进行了伤口愈合实验和transwell侵袭实验。伤口愈合实验结果显示,LSD1上调后Ishikawa细胞迁移率达56.5% ±2.1%,而对照组细胞迁移率为45.5%±1.2%。在LSD1下调后,LSD1-KD组的Ishikawa细胞迁移至伤区的比率为4.8% ±2.1%,而对照组细胞迁移至伤区的比率为35.6% ±2.6%(图5B)。在HEC1A 细胞中,观察到类似的结果(图5B)。此外,在Ishikawa细胞和HEC1A细胞的transwell侵袭实验中,与对照组相比,LSD1-OE组穿过上室下表面的细胞数量明显增加,但LSD1-KD组的侵袭细胞数量低于对照组(图5A)。
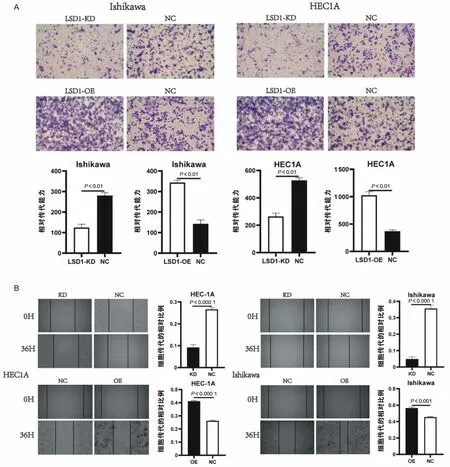
图5 LSD1促进子宫内膜癌细胞的体外侵袭和迁移
2.6 LSD1在子宫内膜癌中反向调控CD9CD9是抑制癌细胞转移的重要因子。首先在ONCOMINE数据库中分析了LSD1与CD9的表达关系,数据显示LSD1与CD9的表达密切相关(图6C)。为了进一步验证这一关系,采用WB检测慢病毒下调LSD1和质粒上调LSD1后CD9的表达水平。结果表明,下调LSD1可使CD9的表达水平升高,反之CD9的表达水平下降。2种细胞株中观察到相同的表现(图6A)。免疫组化检测裸鼠皮下移植组织切片中LSD1和CD9的表达水平也证实了这一观点(图6B)。
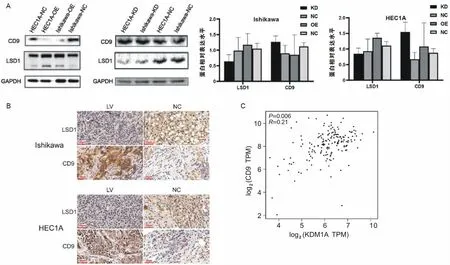
图6 LSD1是CD9的上游调控因子
2.7 LSD1表达的降低在体内抑制子宫内膜癌细胞的生长用干扰慢病毒转染细胞构建LSD1-KD稳转株后,建立BALB/C-nude小鼠皮下肿瘤移植模型。移植后的28 d内,LSD1-KD组裸鼠移植物的生长速度慢于其阴性对照组(图7A-B)。结束时(第28天),与对照组相比,LSD1-KD组的移植瘤体积和质量减少(图7C-D)。
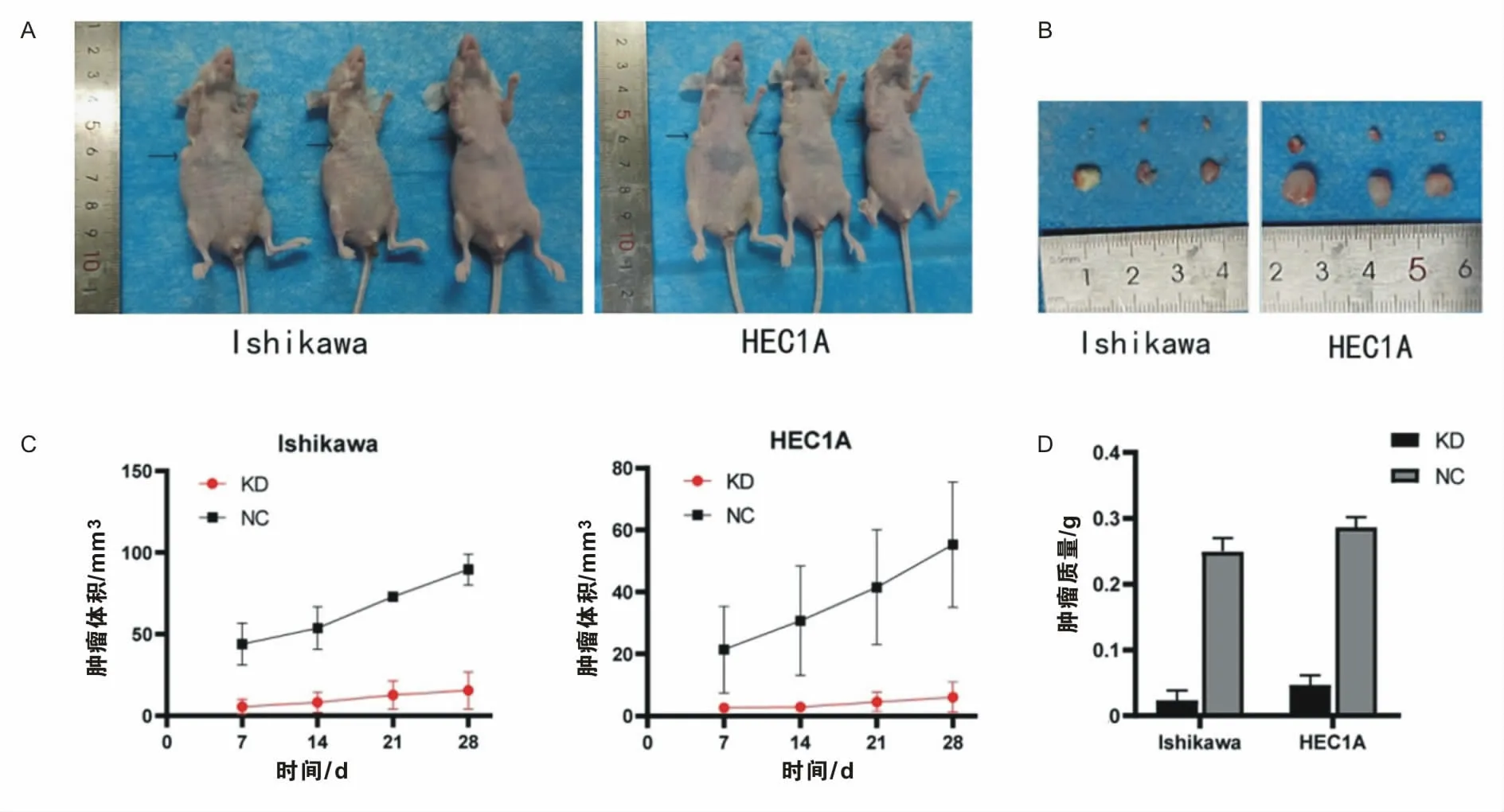
图7 LSD1在体内水平促进子宫内膜癌的增殖
3 讨论
LSD1是首个被鉴定出的赖氨酸特异性去甲基化酶,在未分化侵袭性神经母细胞瘤、乳腺癌、肝癌、侵袭性前列腺癌、胆囊癌、卵巢癌、胰腺癌等肿瘤中高表达,促进增殖、迁移、肿瘤细胞的侵袭等生物学特性[17]。然而,其在子宫内膜癌中的研究却仍不充分。
既往研究报道过LSD1在子宫内膜癌中的作用,研究者主要证实LSD1与雌激素相互作用,通过PI3K/AKT通路促进子宫内膜癌细胞增殖[18]。在另一项研究中,研究者通过对子宫内膜癌组织的免疫组化检测,在组织学水平上验证了LSD1的致癌作用[19]。此外,Theisen等[20]报道了在LSD1小分子抑制剂干预的条件下,LSD1对子宫内膜癌增殖的影响。以上3篇报道都是关于LSD1促进子宫内膜癌增殖作用的研究。本研究中,对LSD1分别进行了干扰和过表达,不仅通过细胞实验验证了LSD1对子宫内膜癌细胞增殖的促进作用,通过伤口愈合和transwell实验证实了LSD1对子宫内膜癌细胞迁移和侵袭能力的影响,还通过裸鼠异种移植实验证实LSD1在体内促进肿瘤增殖。此外,通过检测蛋白表达,发现了LSD1在子宫内膜中负向调控其下游因子CD9。CD9被证实抑制细胞运动和转移,并被报道为运动相关因子[21]。因此,这表明LSD1可能通过下调CD9促进癌症的发生。
在已报道的研究中,LSD1 通过靶向调控miR-142-5p的靶蛋白CD9影响胃癌细胞迁移和生物学特性[13],CD9已被确定为癌转移预测的良好预后标志物[22]。此外,在子宫内膜癌中,发现CD9可以抑制癌细胞的浸润[16]。因此,推测子宫内膜癌中的LSD1和CD9是否也通过某种调控关系影响子宫内膜癌的过程。通过实验发现,在LSD1干扰的细胞中,CD9蛋白水平随着LSD1蛋白表达水平的降低而升高,而在对照组中CD9蛋白水平则降低。LSD1过表达的细胞中也有相同的发现。由此可见,LSD1通过某种深层机制反向调控CD9,从而影响子宫内膜癌的过程,对此怀疑其潜在的机制可能与WNT通路有关。已有研究证实β-catenin在细胞内异常积累与许多人类肿瘤的发生有关,如结直肠癌、肺癌、乳腺癌、宫颈癌、皮肤癌、肝癌等,其中约90%的散发性结直肠癌存在经典WNT信号的异常激活[23-24]。LSD1是WNT通路中的一个重要环节,LSD1抑制剂可与5-FU协同抑制结肠癌生长和转移[25]。研究表明,CD9也与WNT通路密切相关。在晚期结肠癌中,CD9与糖蛋白90K相互作用抑制WNT/β-catenin信号通路,而在其他肿瘤细胞株中,细胞转化和肿瘤转移通过下调WNT家族成员而受到抑制[26-27]。因此,在未来的研究中,期待进一步探索LSD1是否通过WNT通路中与CD9相关的节点调控CD9的表达,从而影响子宫内膜癌的进展。
综上所述,下调LSD1的表达可抑制子宫内膜癌的增殖、迁移、侵袭和肿瘤发生,这可能与CD9表达增加有关。本研究证实了LSD1与子宫内膜癌密切相关,为LSD1作为子宫内膜癌的治疗靶点提供更可靠的依据。未来,希望探索不同的LSD1抑制剂的作用,并进一步研究LSD1影响子宫内膜癌的机制,为子宫内膜癌的治疗提供新的思路。
