基于SIRT1观察补精益视片对自发性青光眼模型DBA/2J小鼠RGCs凋亡的干预及影响
2022-06-14杨凤姣李翔刘红佶万婧雯易文华
杨凤姣 李翔 刘红佶 万婧雯 易文华
青光眼是以持续性RGCs丢失、视神经轴突变性及特征性视野缺损缩小为特征的一组致盲性视神经病变,是世界第一位不可逆性致盲眼病,发病率和致盲率不断上升。预计2040年将达1亿1180万[1]。目前针对青光眼的治疗主要是降眼压药物和保护视神经,降低眼压仍然是治疗青光眼的最有效手段。但单纯控制眼压并不能完全阻止RGCs的凋亡,这表明除病理性眼压升高的主要危险因素外,还存在其他损害机制[2]。我们前期实验及临床研究均证实补精益视片可保护青光眼视功能[3-10],但对RGCs保护作用机制研究不够深入,治疗靶点欠明确。沉默信息调节因子相关酶1(sirtuintypel,SIRT1)是一种细胞代谢辅酶NAD依赖的Ⅲ类组蛋白去乙酰化酶,是Sirtuin家族中被研究最深入的一员,SIRT1在眼部角膜、虹膜、葡萄膜、睫状体、晶状体、视网膜等组织中均有表达[11-14],在葡萄膜炎、白内障、视神经病变以及视网膜退行性疾病发挥作用,尤其对视网膜及视神经退行性变化有保护作用[15-16],近年发现促进SIRT1活性对青光眼RGCs凋亡有一定保护作用,促进SIRT1活性可能成为青光眼新型药物治疗靶点[17-20],但尚无中药干预的研究。故本课题通过观察补精益视片对自发性青光眼模型DBA/2J小鼠RGCs的SIRT1活性及RGCs凋亡的干预及影响,为进一步寻找补精益视片保护青光眼视功能的治疗靶点提供实验依据。
1 材料与方法
1.1模型动物、实验分组与治疗药物 模型动物购置:DBA/2J青光眼模型基因小鼠、对照组C57BL/6J小鼠,均购于上海斯莱克有限责任公司,动物批号:19082808451783CF。该试验已通过实验动物伦理委员会审核,伦理批件G2020001。实验分组:对照组6只(C57BL/6J小鼠)、模型组6只(DBA/2J小鼠)、给药组每组各6只(DBA/2J小鼠补精益视片高、中、低剂量组)。治疗药物:补精益视片为成都中医药大学附属医院院内制剂,规格:100片/瓶,每片重0.3g,川药制字Z20070649。
1.2主要试剂及仪器 Neurobasal/B27培养基购自Life公司,CCK8细胞增殖检测试剂盒购自Solarbio公司,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自日本同仁公司,中强度RIPA裂解液、BCA蛋白定量试剂盒及ECL发光液均购自弗德生物公司,SDS购自Acmec公司,SIRT1抗体购自Abcam公司,细胞培养箱、台式高速离心机均购自Thermo Fisher公司,生物倒置显微镜购自Nikon公司,脱色摇床购自其林贝尔仪器公司,电泳仪购自Bioneer公司,流式细胞仪购自BD公司,荧光定量PCR仪购自ABI公司,酶标仪购自东华电子公司。
1.3给药方法 对照组、模型组生理盐水2mL灌胃,给药组各组每天灌胃补精益视片混悬液2mL,低剂量组0.45g/kg、中剂量组0.9g/kg、高剂量组1.8g/kg,每天同一时间段(2:00pm~5:00pm)测眼压后灌胃1次,连续灌胃8周。
1.4取样 药物处理小鼠8周后取眼球:5组,每组6只小鼠,各组小鼠分别在喂养8周后摘除眼球并固定,处死动物,取眼球样本(左眼和右眼),共计60个样本,并妥善保存。其中30个眼球组织样本(左眼)用多聚甲醛固定,用于HE染色病理实验;另外30个眼球样本(右眼),制备视网膜神经节细胞悬液,-80℃保存,用于Q-PCR、Western Blot、流式细胞术、CCK-8实验。
1.5检测指标及技术
1.5.1Annexin V-FITC/PI双染法流式细胞术检测各组RGCs凋亡率 ①用PBS洗涤孔内细胞三次,加入不含EDTA的胰酶消化收集细胞;②室温,2000 rpm离心5min,收集细胞,用PBS洗涤细胞两次;③在50μL的Binding Buffer中加入5μL PI染液,混匀;④在收集的细胞沉淀中加入上述PI染液,混匀,室温避光反应15min;⑤反应后加入450μL的Binding Buffer混匀;⑥加入1μL Annexin V-FITC混匀,室温避光反应15 min;⑦用流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm,Annexin V-FITC荧光信号呈绿色,使用FL1通道检测,激发波长Ex=488nm,发射波长Em≥630 nm,PI红色荧光用FL3通道检测于48h时间点收集各组细胞,上流式细胞仪进行检测,得到四个象限内细胞百分比,计算右上和右下象限内细胞百分比和,每组重复3次,最后取平均值,得出细胞凋亡率。
1.5.2CCK-8检测各组RGCs存活 提取的各组小鼠视网膜神经节细胞悬液,以5×104/mL的细胞密度接种于96孔板内,每孔加入液体100μL,37℃孵箱培养24 h后,以含3%胎牛血清培养基培养24h,每孔加10μL CCK-8试剂,酶标仪测光度值、吸光度值计算各组细胞间的存活率。
1.5.3Q-PCR检测各组RGCs的SIRT1 mRNA表达 先提取总RNA,然后逆转录反应:取一PCR管,加入含2μg RNA的溶液,加入1μL oligo(dT)15,用无核糖核酸酶的去离子水补足至12μL,于PCR仪上70℃保温5min,迅速置冰上冷却,依次加入4μL 5×buffer,2μL 10mM dNTPs,1μL RNA inhibitor和1μL 反转录酶,用枪抽吸混匀,于PCR仪上42℃保温30min,结束后80℃保温5min灭活反转录酶,其次定量PCR反应,循环结束后从55℃升高到95℃获取熔解曲线,进行结果分析:ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K。
1.5.4Western Blot检测各组RGCs的SIRT1蛋白表达 提取蛋白并测量蛋白浓度,进行样品蛋白处理:将待测样本分别与5×SDS上样缓冲液按4∶1比例混合,置于沸水中加热5min,立即置于冰上3min;上样,电泳:将玻璃板对齐后放入夹中卡紧,按实验安排配制分离胶,加入TEMED后立即摇匀即可灌胶,约45min后可倒去胶上层水并用吸水纸将剩余水吸干, 配制5%的浓缩胶,加入TEMED后立即摇匀即可灌胶,将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中,加足够的电泳液后上样电泳,浓缩胶电压75V,分离胶用120V,电泳至溴酚蓝刚跑出即可终止电泳,进行转PVDF膜,转膜条件:200mA,1小时;封闭,显影;进行图像分析:以β-actin作为内参,以目的条带与内参条带的比值代表各组目的蛋白的表达水平,每个目的条带Western blot重复3次。
2 统计方法
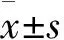
3 结果
3.1眼压 实验前、后模型组与对照组相比均高(P<0.05),模型组实验后与实验前相比差异无统计学意义。高、中、低剂量给药组实验后与实验前相比均明显降低(P<0.01),与模型组比较降低(P<0.05),说明补精益视片有降低眼压的作用(表1)。
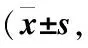
表1 各组小鼠实验前后眼压情况每组n=6)
3.2补精益视片对体外培养小鼠RGCs中的SIRT1mRNA表达的影响 结果表明:模型组与对照组相比降低(P<0.05),高、中、低剂量给药组与模型组相比均升高(P<0.05)、高剂量组最高,说明模型组RGCs SIRT1 mRNA表达明显降低,补精益视片能提高RGCs的SIRT1 mRNA表达量,且与剂量呈正相关(图1-2、表2)。
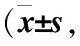
表2 各组体外培养小鼠RGCs的SIRT1 mRNA表达情况每组n=6)

图1 SIRT1实时荧光定量PCR(A:Melt Curve B:Amplification Plot)
3.3补精益视片对体外培养小鼠RGCs中的SIRT1蛋白表达的影响 Weston blot蛋白印迹法结果显示:模型组RGCs的 SIRT1蛋白表达与对照组相比降低(P<0.05),高、中、低剂量给药组与模型组相比均升高(P<0.05),高剂量组最高(P<0.05),说明模型组RGCs的SIRT1蛋白表达明显降低,补精益视片能提高RGCs的SIRT1 mRNA表达量,且与剂量呈正相关(图3-4、表3)。
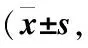
表3 各组体外培养小鼠RGCs中的SIRT1蛋白表达每组n=6)
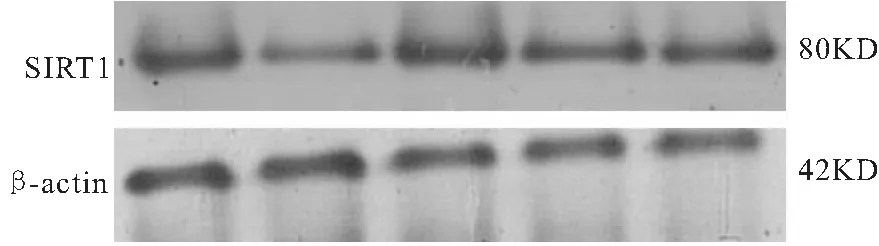
图3 各组体外培养小鼠RGCs中的SIRT1蛋白表达
3.4补精益视片对体外培养小鼠RGCs凋亡的影响 AnnexinV/PI流式细胞术检测结果表明:模型组凋亡率较对照组明显升高(P<0.05),高、中、低剂量给药组凋亡率均低于模型组(P<0.05),高剂量组最低,表明补精益视片对细胞凋亡起到了抑制作用,且与剂量呈正相关(表4、图5)。
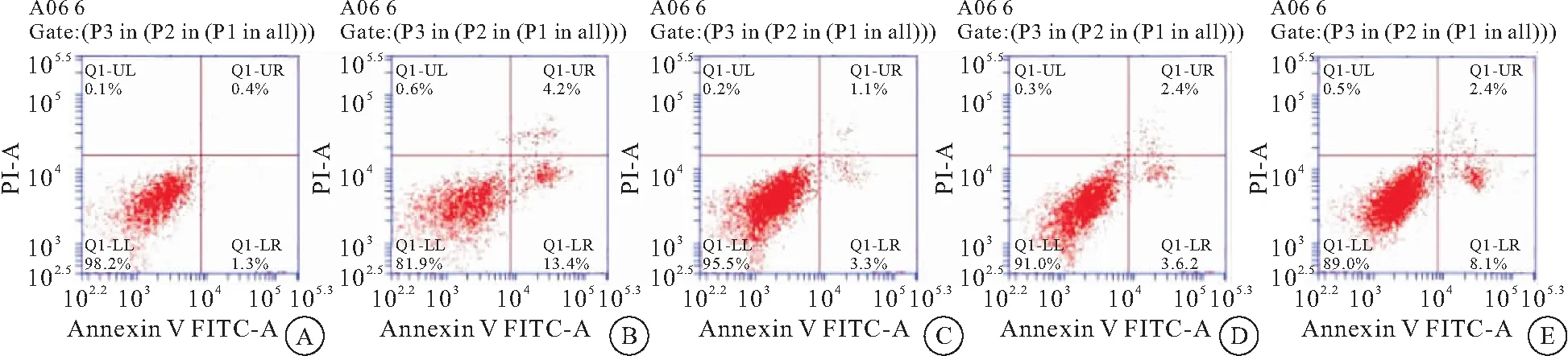
图5 补精益视片对体外培养小鼠RGCs凋亡的影响
表4 补精益视片对体外培养小鼠RGCs凋亡率的影响每组n=6)
3.5补精益视片对体外培养小鼠RGCs存活的影响 CCK-8法检测各组RGCs存活结果表明:RGCs经24h、48h、72h培养后细胞RGCs生存率(OD值),模型组与对照组相比均降低(P<0.05),高、中、低剂量给药组均高于模型组(P<0.05),高剂量组最高,表明模型组RGCs存活率明显降低,而补精益视片对RGCs存活有促进作用,且与剂量呈正相关(表5,图6)。
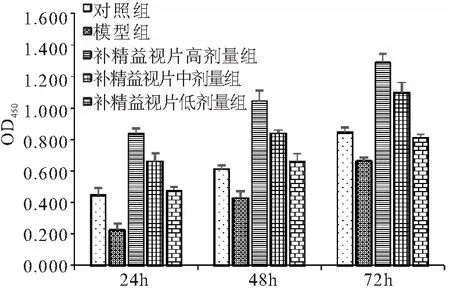
图6 各组体外培养小鼠RGCs细胞增殖情况
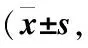
表5 各组体外培养小鼠RGCs细胞增殖情况每组n=6)
*P<0.05 vs 对照组,#P<0.05 vs 模型组
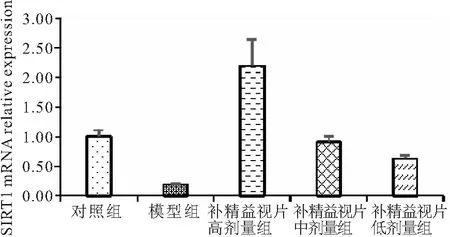
图2 各组体外培养小鼠RGCs的SIRT1 mRNA表达情况
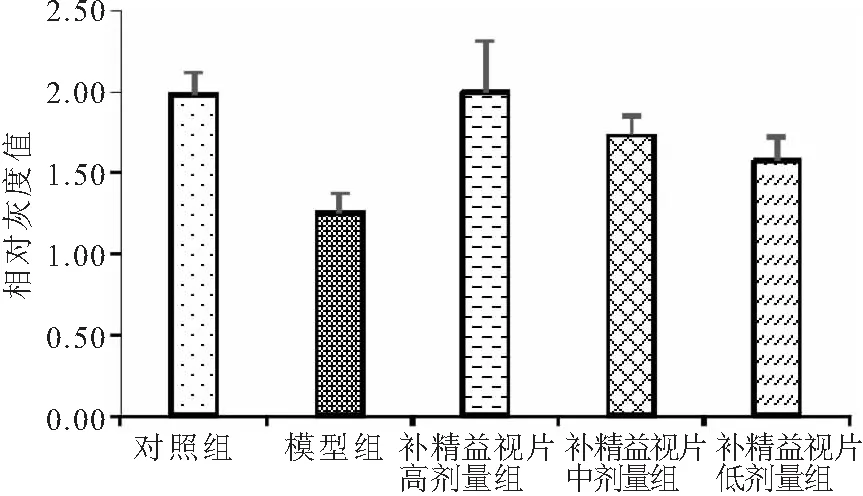
图4 各组体外培养小鼠RGCs中的SIRT1蛋白表达
4 讨论
自发性青光眼小鼠DBA/2J模型能更好地模拟临床青光眼发病特点,也更适于表观遗传学机制研究,2~3月龄DBA/2J小鼠虹膜眼压视网膜和视神经的组织结构均正常,6月龄开始出现眼压升高和明显的虹膜异常,8~9月龄开始出现RGCs和视神经的变性到18个月,且雌性发病早,进展快,眼压更高,视神经损害较重,故本研究选择10月龄雌性DBA/2J小鼠为研究对象[21-23],而C57BL/6J小鼠被广泛用于DBA/2J小鼠正常对照实验,故以C57BL/6J小鼠为对照组[24-25]。
组蛋白乙酰化修饰作为表观遗传学重要机制之一,在细胞分化和凋亡中发挥重要作用,已广泛应用于心血管疾病、肿瘤及退行性神经系统疾病等疾病的研究[26-28],其中SIRT1是调控衰老、神经功能、细胞凋亡的关键因子[29]。研究证实SIRT1表达活性的下调可能是青光眼发病因素之一、SIRT1与青光眼小梁网细胞 (GTM)DNA双链损伤修复能力与细胞衰老有关[30],有学者对RGC-5研究发现SIRT1上调能减弱RGC-5凋亡[31],通过研究大鼠视神经损伤模型也发现SIRT1参与视神经损伤及修复过程[32],促进SIRT1活性可能成为青光眼新型药物治疗靶点[33]。补精益视片(枸杞子、菟丝子、五味子、丹参、三七、茺蔚子、楮实子、车前子、青皮、木瓜)为中医眼科名家陈达夫教授经验制成的成都中医院大学附属医院院内制剂,广泛用于肝肾虚损、脉络瘀滞所致的眼目昏花、视神经视网膜功能减退等症,备受医患青睐[34],其滋养肝肾、活血通络的功效,切合青光眼视神经病变“肝肾虚损、脉络瘀滞”的主要病机[35],我们前期实验发现补精益视片对SD大鼠青光眼视功能损害从RGCs、视神经至视中枢均具有确切保护作用[4-10]。临床也证实补精益视片治疗眼压控制后青光眼疗效确切,可不同程度改善患者中医症状,提高视力、视觉敏感度,有效控制视野缺损,从而保护青光眼患者视功能[3-4]。
本研究基于SIRT1观察补精益视片对自发性青光眼模型DBA/2J小鼠RGCs凋亡的干预及影响,眼压结果提示高、中、低剂量给药组实验后与实验前相比、与模型组相比,眼压值均明显降低,说明补精益视片能降低眼压;通过Q-PCR检测SIRT1 mRNA表达发现模型组RGCs中的SIRT1 mRNA表达低于对照组;高、中、低剂量给药组SIRT1 mRNA表达均升高,尤以高剂量组表达最高,说明补精益视片能增加小鼠RGCs的SIRT1 mRNA表达;通过Western Blot检测RGCs的SIRT1蛋白表达量发现模型组低于对照组,高、中、低剂量给药组均高于模型组,高剂量组表达量最多,说明补精益视片能促进小鼠RGCs的SIRT1蛋白表达,以上表明补精益视片上调SIRT1的表达作用可能类于SIRT1“激动剂”;另外,Annexin V-FITC/PI双染法流式细胞术检测各组RGCs凋亡率发现,模型组高于对照组,高、中、低剂量给药组均低于模型组,高剂量组最低,CCK-8检测各组RGCs生存结果表明:模型组低于对照组,高、中、低剂量给药组均高于模型组,高剂量组最高,进一步证实了补精益视片抑制小鼠RGCs凋亡,促进小鼠RGCs细胞存活作用。
综上所述,补精益视片既可上调SIRT1组蛋白去乙酰化酶,促进RGCs存活、抑制RGCs调亡、增加RGCs的SIRT1 mRNA及蛋白表达,且均与剂量呈正相关,又能降眼压,表明补精益视片可通过降低眼压、上调SIRT1组蛋白去乙酰化酶、抑制RGCs凋亡、促进RGCs生存而实现保护青光眼视功能的作用,推测其治疗靶点可能为促进SIRT1活性,为将补精益视片开发成青光眼视功能损害保护新药奠定科学基础,惠及更多青光眼患者。
