2-十三烷酮胁迫下棉铃虫FoxAl调控CYP6B6的表达
2022-06-10魏倩刘小宁赵洁
魏倩 刘小宁 赵洁
(1. 新疆大学生命科学与技术学院,乌鲁木齐 830046;2. 石河子大学农学院,石河子 832003)
叉头框蛋白(forkhead box protein,Fox)家族是一类含有保守的fork head(FH)结构域的转录因子,该结构域中的“螺旋-转角-螺旋”基序与下游基因启动子区的顺式作用元件结合[1-2]。Fox转录因子的分布十分广泛,从酵母、线虫、昆虫、海鞘、爪蟾、小鼠到人类中,已经发现了数百种Fox蛋白[3-5]。根据Fox蛋白在N端和C端的变异程度,将Fox家族分为24个亚家族和1个孤儿类别[6]。已发表的昆虫基因组或转录组结果表明,昆虫体内并不包含所有的Fox亚家族,例如家蚕体内主要缺失FoxAB、FoxE、FoxH、FoxI、FoxK、FoxL1、FoxM、FoxQ1、FoxR和FoxS[7]。目前,昆虫Fox蛋白的研究主要集中于FoxO和FoxA亚家族,它们在昆虫的氧化应激、生长发育、细胞凋亡、解毒代谢、糖脂代谢和先天免疫等方面发挥着重要的作用[8-12]。
棉铃虫(Helicoverpa armigera)幼虫是一种多食性的农业重要防治害虫。目前,关于棉铃虫Fox蛋白的研究报道极少。Bao等[13]从棉铃虫的蛹内克隆获得第一个Fox基因,即HaFoxA,并发现FoxA蛋白可以与滞育激素和信息素生物合成激活神经肽(diapause hormone-pheromone biosynthesis-activating neuropeptide,DH-PBAN)基因的启动子结合,从而参与蛹的激素合成并影响滞育过程。Cai等[14]首次克隆获得棉铃虫的FoxO基因,并发现在20-羟基蜕皮激素的影响下,FoxO蛋白与Broad转录因子亚型7(broad isoform 7,BrZ7)基因的启动子结合,提高BrZ7以及下游羧肽酶A(carboxypeptidase A,CPA)基因的表达量,从而在棉铃虫的蜕皮过程中促进蛋白质水解。Li等[15]将棉铃虫3龄幼虫体内的FoxA进行RNA干扰(RNA interference,RNAi)后发现,响应苏云金芽孢杆菌Bacillus thuringiensis的两个Cry毒素蛋白受体,即ATP结合盒转运蛋白(ATP-binding cassette transporter proteins,ABCC2和ABCC3)基因的表达都显著降低,并且幼虫对Cry毒素的耐受性明显增强。
2-十三烷酮(2-tridecanone,2-TD)是一种天然存在于茄科植物中的重要次生物质,它能够诱导昆虫体内细胞色素P450解毒酶(cytochrome P450 enzymes)基因的过量表达,例如低浓度的2-TD能显著提高棉铃虫CYP3、CYP6亚家族基因的表达,激活棉铃虫的解毒代谢通路[16-17]。CYP6B6是棉铃虫中肠内一个重要的解毒酶基因,它在棉铃虫的有毒物质代谢和生长发育过程中都发挥重要作用[18]。然而,2-TD长期胁迫却会降低CYP6B6表达量,导致棉铃虫化蛹时间延长、并显著降低化蛹率和羽化率[19-20]。同时,在低浓度2-TD短期胁迫后,对CYP6B6基因的启动子进行分析发现,-373/+21 bp处(即HE1片段)是最重要的活性序列[21]。本课题组前期利用酵母单杂交技术,筛选2-TD短期胁迫后能与HE1片段结合的调控因子,发现一个阳性酵母的测序片段中含有FH结构域的部分序列;同时在2-TD短期处理6龄幼虫的中肠转录组中发现一个新的Fox基因,它和CYP6B6一样都能响应低浓度2-TD胁迫。将克隆得到的新Fox基因与已发表的昆虫FoxA进行多序列比对后发现,该基因包含Fox家族保守的FH结构域,以及一个疑似FoxA亚家族转录激活结构域(Domain Ⅱ)的相关区域,并把该基因命名为FoxA类似基因(forkhead box protein A-like,FoxAl)[22]。随后,对CYP6B6启动子进行转录因子结合位点预测,发现HE1片段上含有多个Fox转录因子的结合位点。基于以上的研究基础,我们推测FoxAl有可能是CYP6B6的转录因子,从而参与棉铃虫的解毒代谢和生长发育过程。
因此,本研究先利用酵母自激活试验,验证FoxAl蛋白是否具有转录激活功能;随后通过凝胶阻滞试验,验证FoxAl蛋白能否与CYP6B6启动子HE1片段结合。在确定FoxAl是CYP6B6的转录因子后,一方面用不同浓度的2-TD胁迫处理棉铃虫6龄幼虫,另一方面注射FoxAl dsRNA于棉铃虫5龄幼虫体内,通过实时荧光定量PCR(Real-time quantitative PCR,qPCR)技术测定不同时间后幼虫中肠内FoxAl和CYP6B6的表达情况,确定FoxAl与CYP6B6启动子的调控关系,为FoxAl蛋白参与棉铃虫的生长发育和解毒代谢过程提供依据,为进一步探索棉铃虫对次生物质的适应机制奠定基础。
1 材料与方法
1.1 材料
供试昆虫:棉铃虫采集于乌鲁木齐市安宁渠镇,并在本实验室用人工饲料长期饲养,试虫种群为第5代。人工饲料配方:玉米粉120 g,大豆粉40 g,琼脂20 g,山梨酸1 g,酵母粉12 g,青霉素0.1 g,抗坏血酸2 g,维生素C 4 g,肌醇0.2 g,复合维生素B 0.9 g,蒸馏水620 mL。饲养条件:温度(26±1)℃,相对湿度(75±5)%,光周期16L∶8D。
菌株和质粒:酿酒酵母Saccharomyces cerevisiae Y2HGold菌株购自Clontech公司,最适生长温度30℃;大肠杆菌Escherichia coli DH5α感受态细胞购自北京全式金生物技术有限公司,最适生长温度37℃;大肠杆菌Transetta(pET32a-FoxAl)菌株由课题组前期构建,最适生长温度37℃,蛋白表达最适温度25℃。pMD18-T-FoxAl质粒由课题组前期构建,pGBKT7质粒购自Clontech公司。
试 剂:DIG-High Primer DNA Labeling and Detection Starter Kit II购自Roche公司;Matchmaker Insert Check PCR Mix 2、2×YPDA Broth、SD/-Trp with Agar和X-α-Gal均购自Clontech公司;EMSA/Gel-Shift结合缓冲液(5×)、EMSA/Gel-Shift上样缓冲液(无色,10×)和EMSA/Gel-Shift上样缓冲液(蓝色,10×)均购自上海碧云天生物技术;2-十三烷酮购自上海麦克林生化科技有限公司;DL2000 DNA Marker、DL5000 DNA Marker、BamH I、EcoR I和T4 DNA Ligase均购自宝生物工程(大连)有限公 司;Proteinlso Ni-NTA Resin、EasyPure RNA Kit、EasyScript First-Strand cDNA Synthesis SuperMix和PerfectStart Green qPCR SurperMix(+Dye I)均购自北京全式金生物技术有限公司;T7 RiboMAX Express RNAi System购自北京普洛麦格生物技术有限公司;其他化学试剂均为国产分析纯试剂。
1.2 方法
1.2.1 FoxAl蛋白的转录激活活性测定 以前期测序正确的pMD18-T-FoxAl质粒为模板,PCR扩增获得FoxAl的开放阅读框(ORF)序列,其中上、下游引物分别为(5'-GGAATTCATGGCGGCTAGAACA GGT-3',EcoR I酶切位点)和(5'-CGGGATCCCTAGT CCACCGTGATGA-3',BamH I酶切位点)。随后,用限制性内切酶EcoR I和BamH I将FoxAl的ORF和pGBKT7质粒分别进行双酶切,酶切产物经T4 DNA Ligase过夜连接后,转化大肠杆菌DH5α,再通过菌液PCR和酶切鉴定获得重组后的pGBKT7-FoxAl质粒。按照Y2HGold菌株使用说明,将pGBKT7-FoxAl质粒转入酵母Y2HGold菌株内,并在SD/-Trp固体培养基上30℃倒置培养3-4 d,挑取生长良好、直径约2-3 mm的酵母菌落进行PCR鉴定。取适量鉴定正确的Y2HGold(pGBKT7-FoxAl)重组菌株,以1∶100的比例稀释于0.9% NaCl溶液中,取100 μL重悬菌液分别涂布于SD/-Trp和SD/-Trp/X-α-Gal固体培养基上,30℃倒置培养2-3 d,观察菌落生长状况和显色情况。阴性对照为Y2HGold和Y2HGold(pGBKT7)菌株按同等比例稀释后,生长于SD/-Trp/X-α-Gal固体培养基上。
1.2.2 FoxAl蛋白和CYP6B6启动子的结合反应 按照赵洁等[22]的文献,经表达、纯化和超滤获得融合蛋白His-FoxAl。按照DIG-High Primer DNA Labeling and Detection Starter Kit II的说明书制备CYP6B6启动子HE1片段的核酸探针,并检测探针的标记效率。按照EMSA/Gel-Shift结合缓冲液的步骤进行HE1探针(1 ng)和FoxAl蛋白(1 μg或1.5 μg)的结合反应,参考Michael R. Green的《Molecular Cloning:A Laboratory Manual》第二章方案3制备5%的非变性聚丙烯酰胺凝胶,并进行DNA-蛋白质复合物的核酸电泳。利用浸没式转印电泳仪将HE1探针转移至带有正电荷的尼龙膜上,并进行紫外线交联固定。按 照DIG-High Primer DNA Labeling and Detection Starter kit II的步骤进行HE1探针的免疫印迹和化学发光成像。此外,为了避免假阳性的阻滞结果,进行未标记探针和无关基因片段的冷竞争反应,分别在结合反应体系中再加入标记探针100倍量的未标记HE1片段或棉铃虫肽聚糖识别蛋白(Peptidoglycan recognition proteins,PGRP-B)基因片段。
1.2.3 FoxAl-dsRNA处理棉铃虫5龄幼虫 以棉铃虫FoxAl的ORF为模板,经PCR扩增和产物回收获得含有T7启动子的目的片段,按照T7 RiboMAX Express RNAi System试剂盒的操作步骤合成和纯化获得FoxAl的dsRNA。取当天蜕皮的5龄幼虫饥饿2 h后冰上麻醉20 min,在幼虫腹部第6节和第7节的节间膜处,用微量注射器将FoxAl 的dsRNA注入幼虫体腔内,dsRNA为5 μg/头,对照组注射等量的Nuclease-free water。注射结束后,将棉铃虫幼虫置于35 mm的培养皿内,在幼虫恢复正常活动后放置于含有人工饲料的玻璃管内,使其在正常环境条件下生长。
1.2.4 2-TD胁迫处理棉铃虫6龄幼虫 将所需2-TD溶于60℃预热的10%乙醇溶液中,充分融化后添加于等质量的棉铃虫人工饲料中,分别配制成不同剂量(0,5,10和20 mg/g)的处理饲料。取当天蜕皮的6龄幼虫饥饿2 h后,放置于含有不同2-TD剂量饲料的玻璃管内,使其在正常环境条件下生长。
1.2.5 qPCR检测FoxAl和CYP6B6的表达谱 在dsRNA注射后的不同时间(24,48,72和 96 h)和2-TD处理后的不同时间(6,12,20,30和48 h),取3头仍然存活的幼虫的中肠组织作为一个生物学样本,按照EasyPure RNA Kit和EasyScript First-Strand cDNA Synthesis SuperMix的操作步骤提取中肠的总RNA,并反转录为相对应的cDNA,每个处理包含3个生物学样本。按照PerfectStart Green qPCR SurperMix(+Dye I)的说明书,以棉铃虫Tubulin作为内参基因,经qPCR技术分别检测FoxAl和CYP6B6的相对表达情况,每个生物学样本包含3个技术重复。qPCR反应体系为10.0 μL的2×SYBR Green PCR master mix、8.0 μL的RNase-free H2O、0.5 μL的上游引物、0.5 μL的下游引物、1.0 μL的cDNA。反应 程 序:94℃ 2 min;94℃ 30 s,58℃ 30s,40个循环。FoxAl引物F:5'-TGATGCCGTTGAGAAGACTA-3';R:5'-CACTTTCCCTGACCACTTG-3'。Tubulin引 物F:5'-TCCAACTCACACACTCGCT-3';R:5'-GGAAGCAGATGTCGTATAATG-3'。CYP6B6引物F:5'-TTCAAACTTATACCATGTCCACAA-3';R:5'-CCAATTGACGGAGCTCTAGAATCA-3'。
1.2.6 数据分析 在每个处理时间点,RNAi试验中以Nuclease-free water组为对照,2-TD胁迫试验中以0 mg/g组为对照,用2-ΔΔCt法计算FoxAl和CYP6B6的相对表达量。运用Prism 8.0软件进行统计分析:RNAi试验,在每个时间点进行t检验(Student’s t test);2-TD胁迫试验,在每个时间点和每个浓度下都进行单因素方差分析(one-way ANOVA)和多重比较(Tukey法)。运用SPSS 20.0软件,将2-TD胁迫试验中FoxAl和CYP6B6的相对表达量,按照不同胁迫浓度和不同胁迫时间进行相关性分析。
2 结果
2.1 棉铃虫FoxAl的转录激活功能验证
将棉铃虫FoxAl的ORF连接至酵母表达载体pGBKT7质粒,构建的重组质粒pGBKT7-FoxAl经EcoR I和BamH I酶切,图1-A电泳结果显示酶切片段小于1 000 bp、大于500 bp,其位置与FoxAl ORF(669 bp)的大小一致,表明重组质粒pGBKT7-FoxAl构建成功。将重组质粒转入酵母Y2HGold菌株感受态后,进行酵母菌落PCR,图1-B结果显示扩增条带略小于750 bp,其位置与FoxAl ORF的大小一致,表明酵母菌株Y2HGold(pGBKT7-FoxAl)构建成功。随后,将构建好的Y2HGold(pGBKT7-FoxAl)菌液涂布于SD/-Trp和SD/-Trp/X-α-ga1培养基上,通过颜色变化检测FoxAl蛋白对酵母MEL1报告基因是否有激活作用。图1-C结果显示,将两个对照Y2HGold和Y2HGold(pGBKT7)的菌液直接涂布于SD/-Trp/X-α-ga1培养基上,前者不能生长、后者正常生长但无颜色变化,对照组的结果符合预期,表明整个转化过程正常且无污染;将Y2HGold(pGBKT7-HaFoxAl)菌液涂布于SD/-Trp和SD/-Trp/X-α-ga1培养基上,酵母菌落正常生长且大小合适,表明插入基因能正常表达,同时该菌液在X-αga1诱导下呈现蓝色,表明FoxAl蛋白本身含有转录激活结构域,能激活酵母体内下游基因的正常表达。
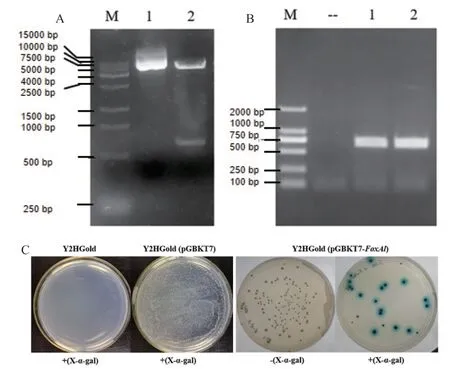
图1 酵母Y2HGold(pGBKT7-FoxAl)菌株的转录激活功能检测Fig.1 Transcriptional activation test of transformed yeast Y2HGold(pGBKT7-FoxAl)strain
2.2 棉铃虫FoxAl与CYP6B6启动子HE1片段结合
首先,用地高辛标记的HE1探针与有活性的His-FoxAl蛋白进行凝胶迁移率检测,图2-A的结果显示,1 μg和1.5 μg的His-FoxAl蛋白都能与1 ng HE1探针结合并形成阻滞条带。随后,通过无关基因片段和未标记探针的冷竞争反应,进一步验证1 ng HE1探针与1 μg His-FoxAl蛋白结合形成阻滞条带的真实性。图2-B的结果显示,泳道3在反应体系中再加入标记探针100倍量的棉铃虫PGRP-B片段时,HE1探针与FoxAl蛋白形成的阻滞条带仍然存在;而泳道4中再加入100倍量的未标记HE1片段时,原有的HE1-FoxAl阻滞条带消失不见;这两个竞争反应结果表明,FoxAl蛋白与CYP6B6启动子HE1片段的结合是特异性的,是通过FoxAl蛋白的识别螺旋与HE1片段的特定碱基以氢键形式结合。

图2 棉铃虫FoxAl蛋白与CYP6B6启动子HE1片段的结合验证Fig. 2 Verification of FoxAl in H. armigera binding to the HE1 fragment of CYP6B6 promotor
2.3 棉铃虫FoxAl沉默对CYP6B6表达水平的影响
将5 μg的FoxAl dsRNA注射到棉铃虫5龄幼虫体内,在注射后的24、48、72和96 h,检测中肠内FoxAl和CYP6B6的表达量变化情况。图3-A的FoxAl相对表达量结果显示:与对照组相比,注射FoxAl dsRNA后中肠内的FoxAl表达量从48 h开始显著降低(P=0.001 8),并在96 h降至最小值(P=0.000 6);图3-B的CYP6B6相对表达量结果显示:与对照相比,FoxAl dsRNA处理后CYP6B6的表达从24 h开始显著降低(P=0.001 9),在48 h降至最小值(P<0.000 1),并在96 h内一直被显著降低(P=0.008 2)。

图3 FoxAl dsRNA 注射后棉铃虫5龄幼虫中肠内FoxAl和CYP6B6的相对表达量Fig. 3 Relative expression of FoxAl and CYP6B6 in the midgut of 5th instar larvae after FoxAl dsRNA injected
2.4 2-TD处理对棉铃虫中肠FoxAl和CYP6B6表达水平的影响
用3种浓度的2-十三烷酮(2-TD)处理棉铃虫六龄幼虫,检测中肠内FoxAl和CYP6B6的表达量变化情况。图4-A的FoxAl相对表达量结果显示:在5 mg/g的2-TD处理组内(F=5.180,P=0.001 9),12 h的表达量最高、30 h的表达量最低,且30 h时显著低于空白组(P=0.003 5);在10 mg/g的2-TD浓度下(F=12.86,P<0.000 1),12 h的表达量最高、48 h的表达量最低,6 h时极明显高于对照(P<0.000 1), 20,30和48 h时 显 著 低 于 对 照(P=0.027 5,P=0.001 4,P=0.042 7);在20 mg/g处理中(F=11.27,P<0.000 1),12 h的表达量最高、48 h的表达量最低,12 h时显著高于空白对照(P=0.013 1)、而20和48 h时明显低于空白对照(P=0.006 3,P=0.027 3)。在3个2-TD浓度处理组内,棉铃虫FoxAl表达量随时间变化基本一致,都是短时间内表达量上升、至12 h达到最高值,然后在20 h表达量快速下降。
CYP6B6的相对表达量结果显示:在5 mg/g的2-TD处理后(F=5.016,P=0.002 3),20 h的表达量最高、30 h的表达量最低,且20 h时明显高于对照(P=0.023 6);在10 mg/g 2-TD处理组(F=33.63,P<0.000 1),12 h的表达量最高、48 h的表达量最低,12 h时显著高于对照(P=0.037 3),30和48 h时显著低于对照(P=0.043 1,P=0.023 4);在20 mg/g的处理中(F=12.95,P<0.000 1),12 h的表达量最高、48 h的表达量最低,12 h时极显著高于空白对照(P=0.000 8)。在3个2-TD浓度处理后,CYP6B6表达量随时间变化基本相似,都是在12 h内急剧升高、在20 h内基本维持高水平表达,然后在30 h迅速下降(图4-B)。
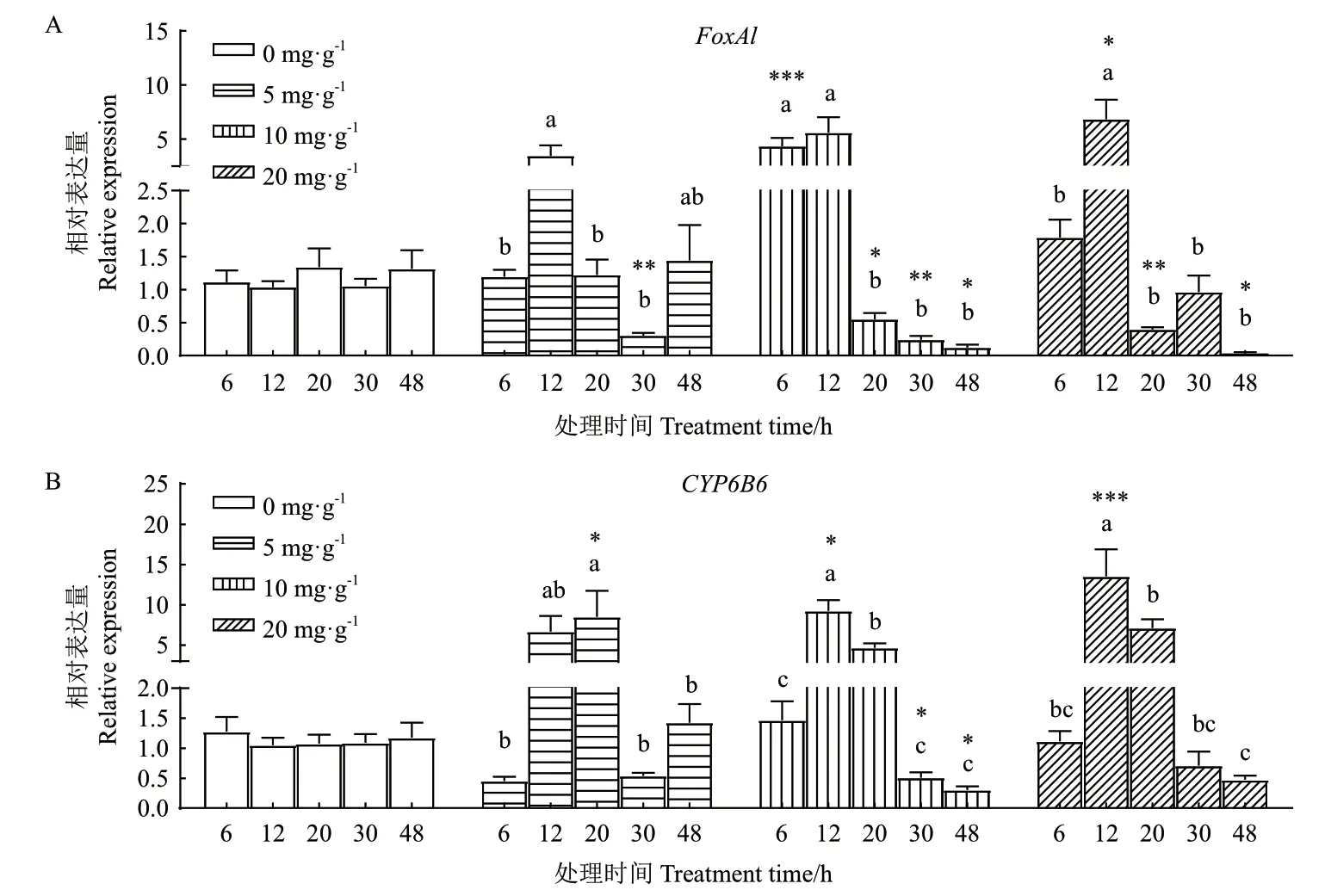
图4 2-TD胁迫后棉铃虫6龄幼虫中肠内FoxAl和CYP6B6的相对表达量Fig. 4 Relative expression of FoxAl and CYP6B6 in the midgut of the 6th instar larvae after 2-TD treated
将不同2-TD浓度处理后的FoxAl和CYP6B6的相对表达量进行相关性分析。表1结果显示,3个胁迫浓度下FoxAl和CYP6B6的表达量都是正相关的,两者的相关系数随着2-TD浓度增加逐渐增大,并且在20 mg/g浓度处理时两者呈显著地高度正相关(r=0.819,P=0.045);除了20 h以外,其他胁迫时间点下FoxAl和CYP6B6的表达量都是正相关的,12 h、30 h和48 h时两者的表达量是高度正相关(r=0.987,r=0.863,r=0.978),其中12 h和48 h时都是显著相关(P=0.007,P=0.011)。

表1 FoxAl和CYP6B6表达量的相关性分析Table 1 Correlation analysis of FoxAl and CYP6B6 expression
3 讨论
课题组前期分析棉铃虫FoxAl蛋白的氨基酸序列时,发现该蛋白只含有一个完整的FH结构域,不包括FoxA亚家族的两个转录激活域[22]。为了明确FoxAl蛋白是否具有转录激活活性,本研究通过酵母自激活试验证明了该蛋白能够激活MEL1报告基因的转录,从而使酵母菌株在缺陷培养基上正常生长并显蓝色。作为棉铃虫体内一个新的Fox家族基因,FoxAl的具体功能与蛋白结构密切相关,因此后期还将进一步明确FoxAl蛋白中主要的转录激活区域以及相关位点。
已有研究表明,在外界物质的刺激下,昆虫Fox蛋白的表达量会迅速上升并进入细胞核内,调控下游基因的转录[14]。例如用一种大环内酯类免疫抑制剂—雷帕霉素饲喂果蝇Drosophila成虫,其肠道内FoxA的表达量升高并大量入核,FoxA激活Diptericin和Metchnikowin基因的转录,表达两种肠道抗菌肽,从而参与果蝇免疫系统[10]。本研究在植物次生物质的胁迫下,棉铃虫体内FoxAl的表达量变化情况。结果显示3种低浓度(5,10和20 mg/g)的2-TD胁迫6龄幼虫后,中肠内FoxAl的表达量在12 h内迅速升高,并在20 h迅速降低,随着胁迫时间的延长,该基因mRNA含量基本维持稳定。目前棉铃虫FoxAl的抗体正在制备中,后期将从蛋白质水平进一步证实FoxAl的表达情况。
细胞色素P450是昆虫体内一种重要的解毒酶系。大量研究表明,P450基因过量表达是昆虫产生抗药性的机制之一,其中CYP6亚家族与植物次生物质和杀虫剂的耐受性密切相关[23-24]。例如2-TD能诱导棉铃虫体内CYP6B7基因的过量表达,并使棉铃虫对拟除虫菊酯产生抗性[25-26]。根据已发表的文章,多次证实低浓度(<50 mg/g)的2-TD短期胁迫棉铃虫幼虫后,中肠组织内CYP6B6的蛋白含量能迅速增加,并参与解毒代谢过程[19-21]。本研究利用低浓度的2-TD处理棉铃虫6龄幼虫不同时间后,检测中肠内CYP6B6的表达量,本试验结果与前人的研究结果相似,3个2-TD浓度都能快速提高CYP6B6的mRNA含量,而随着胁迫时间延长,CYP6B6的表达量都会逐渐降低。在处理30 h-48 h的时间段内,与空白对照组相比,5和10 mg/g处理组的幼虫取食量减少,而20 mg/g处理组的幼虫大量提前预蛹,其中部分幼虫的中肠组织缩短、颜色加深,甚至呈现粉红色。这些现象表明,即使是低浓度的2-TD,长时间胁迫也会降低幼虫的解毒能力,甚至影响棉铃虫的生长发育。
在预蛹的果蝇转化品系P[hs-Fkh111]中,37℃热处理增加唾腺中FoxA的含量后,发现下游P450基因的表达发生改变,其中CYP9B2,CYP6A20和CYP28D1的表达量分别提高3.88,24.39和100.87倍,而CYP4E2和CYP6V1的表达量变化倍数都为-2.15[27]。同时在前期进行CYP6B6启动子分析时,预测出大量的Fox蛋白结合位点。因此,我们推测新的棉铃虫FoxAl蛋白也许能与CYP6B6启动子结合,从而响应植物次生物质胁迫。本研究通过凝胶阻滞试验证实了该假设,棉铃虫FoxAl蛋白能与CYP6B6启动子的核心序列HE1片段结合。通过多种软件的进一步筛选,HE1片段中可能与FoxAl蛋白结合的位点有3个,后期将通过截断HE1片段,进一步缩小FoxAl蛋白的结合范围,同时合成相应的突变探针,明确FoxAl蛋白的具体结合位点。
本研究通过腹腔注射法沉默幼虫中肠内FoxAl的表达后,CYP6B6的表达量也发生显著降低,这说明FoxAl蛋白对CYP6B6的转录调控是正向的。此外,2-TD胁迫后FoxAl和CYP6B6的表达量变化趋势基本相似,对两者的表达量进行相关性分析,结果显示二者总体是正相关的,甚至在20 mg/g处理浓度、以及12,30和48 h处理时间都是高度正相关,该结果表明FoxAl可能是CYP6B6的转录激活因子,正向调控CYP6B6的表达。值得注意的是,在处理20 h后FoxAl的表达量显著降低,而CYP6B6依然高水平地表达,两者的表达量呈低度负相关。转录因子FoxAl表达量出现拐点的时间(12 h)早于下游基因CYP6B6出现的时间(20 h),在此时间段内可能还有其它转录激活因子或辅因子,使CYP6B6持续过量表达。同时,因为检测点相隔时间较长,后期将进一步缩短间隔时间,细化FoxAl和CYP6B6的表达量变化情况。
4 结论
棉铃虫FoxAl蛋白能与CYP6B6启动子结合,并且在有毒物质胁迫下,FoxAl蛋白可能是CYP6B6的转录激活因子。