高成模率和高稳定性的小鼠2型糖尿病阴证创面模型制备方法❋
2022-06-09侯铖宇周忠志胡荣耀周佳俞宋艳雯叶永鑫张欢欢奉水华
侯铖宇, 陈 丽, 周忠志, 刘 泽, 胡荣耀, 扶 凯, 周佳俞, 宋艳雯,叶永鑫, 张欢欢, 奉水华△
(1.湖南中医药大学, 长沙 410208;2.湖南中医药大学第一附属医院, 长沙 410007)
糖尿病慢性难愈性创面是糖尿病常见的并发症,发生率可达30%[1]。其临床表现与中医因阳虚所致的阴证创面的症状极为相似,具有迁延难愈、发病率高、修复难度大等特点,属于中医学“阴疽”范畴,如果治疗不及时会严重影响患者生活与工作甚至导致截肢,因此其治疗一直受到广大医务工作者的重视。近年来,各种治疗药物及相关技术取得了良好的临床效果,如回阳生肌膏[2]、生肌玉红膏[3]、负压引流技术[4]、富血小板血浆[5]、自体微粒皮移植[6]等。以上药物或方法虽然临床治疗效果明显,但由于缺乏规范统一且成模率高的动物模型,使得其具体作用机制尚未被完全阐明。因此,本试验旨在通过构建高成模率和稳定性小鼠2型糖尿病阴证创面模型,为深入研究与糖尿病阴证创面治疗相关的药物、技术及其作用机制奠定基础。本研究通过湖南中医药大学实验动物中心伦理委员会批准(批号LL2020071402)。
1 材料与方法
1.1 动物
SPF级雄性C57BL/6小鼠80只,6~8周龄,体质量(18±2) g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号SCXK(湘)2019-0004。饲养及实验操作于湖南中医药大学动物实验中心,温度20 ℃~22 ℃,相对湿度40%~60%,12 h光照,12 h避光循环。
1.2 主要试剂及仪器
高脂乳剂由精制猪油、胆固醇(货号B73872)、6-正丙基-2-硫代尿嘧啶(货号S30643)、胆酸钠(猪,货号S30219)、吐温-80(货号S15020)、1,2-丙二醇(货号20191125)配制而成,上海源叶生物科技有限公司;链脲佐菌素(sterptozotocin, STZ,货号S8050)、0.1%柠檬酸钠缓冲液(货号C1010),北京索莱宝科技有限公司;氢化可的松注射剂(20 mL:100 mg,国药准字H20023068),国药集团容生制药有限公司。
血糖仪及配套试纸(批号GA-3),三诺生物传感股份有限公司;数码照相机(型号DSC-HX99),日本SONY公司。
1.3 高脂乳剂和STZ注射液配置方法
1.3.1 配制高脂乳剂 以配置500 mL高脂乳剂为例,水浴锅温度设置为60 ℃以备后续加热。先称量50 g胆固醇,分次加入研钵中,充分研磨至无胆固醇晶体亮片(为防止损害小鼠的食管和胃黏膜),研磨完成后再进行1次校量。将100 g猪油放入水浴锅中加热的洁净烧杯中,并将研磨好的胆固醇缓慢加入边加边搅(注意不要过分用力以防激荡飞溅引起误差)。待胆固醇完全混匀后,向烧杯内依次加入1 g丙硫氧嘧啶和10 g胆酸钠(注意这2种试剂极易吸湿,需现称现用)。充分混匀后依次加入100 mL吐温80和100 mL丙二醇。将烧杯内已混匀的乳剂倒入玻璃瓶(注意还要将烧杯中残余的乳剂用纯净蒸馏水洗涤后倒入),并缓慢定容至500 mL。
1.3.2 配置STZ注射液 将5 mL 0.1%柠檬酸钠缓冲液分次注入装有100 mg STZ粉末的棕色瓶中,每次注入后充分抽吸混匀并转移至事先准备好且置于冰上预冷的避光EP管中,重复上述步骤直至STZ完全溶解。注意STZ的pH值需维持在4.2~4.5之间才能确保最佳功效,且STZ在室温下极易分解,要求在15~30 min内使用完毕。
1.4 分组与造模方法
随机选取20只小鼠纳入非糖尿病创面组(非糖组),其余小鼠进行2型糖尿病造模。将造模成功且体质量、血糖浓度较接近的小鼠再次随机分为糖尿病一般创面组(糖创组)、糖尿病阴证创面组(阴创组)每组各30只。
1.4.1 建立2型糖尿病模型 糖创组与阴创组所有小鼠按0.4 mL/d 给予高脂乳剂灌胃,非糖组按0.4 mL/d给予纯水灌胃,连续14 d。灌胃完成后,糖创组与阴创组所有小鼠禁食不禁水12 h以上,将现配的STZ注射液在尽量避光的环境下按180 mg/kg 腹腔注射,非糖组小鼠以相同剂量腹腔注射0.9%氯化钠溶液。注射完成后继续禁食不禁水4 h以上,随后恢复正常饲养。48 h~72 h后尾静脉采血测定各组小鼠血糖值,若血糖值连续3 d>16.7 mmol/L,且糖耐量试验阳性(3组小鼠注射等量葡萄糖15、30、60和120 min后测定血糖值),则认为2型糖尿病模型建立成功。此后可视情况使用高脂乳剂灌胃维持血糖水平[7]。
1.4.2 建立2型糖尿病阴证模型 2型糖尿病模型造模成功后,将阴创组小鼠按2 mL/kg剂量,连续2 d左右腿交替肌肉注射氢化可的松注射液,非糖组及糖创组小鼠注射0.9%氯化钠溶液。若小鼠出现喜静、懒动、蜷卧、毛发粗糙无光泽、便溏、体质量下降、纳食差等阴证症状,则认为糖尿病阴证造模成功。
1.4.3 建立2型糖尿病阴证创面模型 2型糖尿病阴证模型造模成功后,将3组小鼠用10%水合氯醛按3 mL/kg进行腹腔注射麻醉,在腰背部位置用剃毛器联合脱毛膏形成一个2 cm×2 cm大小的正方形裸皮区域,依次用络合碘和75%乙醇消毒,然后采用打孔器在小鼠背部标记区域形成一个直径为10 mm的圆形全层皮肤缺损创面,则认为小鼠2型糖尿病阴证创面模型建立成功。创面制备完成后将小鼠放在电热毯上保温,以提高存活率。
经过以上3次造模最终成功建立2型糖尿病阴证创面小鼠模型。在所有步骤完成后,用医用无菌纱布“丰”字型包裹创面,每日更换纱布1次,以防止木屑、排泄物及其他有害物污染创面。
1.5 指标检测
1.5.1 一般情况 观察各组小鼠血糖、糖耐量、体质量、饮食、饮水、毛发光泽与死亡率等情况。
1.5.2 创面情况 局部观察创面大体情况,肉眼观察创面渗出物、肉芽颜色、水肿形成、创缘、创面结痂情况。
创面修复率:在相应造模时间点用外科标尺置于创面同一位置相机拍照,Image J图像分析软件获取创面面积数据,从而计算出修复面积所占百分比:创面修复率=(原创面面积-相应观察时间点创面面积)/原创面面积×100%,测量时间点分别为阴证造模后1 h及阴证创面造模后第3、7、14天。
1.6 统计学方法
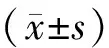
2 结果
2.1 各组小鼠血糖结果
图1示,糖尿病造模前3组小鼠随机血糖浓度均在正常范围内(3.9~6.1 mmol/L)。糖尿病造模后,糖创组与阴创组小鼠血糖浓度明显高于非糖组,基本维持在16.7~19.5 mmol/L。
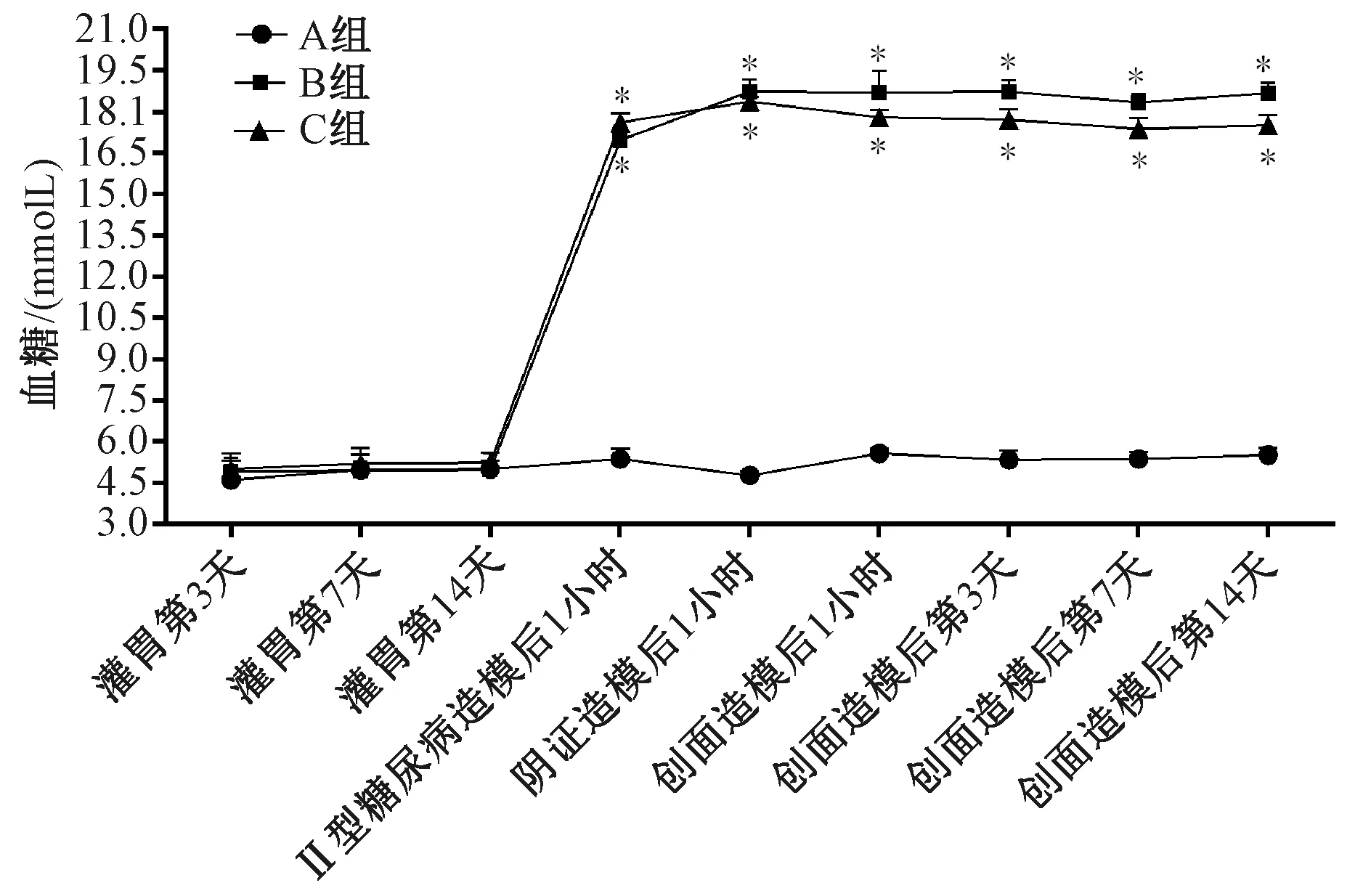
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较:*P<0.05图1 各组小鼠造模前后血糖情况比较
2.2 各组小鼠糖耐量测定结果
图2示,对诱发糖尿病的小鼠进行糖耐量测试,结果与非糖组比较,糖创组与阴创组小鼠注射葡萄糖15、30、60和120 min后血糖值显著提高,差异有统计学意义(P<0.05),且一直处于较高水平,至120 min时仍未能恢复到正常水平。糖尿病成模率可达93%~95%。
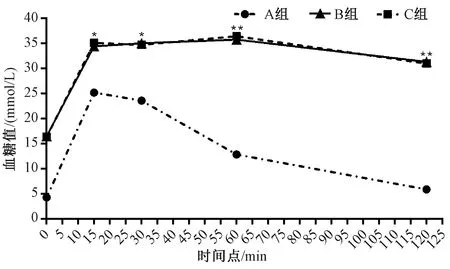
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较:*P<0.05,**P<0.01图2 各组小鼠造模前后糖耐量试验血糖比较
2.3 各组小鼠造模前后一般情况比较
非糖组造模前小鼠毛发黑亮,行动敏捷,体质量、饲料量和饮水量呈正常增长;创面造模后,小鼠活动稍缓,体质量、饲料量和饮水量继续增长。第3天创面干燥,创缘充血;第7天创面修复明显,痂皮缩小且较薄;第14天创面残存少许痂壳,基本修复(见图3~图6)。
糖创组造模前小鼠一般状态良好,糖尿病造模后小鼠毛发杂乱、行动迟缓。创面造模后第3天逐渐出现典型的糖尿病症状,多饮、多食、体质量下降,创面色红,创缘轻微红肿,有少量脓液渗出;第7天创面痂皮较厚大伴少量污秽物;第14天创周痂皮厚积,有修复迹象(见图3~图6)。
阴创组造模前小鼠一般状态良好;糖尿病造模后逐渐出现典型的糖尿病症状;阴证造模后,小鼠毛发杂乱污秽、行动迟缓,糖尿病阴证症状突出。创面造模后第3天创面周围肿胀淡白,有稀薄脓液;第7天创缘色淡,痂皮大;第14天创面色泽晦暗污秽,修复迟缓(见图3~图6)。
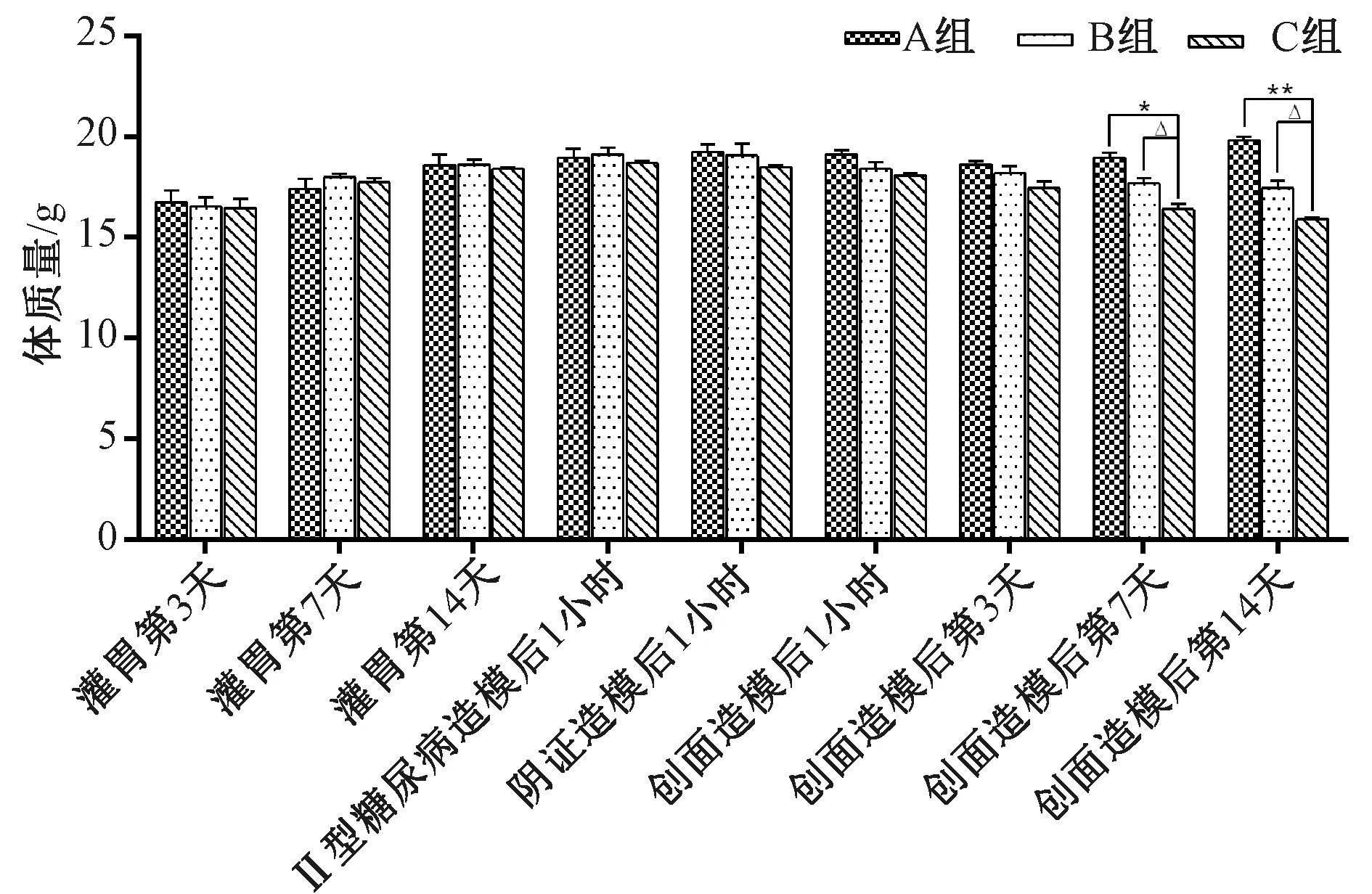
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较:*P<0.05,**P<0.01;与B组比较:△P<0.05图3 各组小鼠造模前后体质量比较
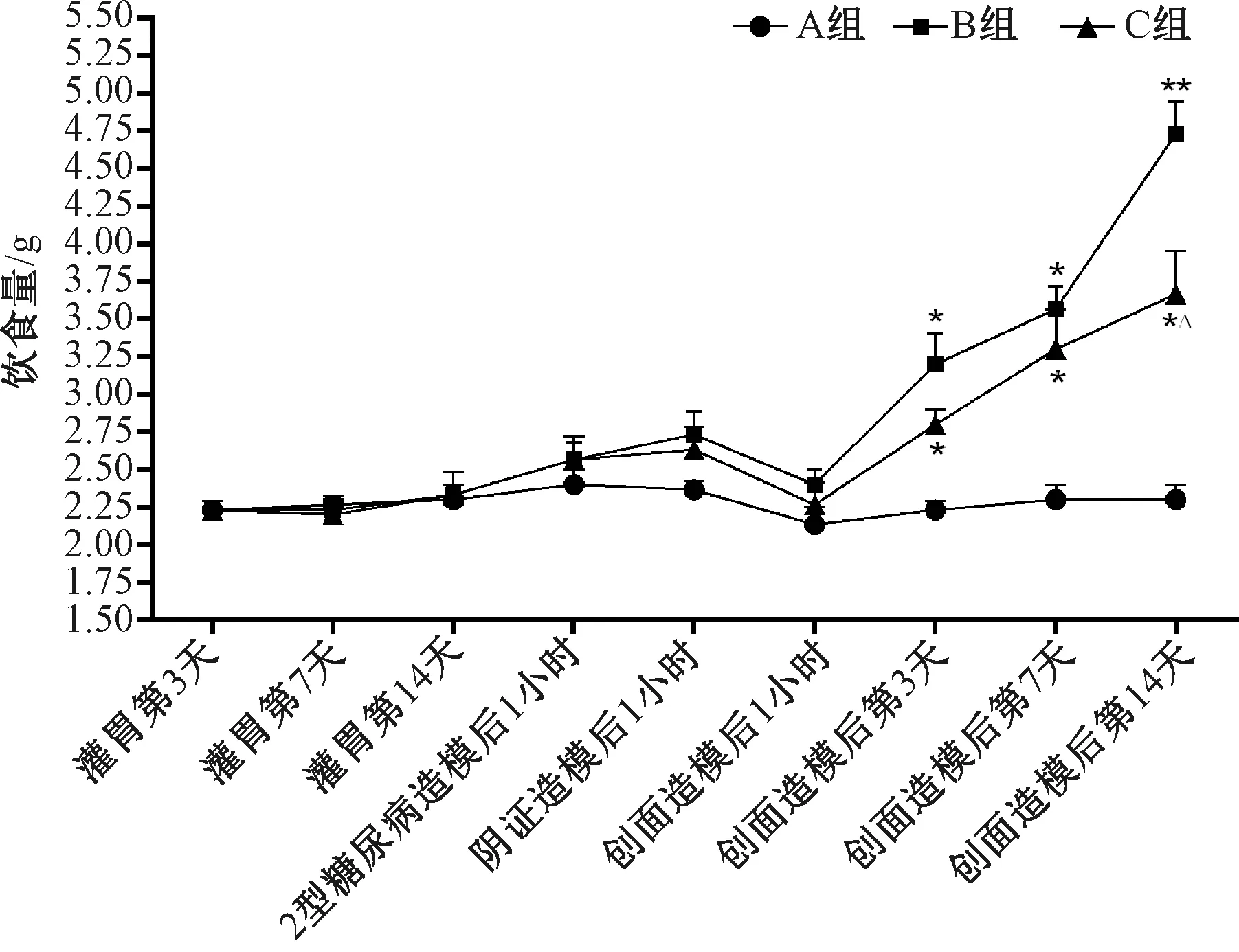
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较:*P<0.05,**P<0.01;与B组比较:△P<0.05图4 各组小鼠造模前后饮食量比较
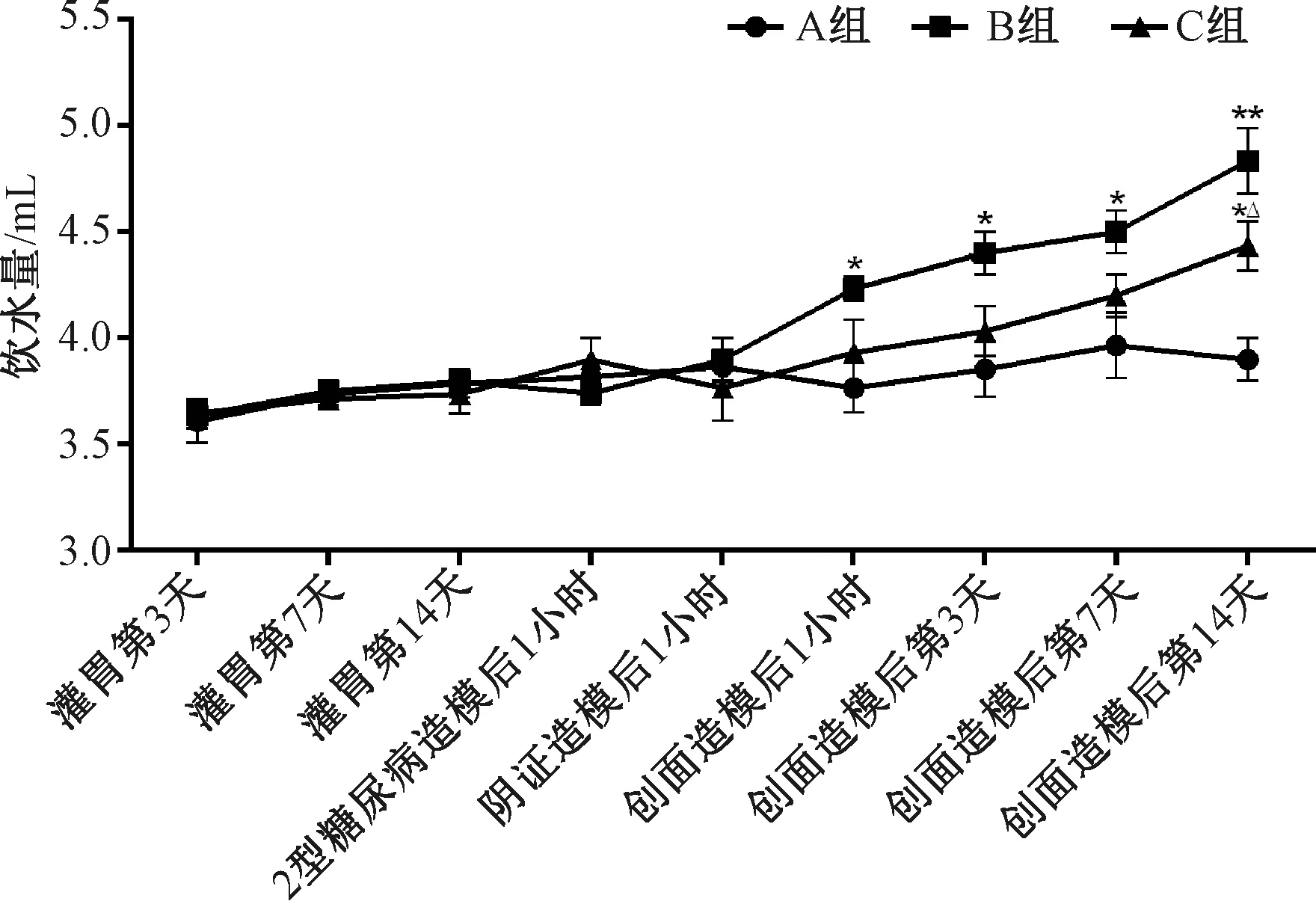
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较*P<0.05,**P<0.01;与B组比较△P<0.05图5 各组小鼠造模前后饮水量比较
2.4 各组小鼠创面修复率
糖创组与阴创组小鼠第7、14天创面修复速率均显著低于非糖组(P<0.05);阴创组第14天创面修复速率显著低于糖创组(P<0.05)(见图7)。
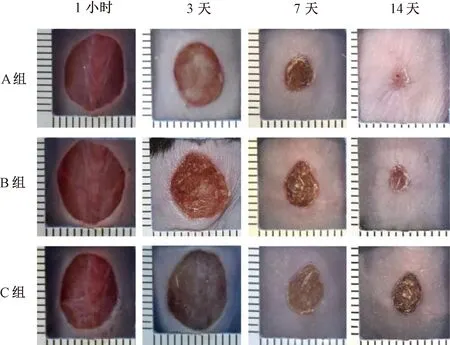
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组)图6 各组小鼠创面造模后大体情况比较
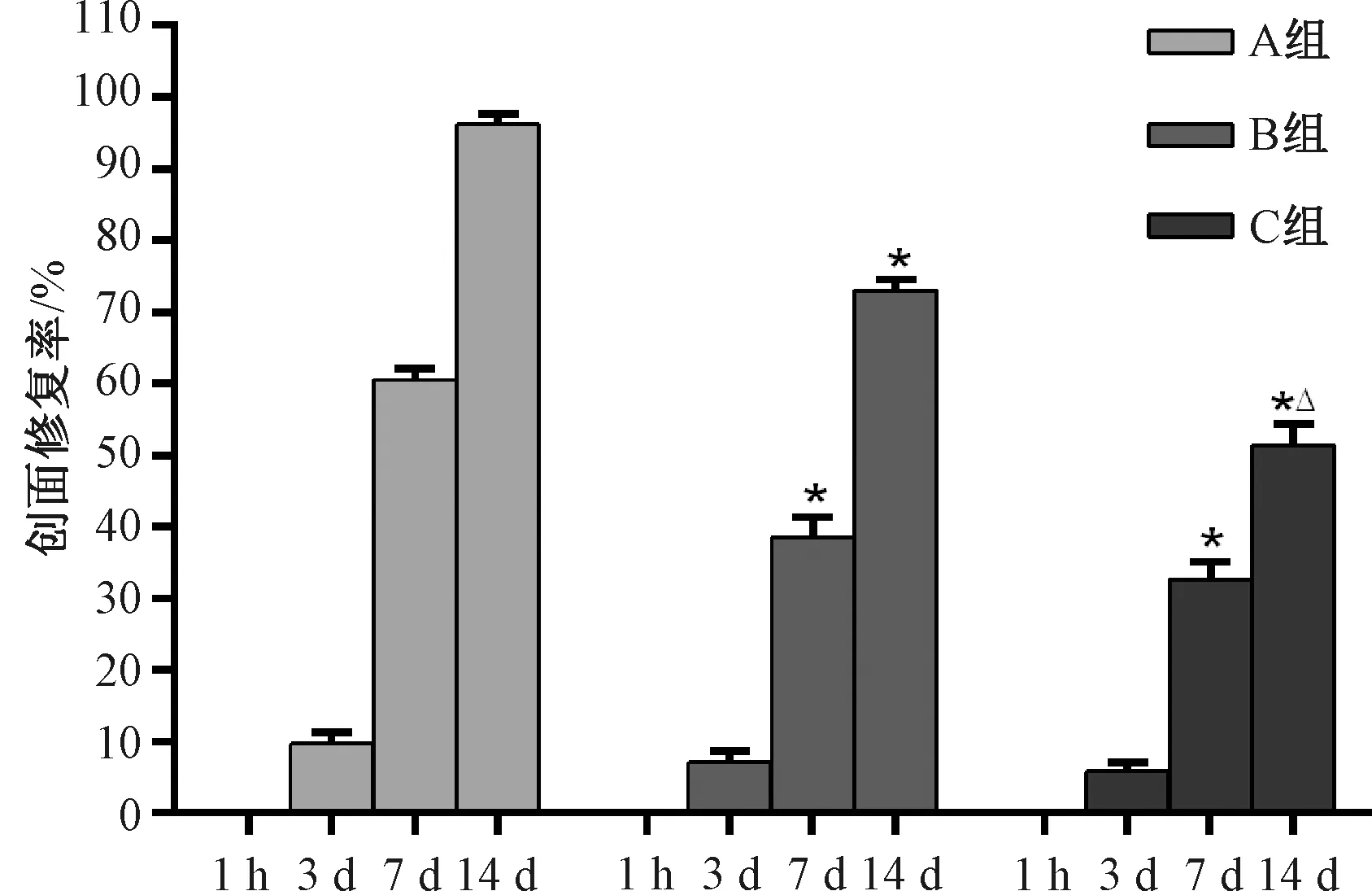
注:A组为非糖尿病创面组(非糖组),B组为糖尿病一般创面组(糖创组),C组为糖尿病阴证创面组(阴创组);与A组比较:*P<0.05;与B组比较:△P<0.05图7 各组小鼠创面造模后修复率比较
2.5 各组小鼠死亡率
糖创组小鼠死亡率10%,阴创组小鼠死亡率为15%(见表1)。
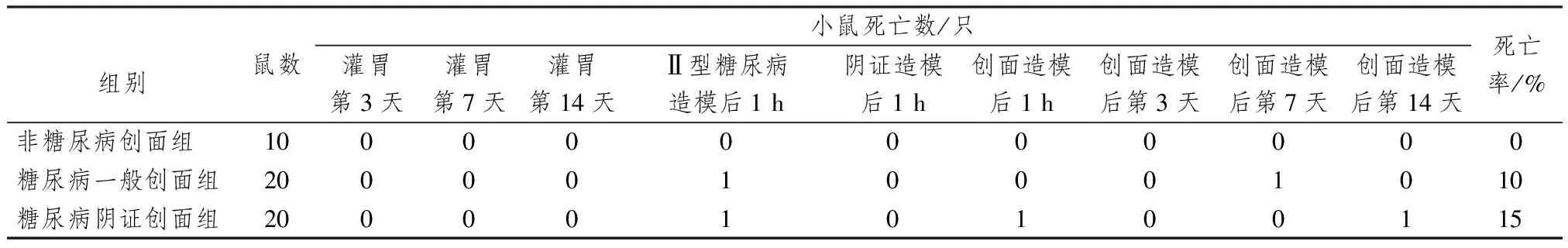
表1 各组小鼠造模期间死亡率
3 讨论
目前,糖尿病阴证创面动物模型的构建方法尚未统一,且成模率和稳定性较低。据此本实验在前人基础上进行改良与优化,结果发现通过3次造模(即高脂乳剂灌胃联合STZ诱导+氢化可的松干预+创面)能成功建立高效且稳定的小鼠2型糖尿病阴证创面模型。
本实验采用高脂乳剂灌胃联合STZ制备2型糖尿病模型。研究发现,高脂饮食可引起糖脂代谢异常,降低胰岛素敏感性,诱发胰岛素抵抗[8]。STZ对小鼠等动物的胰岛β细胞具有选择性破坏作用[9],可导致胰岛素分泌减少,从而诱发小鼠发生糖尿病。有学者使用高脂饲料喂养大鼠,发现可以产生以高血糖为特征的胰岛素抵抗[10]。但高脂饲料存在费用高、消耗大、浪费多等现象,并且每只大鼠所食用的高脂饲料量均不相同,其形成的胰岛素抵抗程度也不同[11],间接增加了实验的变量。而本实验采用高脂乳剂灌胃给药,大大减少了材料浪费,降低了实验费用,并且有效地控制了变量。研究发现,STZ剂量、给药次数以及给药方式的不同诱导小鼠产生的糖尿病模型及效果也不尽相同[12]。目前,腹腔注射和静脉注射是STZ诱导实验性糖尿病动物模型的2种常用注射方法[13]。STZ静脉注射成模率虽高,但对于操作者要求较高,不仅要准确找到尾静脉,还需控制好给药速率,否则注射过快易引起心力衰竭[14]。相比之下,腹腔注射方法更简捷,易于掌握。鲁珽等[15]通过给小鼠低剂量多次注射STZ的方式诱导产生2型糖尿病。然而本试验前期研究发现,在低剂量多次注射STZ诱导糖尿病模型的过程中,小鼠死亡率较高且成模率不理想。因此,本实验在高脂乳剂连续灌胃的基础上,联合STZ一次性腹腔注射诱导建立2型糖尿病小鼠模型。实验发现,一次性以180 mg/kg注射STZ 3 d后,小鼠随机血糖可>16.7 mmol/L,并逐渐出现多饮、多食、体质量下降、垫料潮湿的现象。同时糖耐量试验发现,糖创组、阴创组与非糖组比较,注射葡萄糖后血糖值均有显著性提高,至120 min时仍在较高水平,说明本实验成功建立了2型糖尿病模型。此外,本实验的改良之处在于高脂乳剂配置过程中胆固醇晶体的充分研磨,既可以减少对小鼠食道、胃黏膜的损伤,还可以有效避免高脂饲料导致的肠胀气、肠梗阻等并发症;高脂乳剂灌胃采用小鼠中药专用直针,并且在抽高脂乳剂时边抽边旋转,可以提高灌胃速度与灌胃成功率,减少对小鼠的伤害,保证了后期实验成模率;由于STZ的活性不太稳定,所以STZ相关试剂配置等操作在冰浴、避光环境下进行,可以确保STZ的高活性;STZ注射液在pH值4.2~4.5时功效最佳,而将100 mg STZ溶于5 mL 0.1%柠檬酸钠缓冲液中可以保证STZ的 pH值稳定。
本实验采用氢化可的松制备2型糖尿病阴证模型。研究发现,过量应用糖皮质激素可抑制蛋白质合成,使肌肉萎缩、伤口愈合迟缓[16],对于建立阴证模型极为重要。有学者发现,给小鼠肌肉注射4 mL/kg的氢化可的松可建立慢性难愈性创面模型[17]。但实验发现,4 mg/kg氢化可的松浓度较高,短期内可使小鼠致瘸,严重者甚至局部肌肉坏死或失明。因此,在2型糖尿病小鼠模型的基础上对氢化可的松剂量进行改进,即采用持续2 d左右腿交替肌肉注射氢化可的松(2 mL/kg)的方法,发现可以造成小鼠喜静、懒动、蜷卧、毛发粗糙无光泽、便溏等明显的阴证症状,创面造模之后的创面局部更易出现分泌物清稀、肉芽组织瘀黯或红而不泽等表现,符合2型糖尿病情况下阴证创面模型的中医证候特点。由于氢化可的松具有免疫抑制的作用,所以阴证造模组的死亡率相对升高,这也可能是由小鼠体质虚弱、糖尿病高糖环境、创面感染等多种原因共同导致的。
本实验采用打孔器制备2型糖尿病阴证创面模型。目前,糖尿病创面多经外部破坏皮肤制备,常见的有低温诱导法[18]、高温烫伤法[19]、皮肤磁片压迫法[20]等,虽然各有优点但存在可控性差、耗时较长、创面不规则等缺点,且模型死亡率较高。本研究发现,使用打孔器可在小鼠背部形成一个深达肌层的圆形全层皮肤缺损创面,其操作简单、耗时短,创面形状以及面积基本可控,可以有效减小误差,也使得后续定量测评分析更为方便。此外还发现,创面造模后将小鼠放在电热毯上保温能显著降低死亡率。
对各项指标进行观察检测后发现,糖尿病模型小鼠随着机体代谢功能失常以及受氢化可的松干预的影响,体质量从第7天开始逐渐下降,饮食、饮水量从第3天开始缓慢升高且阴创组变化更明显。阴证创面造模成功后阴创组小鼠表现出创面色泽瘀黯、痂皮污秽、脓液稀薄及修复迟缓等症状,分析原因与阳气耗竭密切相关。一方面阳虚则腠理失于温煦,创面不温;另一方面阳虚则气血不畅,易趋凝滞,瘀血阻塞经络,创面失于濡养,从而导致阴证缠绵难愈,恢复较慢。
本实验从实验经费、实验操作、模型效果及稳定性等方面进行了改良与优化,发现采用0.4 mL高脂乳剂连续灌胃14 d联合STZ一次性腹腔注射(180 mg/kg),较好地实现了从胰岛素抵抗向2型糖尿病的过渡;在2型糖尿病小鼠模型的基础上,采用持续2 d左右腿交替肌肉注射氢化可的松(2 mL/kg)的方法,可使小鼠表现出明显的“阴证”状态,再通过打孔器制造创面的方法,最终完成小鼠2型糖尿病阴证创面模型的制备。但本实验存在一定局限性,如未对小鼠的尿量进行实时检测、缺乏创面组织切片观察等,仍有待进一步深入研究。综上所述,本实验方法所构建的小鼠糖尿病阴证创面模型基本符合该病证特点,可以为相关药理及机制研究提供参考。
