LLDT-8对类风湿关节炎单核细胞向破骨样细胞转化的作用机制研究
2022-06-09严雅何东仪聂红冯伟沈逸姜婷连艳玲丁琴
严雅 何东仪 聂红 冯伟 沈逸 姜婷 连艳玲 丁琴


摘 要 目的:探討LLDT-8对类风湿关节炎骨破坏的作用机制。方法:收集取类风湿关节炎患者的外周血和关节滑液,分离外周血单个核细胞(PBMC)和关节滑液单个核细胞(SFMC)。PBMC用RANKL和M-CSF分别诱导后加入不同浓度LLDT-8干预,于24、48、72 h和14 d进行抗酒石酸酸性磷酸酶染色,显微镜下对Trap(+)细胞计数,同时收集上清检测RANKL、RANK、OPG,比较组间差异。PBMC、SFMC用不同浓度LLDT-8干预后,用ELISA方法检测不同标本中RANKL、OPG、VEGF的分泌,另外用实时PCR检测不同标本PBMC中 RANKL、OPG、VEGF、MMP-9的表达,以了解LLDT-8对骨破坏相关因子的影响。结果:LLDT-8减少PBMC向破骨样细胞的转化,促进破骨样细胞的凋亡;LLDT-8抑制VEGF的表达,上调OPG mRNA表达,同时下调VEGF、RANKL和MMP-9的表达。结论:LLDT-8促进破骨样细胞的凋亡,抑制OC的分化,降低RANKL/OPG比值,下调VEGF的表达,延缓骨破坏。
关键词 类风湿关节炎;LLDT-8;骨破坏;细胞因子
中图分类号:R2 文献标志码:A 文章编号:1006-1533(2022)08-0019-06
引用本文 严雅, 何东仪, 聂红, 等. LLDT-8对类风湿关节炎单核细胞向破骨样细胞转化的作用机制研究[J]. 上海医药, 2022, 43(8): 19-24, 41.
Study of the mechanism of Leitengshu on the transformation of rheumatoid arthritis monocytes into osteoclast like cells
YAN Ya1, HE Dongyi2, NIE Hong3, FENG Wei4, SHEN Yi2, JIANG Ting2, LIAN Yanling5, DING Qin2(1.General Practice Department of Wujing Community Health Service Center of Minhang District, Shanghai 200241, China; 2. Department of Arthritis of Guanghua Hospital of Integrated Traditional Chinese and Western Medicine Hospital, Shanghai 200052, China; 3. Shanghai Institute of Immunology of Medical School of Shanghai Jiao Tong University, Shanghai 200025, China; 4. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 5. Tianlin Community Health Service Center of Xiuhui District, Shanghai 200032, China)
ABSTRACT Objective: To explore the mechanism of Leitengshu(LLDT-8) on bone destruction in rheumatoid arthritis. Methods: Peripheral blood and synovial fluid were collected from patients with rheumatoid arthritis, Peripheral blood mononuclear cells(PBMC) and synovial fluid mononuclear cells(SFMC) were isolated. PBMCs were induced with RANKL and M-CSF, respectively, and then intervened with different concentrations of LLDT-8, tartrate-resistant acid phosphatase staining was performed at 24, 48, 72 h and 14 d, and Trap(+) cells were counted under a microscope, at the same time, the supernatant was collected to detect RANKL, RANK, and OPG, and the differences between groups were compared. After PBMC and SFMC were intervened with different concentrations of LLDT-8, the secretion of RANKL, OPG and VEGF in different samples was detected by Elisa method, in addition, real-time PCR was used to detect the expressions of RANKL, OPG, VEGF and MMP-9 in PBMC of different specimens to understand the effect of LLDT-8 on bone destruction-related factors. Results: LLDT-8 reduced the transformation of PBMCs into osteoclast-like cells and promoted the apoptosis of osteoclast-like cells; LLDT-8 inhibited the expression of VEGF, up-regulated the expression of OPG mRNA, and down-regulated the expression of VEGF, RANKL and MMP-9. Conclusion: LLDT-8 promotes the apoptosis of osteoclast-like cells, inhibits the differentiation of OC, decreases the RANKL/OPG ratio, down-regulates the expression of VEGF, and delay bone destruction.75F94995-6749-439D-AA8D-1B194A60BA7F
KEY WORDS rheumotoid arthritis; Leitengshu; bone destruction; cytokine
类风湿关节炎(rheumatoid arthritis,RA)是临床上常见的慢性、全身性自身免疫性疾病,病理基础为滑膜炎,主要表现为对称性、多发性、反复发作性关节炎[1]。雷公藤用于治疗RA已有30多年历史,有大量的临床和实验室研究证明其具有肯定的抗炎止痛、免疫调节等药理作用[2]。但雷公藤因为诸多的毒副作用使临床应用受限,故现在提取雷公藤的有效成分以提高其疗效和减低毒副作用[3]。LLDT-8,又名雷藤舒或(5R)-5-hydroxytriptolide,是中国科学院上海药物研究所对先导化合物雷公藤内酯醇进行结构修饰优化后所得的全新化合物。前期研究表明,母体雷公藤内酯醇在小鼠体外细胞毒性较LLDT-8升高122倍,在小鼠体内急性毒性升高约10倍,LLDT-8对小鼠RA模型具有优异的治疗作用[4]。在体外实验中发现,LLDT-8在25 nmol/L和50 nmol/L时可明显抑制植物血凝素(Phytohemagglutinin,PHA)抗原诱导的T细胞增殖,降低混合性淋巴细胞活性;同时减少PHA-Sac刺激的外周血单个核细胞(Peripheral Blood Mononuclear Cell,PBMC)产生干扰素-g(IFN-g),白细胞介素-2(IL)-2和肿瘤坏死因子-a(TNF-a)等细胞因子[5]。骨破坏是RA的突出表现,骨破坏的机制尚未完全阐明。目前认为,在炎症通路的启动、活化和最终导致关节破坏的过程中,破骨细胞起着重要作用[6]。在RA的骨侵蚀中,核因子κB受体活化因子配体(Receptor activator of nuclear factor-κB Ligand,RANKL)和骨保护素(osteoprotegerin,OPG)的参与已经得到证实[7]。本研究以RANKL、RANK、OPG和血管内皮生长因子(vascular endothelial growth factor,VEGF)为研究靶点,探讨LLDT-8预防治疗RA骨破坏的作用机制。
1 材料与方法
1.1 一般资料
实验对象为光华医院的RA住院患者,其中内科患者男性5例,女性25例,年龄(51.58±15.24)岁,病程(12.51±8.08)年;外科手术患者男性4例,女性8例,年龄(59.33±10.73)岁,病程(16.12±10.77)年。诊断均符合1987年美国风湿病学会诊断标准[8]。抽取关节内科30例患者的外周血和12例关节外科手术患者的关节滑液。
1.2 实验方法
将实验分为NC组(细胞+1640培养液)、CD3/ cytokine组(细胞+1640培养液+CD3单抗)、MTX组(细胞+1640培养液+CD3单抗+MTX 5 μg/mL)和LLDT-8组[细胞+1640培养液+CD3单抗+LLDT-8(LLDT-8浓度分别12.5、25、50 nmol/L)]。
1.2.1 单个核细胞(PBMC或SFMC)悬液的制备
无菌取RA患者外周血(或滑液)10 mL[9]置于肝素抗凝管,加PBS(含2% FBS)对倍稀释后铺于预置5 mL淋巴细胞分离液的离心管中,2 500转/min(离心半径13.5 cm)离心20 min;予吸管吸取上层白色云雾状液体(单个核细胞)入另一干净的离心管中;加PBS 3倍稀释,2 000转/min(离心半径13.5 cm)离心10 min后弃上清,加5 mL PBS稀释并细胞计数;1 500转/min(离心半径13.5 cm)离心5 min加10% FBS 1640稀释至需要浓度。
1.2.2 检测PBMC向破骨样细胞诱导转化
将分离出的PBMC按细胞数1′106/mL种入12孔板,加入1640培养液、35 ng/mL RANKL和25 ng/mL巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)诱导,再加入MTX 5 μg/mL及不同浓度LLDT-8(上海医药集团提供,12.5、25和50 nmol/L),每孔终体积200 uL,每隔24 h用倒置相差显微镜观察细胞形态并拍照,将培养14 d的细胞行酒石酸酸性磷酸酶染色,再随机选取5个镜下视野进行酒石酸酸性磷酸酶(tartaric acid phosphatase,TRAP)陽性细胞计数。
1.2.3 检测LLDT-8对细胞因子RANKL、RANK、OPG分泌的影响
将分离出的PBMC和SFMC分别按细胞数2×105/孔种板,加入CD3 0.4 μL/孔(终浓度为2 μg/mL刺激,再加入MTX 5 μg/mL及不同浓度LLDT-8(0、12.5、25和50 nmol/L),每孔终体积200 μL,将细胞培养48 h;收取细胞上清用ELISA法检测细胞因子RANKL、RANK、OPG水平(操作参照试剂盒说明书)。
1.2.4实时(realtime)PCR检测PBMC中RANKL、OPG、VEGF、MMP-9的表达
将分离出的PBMC按细胞数2×105/孔种板,加入 CD3 0.4 μL/孔(终浓度为2 μg/mL)刺激,再加入MTX 5 μg/mL及不同浓度LLDT-8(0、12.5、25、50 nmol/L),每孔终体积200 μL,将细胞培养48 h;收取细胞上清加入Trizol 0.5 mL/孔,再加100 uL氯仿,将上层水相RNA(约250 uL)加入等量异丙醇,吸弃上清,晾干,加入15 mL焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水,检测RNA量。取一RNA free管,加试剂液混匀后加标本(RNA)11 μL(总体积为20 uL)孵育后停止反应,-20℃冻存。配制引物(10 μmol/L),cDNA加DEPC水稀释,96孔板每孔加cDNA 4.85 μL,荧光染料5 μL,引物0.15 μL,贴膜后上机检测。 实时PCR引物序列见表1。75F94995-6749-439D-AA8D-1B194A60BA7F

1.3 统计学分析
应用SPSS 17.0分析数据,Students t检验分析组间差异。先用单因素方差分析,再用双侧配对或非配对的Students t检验。计量资料用x±SE表示。P<0.05为差异有统计学意义。
2 结果
2.1 PBMC向破骨样细胞诱导转化
镜下观察PBMC经RANKL和M-CSF诱导向破骨样细胞转化的过程中发现,该方法成功率远小于大鼠骨髓细胞向破骨样细胞转化。PBMC直至约培养5 d后才出现少量细胞贴壁,见图1B。贴壁细胞体积逐渐增大,有伪足,细胞外形出现各种变化,同一个视野里可见圆形、椭圆形、梭形、星状体形等形状,细胞生长速度加快,逐渐出现破骨样细胞形成,细胞体积较大,细胞核分裂、增多,由单核变成多核,细胞形状不规则,轮廓清晰,镜下细胞核较细胞质明显。此后,破骨样细胞形成增多,细胞体积进一步增大,细胞核也相应增多2~20个不等,形态较前相比更为清楚,易于观察。7 d时破骨样细胞数量最多,达到顶峰,往后细胞开始死亡,细胞膜破裂,细胞质流失,细胞形态改变,失去正常结构,留下异常的细胞轮廓,破骨样细胞数量逐渐减少,见图1C。培养14 d后行TRAP染色,出现少量细胞红染,见图1D、1E。行TRAP(+)细胞计数后发现,CD3组阳性细胞数最多(41.33±2.36)个,与之相比NC组(4.33±1.25)个、MTX组(20±4.49)个、LLDT-8 25 nmol/L组(9.33±7.58)个、LLDT-8 50 nmol/L组(13±4.55)个,组间差异有统计学意义(P<0.01),而LLDT-8 12.5 nmol/L组(24±5.71),组间亦存在统计学差异(P<0.05)。从而发现,LLDT-8抑制PBMC向破骨样细胞转化,减少OC的形成。
2.2 LLDT-8对细胞因子VEGF、OPG、RANKL分泌的影响
由图2、3结果得出,RA患者PBMC及SFMC经CD3刺激培养后,各组间VEGF、OPG、RANKL的分泌量基本相等,与CD3组相比,NC组和MTX、LLDT-8不同药物浓度干预组组间差异均无统计学意义(P>0.05)。
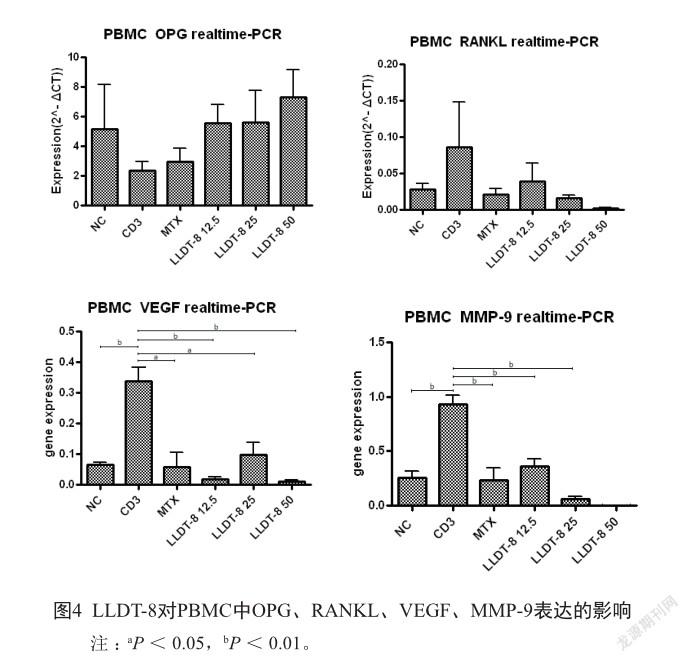
2.3 实时PCR检测标本中OPG、RANKL、VEGF、MMP-9的表达
根据图4各组的变化趋势可见,RA患者PBMC经CD3刺激培养后,LLDT-8不同药物浓度干预组对OPG、RANKL的表达分别有上调及下调趋势,但与CD3组相比,NC组和MTX组、LLDT-8不同药物浓度干预组间均差异无统计学意义(P>0.05)。MTX组及LLDT-8 25 nmol/L与CD3组比较,VEGF的表达差异有统计学意义(P<0.05),而NC组、LLDT-8 12.5 nmol/L及50 nmol/L组与CD3组间差异有统计学意义(P<0.01)。而在MMP-9表达上,NC组、MTX组、LLDT-8不同药物浓度组与CD3组间差异均有统计学意义(P<0.01)。表明LLDT-8下调VEGF和MMP-9的表达,但与不同药物浓度组间无明显剂量相关性。
3 讨论
1998年Matsuzaki等[10]报道RANKL可诱导人外周血PBMC生成破骨样細胞,这为培养人破骨样细胞提供了新思路。2005年Husheem等[11]报道,利用免疫磁珠性细胞分离技术从人外周血中分离CD14(+)、CD11b(+)和CD61(+)的单核细胞,用RANKL、M-CSF、TNF-a和地塞米松刺激培养14 d,生成的破骨样细胞数目分别是对照组的90、30和20倍。顾淑珠等[12]报道,分离脐血中的PBMC,经1,25(OH)2D3诱导培养13 d,可生成多核、TRAP阳性,但没有骨吸收功能的细胞。破骨细胞含有高水平的抗酒石酸酸性磷酸酶,组织蛋白酶K,基质金属蛋白酶-9等,这些特征性标记产物可用于鉴别破骨细胞[13]。
RANKL、RANK和OPG是近年来发现的与骨吸收和重建密切相关的细胞因子。RANKL主要表达于破骨细胞前体细胞表面,是参与破骨细胞分化、激活、存活和淋巴结形成的主要介质[14]。巨噬细胞和PBMC转化成破骨细胞依赖于粒细胞集落刺激因子(M-CSF)、RANKL与其膜受体c-Fms和RANK结合[15]。RANK与RANKL结合后促进破骨细胞及其前体细胞分化成熟和活化,并阻止破骨细胞凋亡。OPG主要由成骨细胞合成,是RANKL的天然阻滞受体,可阻断其与RANK的结合,抑制破骨细胞增殖活化。有研究表明,RANKL/OPG比值可能是骨吸收和重建的重要影响因素[16]。
VEGF具有诱导内皮细胞增殖、促进血管生成和增加毛细血管渗透性等的作用。近期,人们发现VEGF在风湿性疾病的血管病变中起着重要作用,尤其是RA[17]。许多因素影响VEGF的表达,RA PBMC分泌的VEGF被TGF-b和TNF-a上调,被IL-4、IL-10下调,而在滑膜中上调VEGF的因子是TNF-a[18]。Niida等[19]研究证实,VEGF对骨质疏松鼠可促进破骨细胞分化、成熟,维持骨髓功能,且达到类似于巨噬细胞集落刺激因子(M-CSF)的作用,VEGF表达在破骨细胞或前体细胞中,作用为促进其增殖、分化、成熟为破骨细胞。
基质金属蛋白酶-9(matrix metalloproteinases,MMP)是MMPs家族成员之一,MMP-9在骨吸收破骨细胞和破骨前体细胞中高水平表达,MMP9对RA关节的破坏作用至少有2条途径。①白细胞介素(IL)-1、肿瘤坏死因子(TNF)-a与RANKL协同促进MMP-9 mRNA在破骨细胞中表达并增加破骨细胞在骨代谢微环境及病理条件下的骨吸收活性直接降解软骨和骨质[20]。②MMP9帮助内皮细胞分解微血管基底膜和间质这两个屏障,促进血管再生,使RA关节滑膜和软骨交接处滑膜增厚,血管和细胞成分显著增多,形成血管翳,侵入软骨,构成血管翳/软骨结合[21]。75F94995-6749-439D-AA8D-1B194A60BA7F

目前认为破骨细胞增殖的信号传导有三个途径:第一个是RANKL/RANK/NF-kB或蛋白激酶JAK(janus kinase)通路,第二个是IL-1等炎症因子的非RANKL/ RANK依赖通路。两个通路之间有着密切的联系。主要途径中RANKL与破骨细胞表面的RANK结合后,激活得RANK将信号传入细胞内,与肿瘤坏死因子受体相关因子(TNF receptor associated factors,TRAFs)中的TRAF1、2、3、5及6结合,可激活转录因子NF-kB和JAK,从而促进破骨细胞的增殖、分化、成熟。第二个途径中由RA滑膜和血管翳组织产生的细胞因子例如IL-1、TNF-a,均可诱导单核巨噬细胞系分化为功能性破骨细胞,进而促进骨吸收。第三个途径考虑为单核细胞可以分泌VEGF,而破骨细胞前体细胞膜上具有VEGF受体,VEGF与VEGF受体结合使局部黏附激酶(FAK)中的酪氨酸磷酸化,激活破骨细胞的胞外基质、整和素FAK的信号传导通道,促进其不断增殖、趋化,并募集前体细胞,最终融合形成破骨细胞[22]。
本研究表明,用PBMC诱导向破骨样细胞的转化方法不如骨髓细胞诱导转化成熟。LLDT-8能抑制PBMC向破骨样细胞转化,减少OC细胞的生成。实时PCR结果显示LLDT-8能下调RANKL、VEGF和MMP-9的表达,上调OPG的表达,降低RANKL/OPG的比值,抑制破骨细胞的增殖活化。而ELISA结果显示LLDT-8对PBMC和SFMC VEGF、RANKL和OPG的分泌并无影响。我们推断,LLDT-8对破骨细胞的抑制作用,可能是直接作用促进其凋亡,而RANKL主要由OC分泌,破骨细胞产生减少,从而影响RANKL的分泌水平;另一方面,LLDT-8可能通过阻断OC活化的第二、第三途径达到对OC的抑制作用,由此可以推测,LLDT-8通过减少炎症因子的释放,使OC前体细胞失去激活的信号,从而阻断了OC的活化。
参考文献
[1] 2018中国类风湿关节炎诊疗指南 中华医学会风湿病学分会[J]. 临床医学研究与实践, 2018, 3(12): 201.
[2] 马伟光, 张韬, 张超, 等. 有毒药物雷公藤的研究及展望[J]. 中华中医药杂志, 2006, 21(2): 117-120.
[3] Viegas JSR, Pra?a FG, Kravicz M, et al. Therapeutic applications and delivery systems for triptolide[J]. Drug Deliv Transl Res, 2020, 10(6): 1584-1600.
[4] Zhou R, Zhang F, He PL, et al. (5R)-5-hydroxytriptolide(LLDT-8), a novel triptolide analog mediates immunosuppressive effects in vitro and in vivo[J]. Int Immunopharmacol, 2005, 5(13-14): 1895-903.
[5] Dai Y, Hu C, Wang L, et al. Serum peptidome patterns of human systemic lupus erythematosus based on magnetic bead separation and MALDI-TOF mass spectrometry analysis[J]. Scand J Rheumatol, 2010, 39(3): 240-246.
[6] Nosaka K, Miyamoto T, Sakai T, et al. Mechanism of hypercalcemia in adult T-cell leukemia:overexpression of receptor activator of nuclear factor KB ligand on adult T-cell leukemia cells[J]. Blood, 2002, 99: 634-640.
[7] Page G, Miossec P. RANK and RANKL expression as markers of dendritic cell-T cell interactions in paired samples of rheumatoid synovium and lymph nodes[J]. Arthritis Rheum, 2005, 52(8): 2307-2312.
[8] 葉任高, 陆再英. 内科学[M]. 6版. 北京: 人民卫生出版社, 2004: 887.
[9] 连艳玲, 何东仪, 聂红, 等. 雷藤舒在类风湿关节炎中免疫调节机制的研究[J]. 现代免疫学, 2012, 32(3): 239-242.
[10] Matsuzaki K, Udagawa N, Takahashi N, et al. Osteoclast differentiation factor induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures[J]. Biochem Biophys Res Commun, 1998, 246(1): 199-204.
[11] Husheem M, Nyman JK, Vasraniemi J, et al. Characterization of circulating human osteoclast progenitors:development of in vitro resorption assay[J]. Calcif Tissue Int, 2005, 76(3): 222-230.75F94995-6749-439D-AA8D-1B194A60BA7F
[12] 顧淑珠, 朱建民, 高建军, 等. 脐血单核细胞向破骨细胞诱导分化的实验研究[J]. 复旦学报(医学版), 2005, 28(3): 70-71.
[13] 苑芳, 刘晓辉, 刘兰忠. 体外诱导培养人破骨细胞样细胞的研究[J]. 西北国防医学杂志, 2006, 27(2): 123-125; 161.
[14] Wielińska J, Kolossa K, ?wierkot J, et al. Polymorphisms within the RANK and RANKL encoding genes in patients with rheumatoid arthritis: association with disease progression and effectiveness of the biological treatment[J]. Arch Immunol Ther Exp (Warsz), 2020, 68(4): 24.
[15] 尚鹏, 朱平, 樊春梅, 等. RANK RANKL和骨保护素在类风湿关节炎患者外周血和滑液中表达的研究[J]. 中华风湿病学杂志, 2005, 9(7): 417-420.
[16] Kim KW, Kim BM, Won JY, et al. Tocotrienol regulates osteoclastogenesis in rheumatoid arthritis[J]. Korean J Intern Med, 2021, 36(Suppl 1): S273-S282.
[17] 王天, 刘复强, 唐福林, 等. 类风湿关节炎患者血管内皮生长因子mRNA的表达[J]. 中华风湿病学杂志, 2003, 7(1): 18-21.
[18] Bottomley MJ, Webb NJ, Watson CJ, et al. Peripheral blood mononuclear cells from patients with rheumatoid arthritis spontaneously secrete vascular endothelial growth factor(VEGF): specific up-regulation by tumour necrosis factor-alpha (TNF-alpha) in synovial fluid[J]. Clin Exp Immunol, 1999, 117(1): 171-176.
[19] Niida S, Kondo T, Hiratsuka S, et al. VEGF receptor 1 signaling is essential for osteoclast development and bone marrow formation in colony-stimulating factor 1-deficient mice[J]. Proc Natl Acad Sci USA, 2005, 102(39): 14016-14021.
[20] SundaramK, NishimuraR, SennJ, et al. RANK ligand signaling modulates the matrix metalloproteinase-9 gene expression during osteoclast differentiation[J]. Exp Cell Res, 2007, 313(1): 168-178.
[21] FujisakiK, TanabeN, SuzukiN, et al. Receptor activator of NF- kB ligand 121 induces the expression of carbonicanhydraseII, cathepsinK, and matrix metalloproteinase-9 in osteoclast precursor RAW264.7 cells[J]. Life Sci, 2007, 80(14): 1311-1318.
[22] Matsumoto Y, Tanaka K, Hirata G, et al. Possible involvement of the vascular endothelial growth factor-Flt-1-focal adhesion kinase pathway in chemotaxis and the cell proliferation of osteoclast precursor cells in arthritic joints[J]. J Immunol, 2002, 168(11): 5824-5831.75F94995-6749-439D-AA8D-1B194A60BA7F
