壳聚糖对无水保活单环刺螠品质的影响
2022-06-02李仲堃李姿萱刘辰昊刘春娥
李仲堃 李姿萱 刘辰昊 刘春娥
(中国农业大学烟台研究院,山东 烟台 264670)
单环刺螠(Urechisuniconctus)俗称海肠,属于螠虫动物门,富含微量元素和多种鲜味氨基酸,肉味鲜美,不仅形似海参,其营养价值也不逊于海参,因此享有“裸体海参”的美誉,具有极高的食用价值[1]。单环刺螠分布地域性较强,在中国主要产于黄渤海沿岸,其中烟台海肠被评为国家地理标志产品[2]。由于其生长区域的限制,导致其运输成本较高,外地消费者很难品尝到鲜活的单环刺螠产品。
低温运输是目前市场上单环刺螠的主要运输方式。随着近几年研究的深入,对水产品的保活运输,不单纯追求其成活率,对其风味和营养成分的变化也非常关注。低温运输水产品成本较大、经济效益较低[3-4],因此,寻找一种成本低廉且保活效果好的方法是水产品长途运输的关键。目前,水产品的无水保活技术已发展相对成熟并在部分水产品中得到应用[5-6],若能通过运用保活剂部分代替无水保活前处理的低温及麻醉操作[7],进而减少单环刺螠在运输中的应激反应,将降低对环境因子的依赖。
壳聚糖具有成本低、抑制微生物生长、减缓脂质氧化、延缓蛋白质降解速率等优点[8-9],同时拥有良好的生物降解性和生物相性[10],在水产品保鲜、保活领域应用广泛[11]。研究拟将壳聚糖应用于单环刺螠无水保活前处理中,分析保活前、后以及复水后样品中基本营养指标的变化,为研发更高效的单环刺螠无水保活方法提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
单环刺螠:(100±20) g,烟台市芝罘区吴松华水产品店,带水运回实验室后暂养6 h,期间禁食;
壳聚糖:脱乙酰度90%,分子量1 526.45,河南云航轩生物科技有限公司;
糖原、乳酸试剂盒:南京建成生物工程研究所;
无水乙醚、浓硫酸、硼酸、甲基红指示剂、氢氧化钠、硫酸铜、硫酸钾等:分析纯,天津致远化学试剂有限公司。
1.1.2 主要仪器设备
电热鼓风干燥箱(DHG-9240A型)、电热恒温水浴锅(HWS-24型)、电热板(NMK-450A型)、万分之一分析天平(ESJ182-4型):上海一恒科学仪器有限公司;
凯氏定氮仪(K1100型)、石墨消解仪(SH420F型)、脂肪测定仪(SOX406型):山东海能科学仪器有限公司;
酶标仪:Epoch型,上海菲特科学器材有限公司;
紫外可见光分光光度计:UV1900型,青岛聚创环保集团有限公司;
酸度计:PHS-3型,上海佑科仪器仪表有限公司。
1.2 方法
1.2.1 壳聚糖浓度确定 在17 ℃分别设置1,2,3,4 g/L共4组壳聚糖水溶液浓度梯度,并设置空白对照组,每组样品浸泡30 min,之后将单环刺螠分别置于泡沫箱,进行无水保活模拟。期间进行外部形态观察,记录单环刺螠死亡情况,通过观察口部是否张合或刺激体壁观察有无应激反应,判断单环刺螠是否死亡。无水保活至72 h时,3 g/L壳聚糖溶液保活条件下单环刺螠存活率为50%,对照组及其他浓度组别单环刺螠存活率为0%,得出壳聚糖对单环刺螠的无水保活较适质量浓度为3 g/L。
1.2.2 无水保活试验 试验组(经3 g/L壳聚糖溶液保活处理)和对照组分别取21条单环刺螠进行试验,无水保活64 h后,将仍存活的半数试验组与半数对照组复水4 h,另外半数不复水,继续保持无水状态3 h。由此得到5组样本:复水试验组(E1)、不复水试验组(E2)、复水对照组(C1)、不复水对照组(C2)和原料组(C0),对所有单环刺螠进行解剖处理,获取的体腔液与体壁肌肉存储于-80 ℃冰箱,待测。
1.2.3 出皮率计算 根据文献[12]修改如下:将单环刺螠解剖后,去除内脏和体腔液,将其体壁置于滤纸上吸干水分,用电子天平重复3次称量其体壁重量,按式(1)计算出皮率。
(1)
式中:
s——出皮率,%;
m1——无水保活后体壁质量,g;
m2——无水保活前体壁质量,g。
1.2.4 粗蛋白测定 按GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法执行。
1.2.5 粗脂肪测定 按GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏抽提法执行。
1.2.6 水分测定 按GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法执行。
1.2.7 持水力测定 根据文献[13]修改如下:剪取单环刺螠体壁肉称重记为W1,用三层滤纸包裹后置于50 mL离心管中,17 ℃,5 000 r/min离心10min。离心结束后,立即取出样品,称重记为W2,每组试验重复3次,按式(2) 计算持水力。
(2)
式中:
WHS——持水力,%;
W1——单环刺螠体壁初始质量,g;
W2——离心后单环刺螠体壁质量,g。
1.2.8 糖原测定 根据文献[14]。
1.2.9 乳酸测定 根据文献[15]。
1.2.10 pH测定 按GB 5009.237—2016《食品安全国家标准 食品中pH的测定》执行。
1.2.11 数据处理 每组试验取3个平行,采用Excel 2016软件进行数据处理,SPSS 25.0做显著性分析和相关性分析,采用Originpro 2021作图,以平均值±标准差表示最终结果;显著性分析以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 无水保活过程形态观察与存活率
预试验过程中,单环刺螠呈现出多种死亡形态,可归为4种类型:① 体壁涨破,溢出大量体腔液,排出部分排泄物;② 体壁干燥且部分肿胀,无体腔液溢出,有大量排泄物,死亡速度极快;③ 体壁无肿胀现象,溢出少量体腔液;④ 体壁微微湿润,无肿胀现象,无体腔液溢出。正常无水保活状态下非正常死亡状态的个体较少,当壳聚糖溶液质量浓度>3 g/L时,出现前两种状态的个体居多,推测原因,壳聚糖的浓度过高导致其黏稠度增加,进而影响单环刺螠的呼吸与活动。此外,通过观察发现,单环刺螠在无水条件下会出现一动不动的“假死”现象,但在受到外力刺激时会表现一定的应激反应,复水后可以观察到单环刺螠身体摆动,活性有很大的提高。
试验组与对照组无水保活64 h后,成活率见图1。经过壳聚糖溶液保活处理的单环刺螠,17 ℃无水保活64 h 的存活率为67%,对照组为47%,壳聚糖处理组存活率极显著高于对照组(P<0.01)。单环刺螠的体表被覆一层由蛋白质和多糖组成的黏液,研究表明,黏液层能够保持机体水分并抵抗外界不良条件[16],对单环刺螠的存活非常重要[17],但仅对大肠杆菌、溶血性链球菌、不动杆菌有抑制作用[18],而对水产动物常见的9种病原菌均无抗菌性[16]。壳聚糖具有成膜性,同样能保持水分,并且壳聚糖具有抗菌性,能与病原微生物细胞膜发生作用[19],在保活过程中辅助单环刺螠体表黏液抵御病原微生物侵染,进而提升存活率。
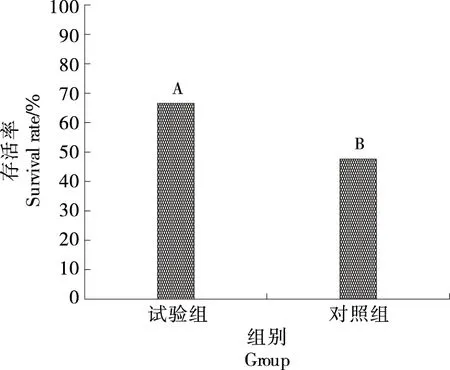
字母不同表示差异极显著(P<0.01)图1 无水保活64 h后单环刺螠存活率Figure 1 The survival rate after waterless preservation for 64 hours
2.2 无水保活过程营养及理化指标含量的比较
蛋白质和脂肪是组成水产品肌肉的主要成分,其含量的变化与肌肉的多汁性、感官风味、新鲜度存在重要联系[20]。不同无水保活条件对单环刺螠肌肉品质的影响如表1所示,由于单环刺螠在无水保活过程中没有摄食,脂肪和蛋白质作为供能物质被消耗[21],因此E2组与C2组的脂肪含量与C0组相比极显著下降(P<0.01)。E2组粗蛋白含量高于C0组,推测原因一方面可能是由于单环刺螠个体差异,另一方面无水保活后的样品由于本身有黏液存在,部分壳聚糖可能附着于单环刺螠体表,导致粗蛋白中非蛋白含氮量升高。C1和E1组的粗蛋白含量与粗脂肪含量均分别极显著低于C2和E2组(P<0.01),究其原因,复水后单环刺螠由无氧呼吸变为有氧呼吸,脂肪和蛋白质代谢分解产生能量以调节体内新陈代谢,这一变化趋势在鲫鱼[22]、斑点叉尾鮰[23]、黄颡鱼[24]等无水保活研究中已得到证实。

表1 无水保活条件对单环刺螠肌肉品质的影响†Table 1 Effect of different condition of waterless preservation on physiological index
持水力不仅影响肌肉色泽,还与蛋白质三维网状结构和变性程度相关[25],保活过程中E1组与E2组持水力均无显著性下降(P>0.05),C2组持水力极显著低于C0组(P<0.01),C1组比C2组高3.84%,说明复水过程使持水力得到部分恢复。保活处理后,各组水分含量均极显著低于对照组(P<0.01),与对鲟鱼的试验结果[26]一致,此外,E1组、E2组水分含量分别显著高于C1组、C2组(P<0.05),与保活过程单环刺螠自身水分消耗和水分蒸发有关,E1组水分含量极显著高于C1组(P<0.01),结合持水力的结果,表明试验组中壳聚糖起到了良好的保水与维持体壁肌肉蛋白质网状结构的作用。无水保活后各组pH均显著下降(P<0.05),主要是由于保活过程中无氧代谢增加,乳酸积累导致。
2.3 无水保活过程出皮率的比较
由图2所示,与C0组相比,无水保活后的4组单环刺螠出皮率极显著下降(P<0.01),与保活过程中粗蛋白、粗脂肪、水分等营养成分的消耗和流失有关。壳聚糖对单环刺螠保活前后的出皮率无显著影响(P>0.05)。
2.4 无水保活过程糖原及乳酸含量的比较
不同无水保活条件下单环刺螠肌糖原含量如图3所示,E2组的肌糖原含量极显著高于E1、C1、C2组(P<0.01)。单环刺螠在缺氧情况下为了维持生命代谢活动,肌糖原分解成乳酸并产生ATP[27],因此E2组与C2组的肌糖原含量较C0组极显著下降(P<0.01)。斑点叉尾鮰[28]、鲫鱼[22]在保活过程也出现同样变化。壳聚糖结构上的羟基和氨基具有很强的还原性[19],武桂新等[29]研究表明壳聚糖有助于无氧训练大鼠肌糖原的恢复并对其糖的代谢与合成有明显影响,因此推测壳聚糖调节单环刺螠体内糖合成,使E2组肌糖原含量维持在相对较高水平。复水4 h后,肌糖原含量仍持续降低,这是因为整个试验过程均未进食,机体为解决自身的供能问题而消耗肌糖原[22]。

小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)图2 不同无水保活条件下单环刺螠各组出皮率的比较Figure 2 Effect of different condition of waterless preservation on the rate of skin

小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)图3 不同无水保活条件下单环刺螠肌糖原含量Figure 3 Effect of different condition of waterless preservation on muscle glycogen
由图4可以看出,E2和C2的乳酸含量较C0组极显著上升(P<0.01),无水保活过程并未额外充氧,而缺氧是水产动物常见的应激源[30],单环刺螠为了使自身能量消耗维持在较低水平,机体消耗糖原进行无氧代谢[31],体内乳酸含量呈上升趋势。壳聚糖有较好的成膜性与保水性,能够在单环刺螠表面形成一层较好的保护膜[32],同时氧气被隔绝,使单环刺螠无氧呼吸加剧,而乳酸在一定范围内的上升可以提高鱼类在缺氧条件下的存活率[33],这可能是E2组乳酸含量与存活率均高于C2组的原因。复水后,有氧呼吸增强,乳酸被消耗[34-35],因此E1、C1组的乳酸含量极显著下降(P<0.01)。
2.5 各指标间相关性分析
各指标的相关性分析见表2。水分、持水力与出皮率呈极显著正相关(P<0.01),表明高的水分含量与持水力有利于单环刺螠出皮。出皮率与粗脂肪、肌糖原呈极显著正相关(P<0.01),说明保活后单环刺螠出皮率的下降与粗脂肪及肌糖原的消耗有关。肌糖原在无水保活过程中发生糖酵解,生成乳酸,降低了机体pH,因此其含量与pH呈极显著正相关(P<0.01)。pH和水分含量与粗蛋白、粗脂肪、肌糖原呈极显著正相关(P<0.01),表明pH和水分含量的变化会影响肉质品质。另有研究[28]表明,pH和水分含量与贮藏损失有极强相关性,因此保活过程中原料水分流失及pH的变化可能是品质下降的重要原因之一。

小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)图4 不同无水保活条件下单环刺螠血浆乳酸含量Figure 4 Effect of different condition of waterless preservation on lactic acid

表2 各指标间的相关性分析†Table 2 Correlation analysis of various quality parameters
3 结论
以单环刺螠为研究对象,探讨壳聚糖在单环刺螠无水保活中的作用。结果表明,单环刺螠经质量浓度为3 g/L的壳聚糖浸泡处理后,无水保活64 h后的存活率为67%,相比对照组,其存活率、肌糖原、持水力、水分、乳酸含量均有显著提升。由于整个试验过程不喂食,经过无水保活后单环刺螠粗蛋白、出皮率、粗脂肪、水分、肌糖原含量极显著降低(P<0.01);复水处理后,持水力、乳酸含量得到恢复,但粗蛋白、乳酸、粗脂肪、水分含量仍显著下降(P<0.05)。试验环境温度为17 ℃,虽然单环刺螠本身具有较强的抗逆性,但对水产动物而言,环境温度是影响其生理机能、免疫力以及存活率的重要因素,因此若在环境温度较高的季节,可将壳聚糖与低温相结合运用到单环刺螠无水保活运输中,以更好地提高原料质量。
