老年大鼠脊髓小胶质细胞分选新方法及功能特征观察*
2022-06-01张雨彤尹艺儒吴淑芬张利娜杜相欣
张雨彤,赵 欣,尹艺儒,吴淑芬,张利娜,杜相欣,张 宇
(山西医科大学生理学系 细胞生理学教育部重点实验室,太原030001)
随年龄增长,个体生存及整体功能下降的过程称为衰老[1]。在衰老过程中,人体对内外环境适应能力逐渐减退,大脑的结构和功能逐渐老化,导致认知障碍、抑郁和神经退行性疾病的发病率增加。
小胶质细胞是神经胶质细胞中的一种,在神经系统发育过程中,参与神经元凋亡、突触发生和突触剪枝,为中枢神经系统正常发育所必需。小胶质细胞还是中枢神经系统内固有的免疫细胞,通过其分支监控神经系统的内环境[2-4],吞噬清除病原体和细胞碎片,维持突触稳态,调控突触可塑性,维持大脑正常的结构和功能[5]。当神经系统内发生炎症、感染或创伤时,小胶质细胞可迅速激活,参与神经系统疾病的发生发展[6,7]。作为神经系统内固有的免疫细胞,小胶质细胞参与衰老的具体机制尚未完全阐明。
小胶质细胞的研究对象包括细胞系(小鼠小胶质细胞(BV-2)和大鼠小胶质细胞(HAPI))或乳鼠原代分离培养的细胞。细胞系的主要优势在于有较强的增殖能力、易培养易操作,但细胞系的永生化可能会显著影响细胞特性,改变细胞生理功能。原代培养小胶质细胞与细胞系相比,其功能更接近生理状态,但原代培养小胶质细胞来源于刚出生、尚未发育成熟的乳鼠,因此原代小胶质细胞虽然更接近正常细胞,但因没有经历成熟过程,并不能完全反映正常成熟甚至衰老细胞的功能。
小胶质细胞分离纯化方法很多,但各种方法操作步骤上有很大的差异,而且分选出的细胞纯度、数目及细胞活性的差异明显,但普遍都存在不足之处。如流式细胞术需要的设备昂贵,所需的专业技能要求高;免疫磁珠分选虽然操作简单、分选出的细胞纯度高,但是由于试剂昂贵,所以如果大量分离细胞以用于实验,所需成本太高。虽然从大鼠神经系统中分离小胶质细胞的方法已经比较成熟,但由于老年大鼠小胶质细胞较为脆弱,所以如何从老年大鼠脊髓组织中获得小胶质细胞仍然存在较大困难。因此,本研究旨在建立一种分选高纯度、高活性老年大鼠小胶质细胞的实验方法,并以此为基础初步观察脊髓小胶质细胞的老化特征。
1 材料与方法
1.1 实验动物
实验分组:年轻组(2月龄雄性SD大鼠)与老年组(20月龄雄性SD大鼠)。
大鼠均购自山西医科大学动物实验中心。饲养于SPF级动物房,每笼2只,环境温度20℃~22℃,湿度50%,昼夜明暗交替时间为12 h/12 h。所有动物自由进食和水。所有动物实验及处理均经山西医科大学伦理委员会审核批准。
1.2 主要试剂和仪器
Percoll(Solarbio)、胰酶替代物(gibico)、DMEM/F12培养基(Boster)、青链霉素混合液(Solarbio)、磷酸盐缓冲溶液(PBS,Boster)、HBSS(Boster)、10×HBSS(Solarbio)、多聚赖氨酸(sigma)、Iba1抗体(sigma)、4%多聚甲醛溶液(Boster)、TritonX-100(Solarbio)、0.4%台盼蓝(Solarbio)、DNA酶Ⅰ(Solarbio),柱式动物组织总RNA抽提纯化试剂盒(Solarbio),PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TAKARA),TB Green® Premix Ex TapTM II(Tli RNaseH Plus)(TAKARA)。24孔培养皿(NEST)、100 μm滤网、恒温二氧化碳培养箱和超净工作台(Thermo)、倒置相差光学显微镜(Olympus)、荧光倒置显微镜(Olympus)、高速自动平衡离心机(Eppendorf)、基因扩增仪(BIO-GENER)、LightCycler 96 Instrument(ABI)。
1.3 Percoll密度梯度离心法分离纯化大鼠脊髓小胶质细胞
1.3.1 制备脊髓组织单细胞悬液 取大鼠麻醉后断头,置于冰上剪开背部皮肤,用止血钳分离脊椎暴露脊髓组织,取出全部脊髓组织用冷的PBS冲洗3次以清洗血液,之后转移至超净台中,在冰上剥膜。
胰酶及胰酶替代物制备细胞悬液:用刀片将组织切碎至约1 mm3,加入0.125%胰酶(PBS稀释)或50%胰酶替代物(PBS稀释),轻轻吹打10次左右,置于37℃水浴锅内恒温消化20 min(期间吹打3次),消化后可见组织变白呈絮状。加入5 ml无血清培养基(DMEM/F12+0.1%双抗)终止消化,加入0.5 ml的DNA酶Ⅰ,用1 ml移液枪将组织轻轻吹散,100 μm滤网过滤至50 ml离心管中。1 500 r/min 离心5 min,弃去上清。
机械网搓法制备细胞悬液:将组织剪碎放在100 μm 滤网上用小镊子轻搓组织块,边搓边用PBS冲洗,直至组织搓完。500 g 离心5 min,弃去上清。
1.3.2 Percoll分离液配置 用9份 Percoll 原液和1份10×D-Hanks溶液充分混合配制成SIP Percoll混合液,达到生理渗透压后用DMEM/F12稀释成30%SIP Percoll分离液,1×D-Hanks稀释成70%SIP Percoll分离液。
1.3.3 密度梯度法分离纯化小胶质细胞 细胞悬液离心后所得沉淀用30%SIP Percoll分离液重悬,在其下用注射器缓慢加入70%SIP Percoll分离液(缓慢加入避免破坏分层),1 900 r/min 离心30 min后可见分层,去除上层白色髓鞘,小心吸取出30%与70% SIP Percoll分离液之间的雾状小胶质细胞层,加入两倍体积的PBS混匀,1 500 r/min 离心5 min,去除上清,收集细胞。细胞可用于后续实验。如需培养,可将细胞重悬于2 ml的无血清培养基中,接种于预先铺好0.1 mg/ml多聚赖氨酸的24孔培养板上,置于恒温二氧化碳培养箱中孵育(图1)。

Fig. 1 Sorting process of rat spinal cord microglia
1.4 细胞存活率及数量检测
将分选出的小胶质细胞悬液与0.4%台盼蓝以9∶1混合均匀,静置染色3 min,取20 μl滴到血细胞计数仪中。蓝色细胞为死细胞,未染色且折光性较强的细胞为小胶质细胞。对细胞进行计数,每次检测4个视野,取平均值,计算出活细胞数与总细胞数。细胞存活率 (%) = 活细胞数/总细胞数×100。
1.5 细胞免疫荧光鉴定及纯度分析
小胶质细胞贴壁培养48 h后,吸出培养基,37℃PBS清洗3次。室温下,4%多聚甲醛固定15 min,PBS清洗3次,破膜(0.5% TritonX-100+PBS)15 min,封闭(1%BSA+0.1% TritonX-100+PBS)30 min,一抗Iba1(兔抗大鼠、abcam)以1∶1 000 PBS稀释后4℃孵育过夜,室温恢复1 h后用PBS清洗3次。二抗(驴抗兔、abcam)以1∶500 PBS稀释后室温孵育1 h,PBS清洗3次,DAPI孵育10 min,PBS清洗3次后在荧光倒置显微镜下观察、拍照。红色为Iba1标记的小胶质细胞,蓝色为DAPI标记的细胞核。小胶质细胞纯度(%) = Iba1标记阳性细胞数/DAPI标记阳性细胞数×100%。
1.6 细胞因子检测
实时荧光定量PCR检测促炎因子IL-1β与抗炎因子IL-10表达水平。将分选所得小胶质细胞加入250 μl中的Buffer Rlysis-AG,按柱式动物组织总RNA抽提纯化试剂盒说明书进行RNA提取。将提取出的RNA按TaKaRa试剂盒说明书去除基因组(42℃、2 min)后反转录为cDNA(37℃、15 min,85℃、5 s)。按TaKaRa试剂盒说明书进行扩增反应(表1),两步法RT-PCR扩增标准程序:(1)预变性:95℃、30 s ;(2)PCR反应:95℃、5 s,60℃、30~40 s;40个循环。数据采用仪器自带软件LC 96分析,采用2-ΔΔCt法计算IL-1β与IL-10基因相对表达量。

Tab. 1 Primer sequences
1.7 统计学处理
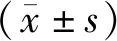
2 结果
2.1 不同单细胞悬液制备方式对脊髓小胶质细胞分选效果比较
我们比较了胰酶、胰酶替代物及机械网搓法的分选效果。消化液的浓度分别为:胰酶0.125%、胰酶替代物50%。消化之前均将组织切碎至约1 mm3,在37℃下消化20 min,通过100 μm滤网过程中要保持轻柔,避免用力过猛损伤细胞;机械网搓法分散组织应注意,在100 μm滤网上搓组织时动作轻柔且迅速,而且要多次用PBS冲洗滤网;对最终分选出小胶质细胞存活率进行观察,结果发现,胰酶消化所得细胞的存活率最低;机械网搓法得到的存活率较高,但是细胞获取率最低;胰酶替代物可显著提高细胞获取率及细胞存活率,尤其适合于老年大鼠,分离效果最好(表2)。

Tab. 2 The effects of different treatment on n=3)
2.2 不同年龄大鼠脊髓小胶质细胞分选的数量及存活率比较
采用胰酶替代物解离结合密度梯度离心法进行分选,结果发现不同年龄大鼠脊髓组织分选出的小胶质细胞数量不同。老年大鼠脊髓组织体积大,分选出的小胶质细胞数目较多,每只老年大鼠脊髓组织大约可分选出(2.570±0.113)×106个细胞,每只年轻大鼠脊髓组织大约可分选出(0.927±0.049)×106个细胞。采用台盼蓝染色检测分选出的小胶质细胞的存活率发现,年轻大鼠和老年大鼠的细胞存活率均可达到95%以上,小胶质细胞的纯度均可达到85%以上(表3)。

Tab. 3 Comparison of isolated spinal cord microglia number,survival rate and n=3)
2.3 不同年龄大鼠脊髓小胶质细胞分选条件比较
在细胞分选的过程中发现,为达到最好的分选效果,即较多的细胞量和较高的存活率,不同年龄大鼠脊髓组织在制备单细胞悬液的实验条件需有所差异。消化液中胰酶替代物的浓度保持一致,均为50%;年轻大鼠脊髓组织量较老年大鼠小,消化液体积需少于老年大鼠,但消化时间老年大鼠较年轻大鼠缩短(表4)。

Tab. 4 Comparison of digestive process in rat spinal cord
2.4 不同年龄大鼠脊髓小胶质细胞的形态比较
小胶质细胞可通过检测Iba1(电离钙结合蛋白)的表达来进行标记。将70%-30% SIP percoll之间的界面分离出的细胞在体外培养48 h后,采用Iba1抗体进行荧光标记,结果发现,与年轻大鼠相比,老年大鼠脊髓小胶质细胞胞体较大较圆,突起较少且粗短,Iba1荧光信号较强,形态上更偏向于激活状态(图2)。

Fig. 2 Immunofluorescence staining of rat isolated spinal cord microglia(×200)
2.5 不同年龄大鼠脊髓小胶质细胞炎症因子表达
对不同年龄大鼠脊髓组织分选出的小胶质细胞进行荧光定量PCR分析,结果发现,与年轻大鼠相比,老年大鼠脊髓小胶质细胞促炎因子IL-1β表达降低(P<0.05),而抗炎因子IL-10表达升高(P<0.05,表5)。

Tab. 5 Inflammatory cytokines mRNA levels of isolated spinal cord n=3)
3 讨论
本研究选取老年大鼠,采用胰酶替代物解离的方法制备脊髓组织单细胞悬液,采用Percoll密度梯度离心法分选小胶质细胞,得到活性好、纯度高的细胞,进行老年大鼠神经组织小胶质细胞分选方法的改良。成年大鼠小胶质细胞的分选,弥补了细胞系或乳鼠来源原代培养小胶质细胞不能观察衰老小胶质细胞功能特征的局限性。
胰酶替代物解离脊髓组织分选出的小胶质细胞细胞活性好,纯度高。以往的研究方案多采用胰酶或木瓜蛋白酶进行组织消化[6,8,9]。然而,有报道称消化酶处理对活细胞有轻微的毒性作用,影响细胞活力。除此之外,消化酶处理会破坏细胞表面结构,可能会干扰之后的应用[7,10,11]。胰酶替代物是非动物源性的细胞解离试剂,对细胞损伤更小;胰酶替代物可以稳定的保存于室温,便于储存及使用;胰酶替代物不需要含血清的抑制剂终止消化,直接用 PBS 稀释终止消化即可。这样避免了与血清的直接接触,血清中的复杂成分也不会干扰小胶质细胞的生理功能,改变其功能状态。
木瓜蛋白酶或胰蛋白酶消化获得的细胞状态不好,存活时间短,不能满足实验需要,而且血清来源的消化酶易对细胞产生刺激,使细胞离体时与在体状态不同。而机械剪切获得的细胞虽状态好,但由于解离不够彻底,获得的细胞量少,不能满足后续实验需要,所以我们利用胰酶替代物代替木瓜蛋白酶或胰蛋白酶进行组织细胞解离,可以保护细胞表面标记物免受损伤,并增加细胞活力,还可以降低血清成分对小胶质细胞可能产生的免疫激活反应,更好地保持细胞的正常功能状态。
Percoll是一种经聚乙烯吡喀烷酮处理的硅胶颗粒,分离液渗透性低、不易穿透细胞、无毒性作用,是比较理想的分离介质。Percoll密度梯度离心法已被成功运用到多种细胞及细胞器的分离实验中[12,13]。Cardona等人使用70% - 37% - 30% SIP从神经组织的单细胞悬液中分离小胶质细胞[8]。我们采用70% - 30% SIP分离脊髓组织中的小胶质细胞。采用密度梯度离心法分选细胞无需使用荧光抗体或磁珠,也可避免抗体结合引起的小胶质细胞细胞激活风险[14]。
为取得活性较好的细胞,在组织细胞解离和细胞分选过程中应特别注意:(1)在处死动物后,脊髓组织必须一直置于冰冷的环境中,以减缓离体神经组织的液化情况;(2)取出的脊髓组织应尽量将血液清洗干净,避免血细胞以及血液中的免疫物质对后续实验的影响;将脊膜分离干净,以免影响单细胞分离;(3)在组织的机械性分离过程中,最好将组织切碎至1 mm3,组织块过大会使得消化过程不完全,太小会造成细胞损失过多,细胞状态不好;(4)细胞解离后用培养基终止消化,避免消化过度,吹打过程要轻柔,注意不要产生气泡;(5)在30% SIP Percoll下加入70% SIP Percoll时要注意不要破坏分层;(6)确保离心机缓慢降速,避免破坏细胞分层。
本研究成功分选成年大鼠脊髓小胶质细胞,而老年大鼠和年轻大鼠的细胞分选所需实验条件也并非完全相同。我们比较老年大鼠和年轻大鼠脊髓小胶质细胞分选条件的差异,与年轻大鼠相比,老年大鼠组织量更大,需要更多消化液,但由于老年细胞较为脆弱,需要适当的缩短解离时间以提高细胞存活率,同时在解离时结合多次轻柔机械吹打,可提高小胶质细胞的获取率。根据我们优化后的实验方法,分选出的脊髓小胶质细胞还可在无血清培养基中继续培养3~5 d,保持细胞正常功能状态,可进行其他相关实验。
本研究从年轻和老年大鼠的神经系统中取材,避免了乳鼠小胶质细胞还未发育成熟对实验带来的影响,有助于观察衰老过程中脊髓小胶质细胞形态及功能的变化。自然衰老进程中机体内呈现出促炎症反应状态缓慢进行性增高,这种现象被称为炎性衰老(inflammaging)[15]。其原因在于促炎因子和抗炎因子之间的动态平衡被打破。小胶质细胞是神经系统固有的免疫效应细胞,可分泌各种炎性因子,调节神经系统内的炎症状态。我们比较年轻大鼠和老年大鼠脊髓组织分选出的小胶质细胞的结构和功能,结果发现,老年大鼠的脊髓小胶质细胞数目大大增加,形态上,胞体增大,突起变粗变短,倾向于一种激活形态;检测细胞因子(包括促炎因子和抗炎因子)的表达情况,结果发现,促炎因子IL-1β表达降低而抗炎因子IL-10表达升高,这说明老年大鼠的脊髓小胶质细胞的功能异于年轻大鼠,衰老的小胶质细胞功能发生改变,参与神经系统内促炎功能和抗炎功能的失衡,可能是炎性衰老形成的机制之一。我们的结果还提示,在正常衰老过程中,脊髓小胶质细胞可能发挥的不是促炎作用,而是抗炎作用,从而发挥神经保护作用。这可能是因为在正常老化过程中,由于某些原因导致神经系统中促炎因子水平增加,而小胶质细胞的抗炎作用可参与维持中枢神经系统的炎症状态平衡,从而发挥神经保护作用[16]。
综上所述,本研究建立了改良的老年大鼠神经组织小胶质细胞的分选方法,可分离出数量多、纯度高、活性好的小胶质细胞,有助于进行老化的神经生物学机制的研究;本研究还初步证实正常衰老过程中,小胶质细胞参与炎性衰老的进程。
