miR-216a、miR-301a调控BMPR2促进缺氧环境下肺动脉平滑肌细胞的增殖
2022-05-31林潇郑炜平李鸿茹陈愉生周梦
林潇,郑炜平,李鸿茹,陈愉生,周梦
(福建省立医院 1. 老年科; 2. 呼吸与危重症医学科; 3. 风湿免疫科,福建 福州 350001)
肺动脉高压(pulmonary arterial hypertension, PAH)是由多因素引起的肺血管阻力增加,引发肺动脉压力异常升高的临床综合征,其病理生理特点主要为肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMC)过度增殖、肥大,后期逐渐演变为肺血管丛状纤维化[1],右心室后负荷增加,最终导致右心功能衰竭[2]。目前PAH的治疗主要包括一氧化氮、内皮素受体拮抗剂和前列环素类似物[3],但总体效果不佳,死亡率高,因此亟需寻找新的分子通路靶点用于药物研发。当前微小RNA(miRNA)参与PAH发病机制的研究已成为学术界的热点,多篇文献已报道,miR-21、miR-124、miR-140和miR-663等多种miRNA参与调控PASMC的增殖、迁移[4-7],有研究发现miR-216a、miR-301a在PAH大鼠或人的PASMC中表达上调[8-9],然而缺氧环境下miR-216a、miR-301a调控PASMC增殖的相关机制研究较少。本研究通过体外细胞实验探讨miR-216a、miR-301a对缺氧条件下人PASMC(HPASMC)增殖的影响及相关分子机制,旨在为治疗PAH开发新型靶向药物提供理论基础。
1 材料与方法
1.1 主要材料
HPASMC及iCell原代平滑肌细胞基础培养基(上海赛百慷生物技术公司);超纯RNA提取试剂盒、超纯miRNA提取试剂盒及BCA蛋白定量试剂盒(北京康为世纪生物科技公司);mRNA逆转录试剂盒、miRNA逆转录试剂盒及miRNA荧光定量qPCR检测试剂盒(南京诺唯赞生物科技公司);mRNA荧光定量qPCR检测试剂盒(厦门生命互联科技公司);CCK8细胞增殖检测试剂盒(江苏凯基生物技术公司);RIPA细胞裂解液(北京普利莱基因技术公司);ECL超敏发光液(美国赛默飞公司);骨形成蛋白2型受体(bone morphogenetic protein receptor type 2, BMPR2)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、β-肌动蛋白抗体及辣根过氧化物酶标记的二抗(英国Abcam公司);Lipofectamine 3000转染试剂(美国Invitrogen公司);双荧光素酶报告检测试剂盒(上海碧云天生物技术公司);293T细胞(河北北纳生物科技公司);miR-216a模拟物、miR-216a抑制物(anti-miR-216a)、miR-301a模拟物、miR-301a抑制物(anti-miR-301a)、模拟物对照(miR-NC)及抑制物对照(anti-miR-NC)、BMPR2过表达质粒(pcDNA-BMPR2)及空白载体(pcDNA)均购自江西中洪博元生物公司。
1.2 主要方法
1.2.1 细胞培养 将HPASMC加入iCell原代平滑肌细胞基础培养基中,常氧组细胞于21% O2、5% CO2、74% N2的37 ℃恒温培养箱中培养48 h,缺氧组细胞于3% O2、5% CO2、92% N2的37 ℃培养箱中培养,根据HPASMC在缺氧环境下培养时间的不同分为3组,分别为缺氧12 h、缺氧24 h和缺氧48 h组。
1.2.2细胞转染 HPASMC传代培养至细胞密度达70%时,更换为无血清的培养基,根据Lipofectamine 3000试剂盒说明书,将miR-216a和miR-301a模拟物、anti-miR-216a、anti-miR-301a、miR-NC、anti-miR-NC、pcDNA-BMPR2及空白载体转染入HPASMC,转染4 h后加入血清含量为20%的完全培养基,放回缺氧培养箱中继续培养48 h后进行检测。
1.2.3 qRT-PCR 提取常氧组和各缺氧组HPASMC中的BMPR2 mRNA和miR-216a、miR-301a,紫外分光光度计检测RNA纯度和浓度,分别通过mRNA和miRNA逆转录试剂盒合成cDNA,将cDNA分别采用mRNA和miRNA荧光定量qPCR检测试剂盒进行扩增,反应步骤为预变性95 ℃,10 min;变性95 ℃,10 s;退火58 ℃,30 s;延伸72 ℃,30 s;40个循环。分别以β-肌动蛋白和U6作为mRNA和miRNA的内参,miR-216a、miR-301a、BMPR2 mRNA的相对表达量根据2-△△Ct法计算。miR-216a上游引物:5′-CGCGTCACAGTGGTCTCTGG-3′,下游引物:5′-AGTGCAGGGTCCGAGGTATT-3′;miR-301a上游引物:5′-CGCGCAGTGCAATAGTATTGT-3′,下游引物:5′-AGTGCAGGGTCCGAGGTATT-3′;BMPR2上游引物:5′-TTGCCGTCTTGCTCATTCT-3′,下游引物:5′-GTCTATTTCCAGTCAGCCTCAT-3′;β-肌动蛋白上游引物:5′-TGGCACCCAGCACAATGAA-3′,下游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.4 CCK8检测HPASMC增殖活力 将造模的HPASMC消化、重悬、计数、铺板,细胞密度为5×103个/孔,将细胞培养48 h后,待测的96孔板细胞换成相同的培养基,每孔加入10 μL CCK8试剂,置于培养箱中孵育2 h,酶标仪在450 nm波长处检测每孔的光密度值,并计算常氧和不同缺氧时间培养下HPASMC的存活率,以及缺氧环境下转染miR-216a或miR-301a抑制物,同时转染miR-216a或miR-301a联合pcDNA-BMPR2后HPASMC的存活率。
1.2.5 蛋白免疫印迹检测BMPR2、PCNA表达 使用RIPA细胞裂解液提取HPASMC中的蛋白,BCA试剂盒测定蛋白浓度。将蛋白质加热变性后,进行十二烷基苯磺酸钠凝胶电泳2 h,后用300 mA恒流转至PVDF膜80 min。将膜浸入5%脱脂奶粉封闭液中孵育2 h,4 ℃下与BMPR2抗体、PCNA抗体及β-肌动蛋白抗体孵育过夜,二抗溶液中室温孵育2 h。在PVDF膜上滴加ECL发光液,并在凝胶成像系统中曝光。采用Image-Pro软件分析各抗体条带灰度值。
1.2.6 双荧光素酶报告检测各转染组萤火虫荧光素酶和海肾荧光素酶活性 将含有miR-216a结合位点的BMPR2 3′-UTR的野生型(WT)和突变型(MUT)片段克隆到pmirGLO质粒上,分别构建BMPR2野生型荧光素酶载体(BMPR2 WT-1)和BMPR2突变型荧光素酶载体(BMPR2 MUT-1),用同样的方法构建与miR-301a结合位点互补的BMPR2 WT-2载体和BMPR2 MUT-2载体。将293T细胞铺板,待细胞完全贴壁后密度达70%时,将miR-216a、miR-301a、miR-NC和构建的BMPR2荧光素酶载体共转染293T细胞。转染48 h后裂解细胞,通过双荧光素酶检测法分别检测各转染组萤火虫荧光素酶活性和海肾荧光素酶活性,验证BMPR2与miR-216a、BMPR2与miR-301a之间的关系。
1.3 统计学分析
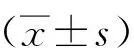
2 结果
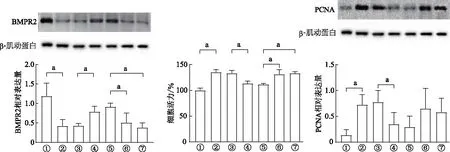
2.1 缺氧对细胞增殖活力及miR-216a、miR-301a、BMPR2表达的影响
CCK8结果显示,HPASMC的增殖活力随缺氧时间延长逐渐增加,Spearman相关性分析提示细胞增殖活力与缺氧时间呈正相关(r=0.865,P<0.001)。因为在本研究中缺氧48 h组细胞增殖活力最强,故后续实验选择缺氧48 h进行。qRT-PCR结果显示,miR-216a在缺氧24 h和48 h的表达水平均显著高于常氧组及缺氧12 h组(P<0.05),miR-216a表达与缺氧时间也呈正相关(r=0.870,P<0.001)。miR-301a在缺氧12 h、24 h和48 h组的表达量均高于常氧组(P<0.05),并且在缺氧24 h组表达量最高。BMPR2 mRNA的表达水平随着缺氧时间延长而逐渐降低,两者呈负相关(r=-0.978,P<0.001)。见图1。

①:常氧组,②:缺氧12 h组,③:缺氧24 h组,④:缺氧48 h组。a:P<0.05,与常氧组比较;b:P<0.05,与缺氧12 h组比较;c:P<0.05,与缺氧24 h组比较
2.2 缺氧环境下miR-216a、miR-301a对HPASMC增殖的影响
CCK8和蛋白免疫印迹结果显示,与常氧组比较,缺氧组HPASMC的细胞增殖活力增强,PCNA表达增加(P均<0.05),转染抑制物对照miR-NC几乎不影响缺氧组HPASMC的增殖活力及PCNA表达。转染miR-216a或miR-301a抑制物后,HPASMC增殖活力受到抑制,PCNA表达下降(P均<0.05),提示下调miR-216a或miR-301a抑制缺氧环境下HPASMC的增殖能力,间接表明缺氧条件下miR-216a、miR-301a能促进HPASMC的增殖(图2)。

①:常氧组,②:缺氧组,③:缺氧+anti-miR-216a-NC组,④:缺氧+anti-miR-216a组,⑤:缺氧+anti-miR-301a-NC组,⑥:缺氧+anti-miR-301a组。a:P<0.05,与常氧组比较;b:P<0.05;与缺氧组比较;c:P<0.05,与缺氧+anti-miR-216a-NC组比较;d:P<0.05,与缺氧+anti-miR-301a-NC组比较
2.3 BMPR2是miR-216a、miR-301a的靶基因
借助Starbase数据库(https://starbase.sysu.edu.cn)搜索发现miR-216a与BMPR2 mRNA的3′-UTR中的7个碱基互补,miR-301a也与BMPR2 mRNA的3′-UTR中的7个碱基互补,提示BMPR2可能是这两个miRNA分子的靶点(图3A)。双荧光素酶报告结果显示,miR-216a联合BMPR2 WT-1转染组的荧光素酶活性显著低于miR-NC联合BMPR2 WT-1转染组和单纯BMPR2 WT-1转染组(P均<0.05),而miR-216a联合BMPR2 MUT-1转染组的荧光素酶活性与miR-NC联合BMPR2 MUT-1转染组和单纯BMPR2 MUT-1转染组比较无显著差异(图3B),提示BMPR2是miR-216a的靶基因。同样,miR-301a联合BMPR2 WT-2转染组的荧光素酶活性显著低于miR-NC联合BMPR2 WT-2转染组和单纯BMPR2 WT-2转染组(P均<0.05),miR-301a联合BMPR2 MUT-2转染组的荧光素酶活性与miR-NC联合BMPR2 MUT-2转染组和单纯BMPR2 MUT-2转染组比较无显著差异(图3C),提示BMPR2也是miR-301a的靶基因。

A:Starbase数据库预测BMPR2分别与miR-216a、miR-301a的结合位点;B:双荧光素酶报告测定BMPR2与miR-216a之间的关系;C:双荧光素酶报告测定BMPR2与miR-301a之间的关系。①:BMPR2 WT-1组,②:BMPR2 WT-1+miR-NC组,③:BMPR2 WT-1+miR-216a组,④:BMPR2 MUT-1组,⑤:BMPR2 MUT-1+miR-NC组,⑥:BMPR2 MUT-1+miR-216a组,⑦:BMPR2 WT-2组,⑧:BMPR2 WT-2+miR-NC组,⑨:BMPR2 WT-2+miR-301a组,⑩:BMPR2 MUT-2组,:BMPR2 MUT-2+miR-NC组,:BMPR2 MUT2+miR-301a组。a:P<0.05,与BMPR2 WT-1组比较;b:P<0.05,与BMPR2 WT-1+miR-NC组比较;c:P<0.05,与BMPR2 WT-2组比较;d:P<0.05,与BMPR2 WT-2+miR-NC组比较
2.4 缺氧环境下miR-216a、miR-301a下调BMPR2基因促进HPASMC的增殖
蛋白免疫印迹结果显示,与常氧组比较,缺氧组BMPR2表达降低(P<0.05),转染了pcDNA-BMPR2后,HPASMC中的BMPR2表达升高(P<0.05)。与转染miR-NC联合pcDNA-BMPR2组相比,当转染了miR-216a或miR-301a联合pcDNA-BMPR2后,BMPR2明显下降(P<0.05),提示miR-216a或miR-301a抑制BMPR2的表达。与缺氧环境下转染空白载体比较,缺氧环境下转染pcDNA-BMPR2,CCK8结果显示细胞增殖活力降低(P<0.05),蛋白免疫印迹结果显示HPASMC中的PCNA表达下降(P<0.05),提示BMPR2抑制HPASMC的增殖。与转染miR-NC联合pcDNA-BMPR2组比较,当转染miR-216a或miR-301a联合pcDNA-BMPR2后,细胞增殖活力明显升高(P<0.05),PCNA表达也呈上升趋势,但差异无统计学意义。综上所述,缺氧环境下miR-216a或miR-301a通过抑制BMPR2,促进HPASMC的增殖。见图4。
①:常氧组,②:缺氧组,③:缺氧+pcDNA组,④:缺氧+pcDNA-BMPR2组,⑤:缺氧+miR-NC+pcDNA-BMPR2组,⑥:缺氧+miR-216a+pcDNA-BMPR2组,⑦:缺氧+miR-301a+pcDNA-BMPR2组。a:P<0.05
3 讨论
缺氧是引发PAH的重要因素之一。目前有关慢性缺氧引发PAH的机制尚未完全阐明,有研究表明缺氧可能通过促进大鼠PASMC中的烟酰胺腺嘌呤二核苷酸磷酸氧化酶4表达增加,诱导活性氧的产生,促进PASMC增殖[10]。新近研究发现缺氧还可诱导胶质瘤相关癌基因蛋白-1的异常表达,通过调控PASMC的增殖和焦亡过程,促进PAH的形成[11]。本研究结果显示,HPASMC的增殖活力随缺氧时间延长而逐渐增加,HPASMC在缺氧组中的PCNA表达水平高于常氧组,均提示缺氧环境能显著诱发肺血管平滑肌细胞增殖,促进肺血管重塑。
已有研究发现miR-130/301家族在HPASMC中表达上调,并通过抑制PPARγ表达,调控下游STAT3/miR-204信号通路,促进HPASMC增殖[9]。另有研究表明miR-130/301家族受转录调节因子YAP/TAZ激活,促进肺血管细胞外基质的重塑,参与PAH的形成[12]。目前有关miR-216a促进PAH形成机制的文献报道极少,Chinnappan等[8]通过对HIV病毒转基因大鼠注射可卡因以构建PAH模型,发现miR-216a在这类大鼠模型的PASMC中呈现高表达,进一步研究发现miR-216a通过沉默下游BMPR2基因表达,促进PASMC的增殖和迁移。而关于miR-216a在缺氧诱导PAH模型中的发病机制研究尚未见报道。本研究发现,随着缺氧时间延长,miR-216a表达水平增加;miR-301a在缺氧24 h的表达水平也显著高于常氧组和缺氧12 h组。通过下调缺氧环境中HPASMC的miR-216a和miR-301a表达,发现细胞增殖活力和PCNA表达均受到抑制,表明miR-216a和miR-301a可能参与PAH的发病过程。
BMPR2是转化生长因子(transforming growth factor, TGF)超家族中一类重要的细胞因子,已被发现与肺动脉高压的发病机制密切相关。Roberts等[13]报道BMPR2基因突变失活是特发性PAH的主要发病原因之一。Jiang等[14]发现在博莱霉素诱导PAH大鼠模型中,BMP9/BMPR2/SMAD信号传导通路受到抑制,继而导致肺微血管内皮细胞凋亡增加及肺血管平滑肌增厚。另有报道发现恢复BMPR2信号传导能够缓解甚至逆转肺血管重塑[15]。本研究发现BMPR2 mRNA表达随着缺氧时间延长而逐渐下降,对缺氧组HPASMC转染pcDNA-BMPR2,细胞增殖活力明显降低,PCNA表达下降,上述结果提示BMPR2具有抑制HPASMC增殖的作用。
目前,miRNA参与调节BMPR2基因或BMP/TGF-β信号通路诱导PAH形成机制的研究已成为学者广泛关注的热点。例如miR-17-92系列通过IL-6/STAT3信号通路下调BMPR2表达,对PASMC和肺血管内皮细胞发挥促增殖和抗凋亡作用[16]。miR-424/503通过上调Apelin基因,恢复BMPR2信号传导,抑制PASMC和肺血管内皮细胞增殖[17]。新近研究发现miR-182通过沉默髓系相关分化标志基因(myeloid-associated differentiation marker, MYADM),促进BMP/TGF-β信号通路传导,延缓缺氧诱导PAH的发病进程[18]。本实验通过双荧光素酶报告测定证实BMPR2是miR-216a、miR-301a的下游靶点。进一步研究表明,同时转染miR-216a或miR-301a联合pcDNA-BMPR2可显著抑制BMPR2表达水平,细胞增殖活力增强,PCNA表达上调,提示miR-216a、miR-301a通过抑制BMPR2参与缺氧诱导PAH的形成。
综上所述,缺氧条件下miR-216a和miR-301a均能促进HPASMC增殖,其作用机制与抑制下游BMPR2表达有关。本研究在设计上还存在以下不足:首先,本研究仅通过体外细胞实验来探讨miRNA参与PAH发病的相关机制,尚缺少动物实验及临床试验的验证;其次,PAH的发病过程不仅与PASMC的增殖有关,也和细胞的迁移、凋亡等多种生物学行为有关联。故今后有必要进一步探讨上述两个miRNA对缺氧环境下PASMC迁移及凋亡的影响,并研究潜在的信号传导通路,同时增加动物体内实验及临床试验来确认miR-216a和miR-301a在PAH发病中的作用。另外,近年来环状RNA(circRNA)与PAH关系的研究已成为学者关注的前沿热点,已发现circRNA可通过吸附miRNA(miRNA海绵作用),削弱miRNA对下游靶基因的抑制,上调靶基因的表达,参与疾病的发病过程[19]。今后可在本研究基础上继续探寻miR-216a、miR-301a上游可能参与PAH发病的circRNA,探索相关分子通路,为未来精准化治疗提供新的靶点。
