基因治疗在肺动脉高压中的研究进展
2022-05-31李尚吕婷婷张子睿孙岚
李尚, 吕婷婷, 张子睿, 孙岚
(中国医学科学院北京协和医学院药物研究所药物筛选中心,北京 100050)
肺动脉高压(pulmonary arterial hypertension, PAH)是由多种原因导致的肺循环阻力进行性升高的临床和病理生理综合征,它以肺血管重塑为特征,表现为血管内皮细胞异常增殖、平滑肌肥大和内膜增厚,最终右心功能衰竭而死亡。目前对于PAH的临床治疗主要是肺血管扩张药物,通过选择性作用于PAH相关分子通路:前列环素通路、内皮素通路与一氧化氮/环磷酸鸟苷通路等,靶向收缩血管,促进肺血管舒张,恢复心肺正常血流供应[1]。肺血管扩张剂虽然可以间接抑制细胞增殖并逆转血管重塑来缓解症状,但安全性低、价格昂贵且不能完全治愈疾病。调查显示,用药后患者的生存率并没有得到很大程度的提高[2]。随着遗传学、细胞学、分子生物学、生物信息学等学科的不断发展,以及对PAH发病机制的不断深入研究,基因技术作为一门新兴的技术,被广泛地应用于生命科学和医学研究的重要领域,为改善甚至治愈PAH提供了新的手段。
1 PAH的基因治疗
基因治疗可通过对基因进行替换、增补或敲除等纠正或补偿缺陷和异常基因引起的疾病,达到治疗效果。目前,采取基因治疗的方法,通过转移目的表达基因,在体内生成有治疗效果的产物如血管舒张因子、细胞生长因子、骨形态发生蛋白2型受体(bone morphogenic protein receptor 2,BMPR2)等是治疗PAH的重要方式。此外,研究人员对非编码RNA与PAH的病理、诊断和治疗关系的研究日渐深入,利用长链非编码RNA(long-noncoding RNA,lncRNA)与微小RNA(microRNA, miRNA)相互作用且miRNA可靶向目的基因的特性而产生的非编码RNA基因疗法也逐渐发展起来。PAH基因疗法的相关途径见图1。
1.1 血管扩张因子
1.1.1 一氧化氮合酶基因疗法 一氧化氮(NO)是一种内源性合成的、可扩散的气体信号分子,在肺循环过程中,参与调节肺血管张力、平滑肌收缩、血小板抑制以及血管重塑等多个生理过程[3]。一氧化氮合酶(NOS) 催化精氨酸氧化是NO的主要来源,其中,肺组织中的NO主要由内皮型NOS(eNOS)催化生成[4]。NO扩散进入肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)中,促进GTP转化为cGMP,使平滑肌细胞舒张,降低肺动脉压力[3]。NOS3基因转移对PAH的作用已在多种动物模型中得以研究,如Somani等[5]基于大鼠血液生长内皮细胞(rat blood outgrowth endothelial cells,rBOECs),以逆转录病毒为载体过表达eNOS,得到rBOEC/eNOS细胞,尾静脉注射于野百合碱(monocrotatine,MCT)诱导大鼠PAH模型,结果显示,与对照组相比,细胞注射组右心室收缩压降低,右心室肥大、肺小动脉肌化改善。Granton等[6]通过将NOS3基因转染的内皮祖细胞(endothelial progenitor cells,EPCs)经多孔肺动脉导管注入7名WHO Ⅲ级以上症状的特发性PAH患者的右心房,发现其总肺阻力有改善,短期血流动力学改善、运动能力持续增加。
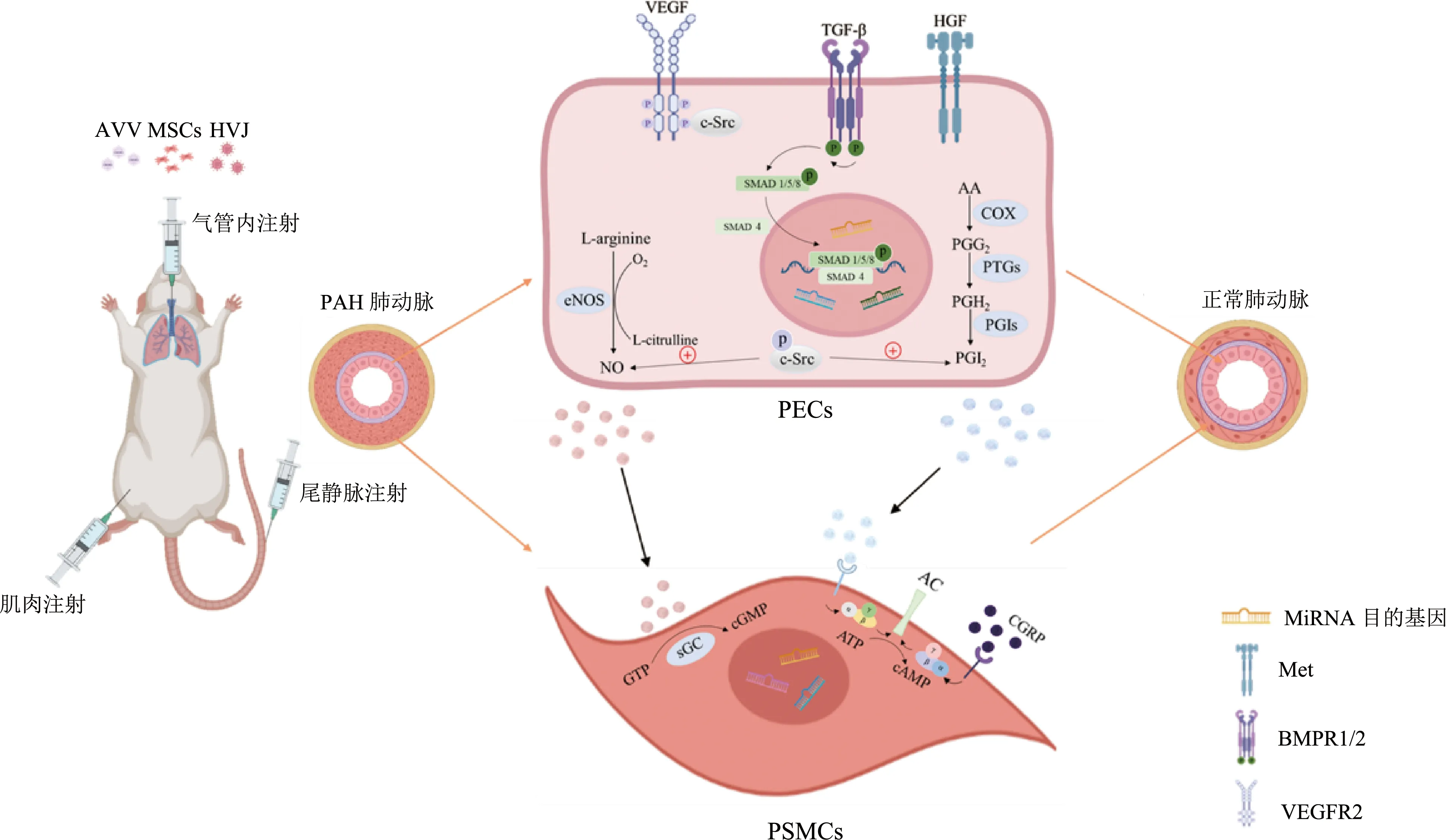
AAV:腺病毒;MSCs:间充质干细胞;HVJ:副流感病毒;PECs:肺内皮细胞;VEGF:血管内皮生长因子;VEGFR2:血管内皮生长因子受体2;c-Src:c-Src激酶;TGF-β:β转化生长因子;BMPR1/2:骨形态发生蛋白受体;HGF:肝细胞生长因子;Met:Met酪氨酸激酶;L-arginine:L-精氨酸;eNOS:内皮型一氧化氮合酶;L-citrulline:L-瓜氨酸;SMAD:SMAD蛋白;AA:花生四烯酸;COX:环氧合酶;PGG2:前列腺素G2;PTGs:前列腺素合酶;PGH2:前列腺素H2;PGIs:前列环素合酶;PGI2:前列环素;PSMCs:肺平滑肌细胞;AC:腺苷酸环化酶;CGRP:降钙素基因相关肽;GTP:三磷酸鸟苷;cGMP:环磷酸鸟苷;ATP:三磷酸腺苷;cAMP:环磷酸腺苷
1.1.2 降钙素基因相关肽基因疗法 降钙素基因相关肽(calcitonin gene-related peptide, CGRP)是高效的血管扩张剂,可以在受体介导下作用于上皮细胞和平滑肌细胞,激活腺苷酸环化酶生成cAMP,从而舒张血管[7],并可通过抑制肺动脉胶原的积累减缓PAH的进程和肺血管重构[8],在病理生理条件下具有调节肺循环的作用。在多种实验性PAH模型中,CGRP的基因转移治疗都被证明是有效的。在体外实验中,Li等[9]分离、体外扩增大鼠PASMCs后用含CGRP的腺病毒进行转导,表明CGRP的分泌可抑制PASMCs增殖。Zhao等[10]对腹主动脉-下腔静脉分流术诱导的大鼠PAH模型静脉注射表达CGRP的EPCs,发现表达CGRP的EPCs移植可有效改善PAH并逆转肺血管重构。Champion等[11]在小鼠慢性缺氧模型气管内注射表达CGRP前体的腺病毒,发现小鼠肺血管阻力降低,右心室肿大、肺血管重塑得到改善。
1.1.3 前列环素合酶基因疗法 前列环素(prostacyclin, PGI2)是一种由血管内皮细胞产生的高效的内源性血管舒张因子,具有强大的舒张血管、抑制血小板黏附以及抗增殖特性[12]。PGI2是前列环素合酶(PGIs)和环氧合酶(COX)催化内源性花生四烯酸产生的。PGI2可以通过影响PASMCs的增殖和凋亡,逆转肺血管重构[13],进而阻止PAH的发展。研究证实,在重度PAH患者肺毛细血管中PGIs的表达水平明显降低[14]。日本研究人员[15]以腺相关病毒(AAV)为载体,通过大腿注射AAV-PGIs,将PGIs转染到小鼠体内,小鼠肺血管阻力和肺动脉压降低。同时,小鼠副流感病毒(HVJ)包膜载体系统也应用于PAH大鼠的基因治疗,采用HVJ-脂质体法将PGIs转染到MCT诱导的PAH大鼠气管内,1周后PGI2的代谢产物显著增加,大鼠模型PAH显著改善。Wang等[16]利用超声波辅助基因转移在大鼠颌下腺表达Cox1-PGIs,数据显示循环PGI2显著升高,大鼠模型PAH同样得到改善。
1.2 细胞生长因子
1.2.1 血管内皮生长因子基因疗法 血管内皮生长因子(VEGF)具有促进内皮细胞增殖、提高血管通透性以及诱导新生血管和小动脉形成等作用[17]。VEGF在肺中含量丰富,可作为肺结构的维持因子来发挥作用。VEGF还可以通过 flk-1、KDR 信号通路激活c-Src激酶,诱导内皮细胞产生NO和PGI2,从而促进血管舒张[18]。实验研究证明,急性和慢性缺氧会导致肺中VEGF及其受体VEGFR1和VEGFR2表达增加[19],基因导入VEGF可减轻实验动物PAH的发生。尚峰等[20]将VEGF165转染的骨髓间充质干细胞(BMSCs)移植入MCT诱导的大鼠PAH模型中,观察到肺内损伤血管修复和血管新生现象。Farkas等[21]通过腺病毒载体介导VEGF治疗继发性PAH大鼠,其血管内皮细胞凋亡减少,血管生成增加,PAH显著改善。
1.2.2 肝细胞生长因子基因疗法 肝细胞生长因子(HGF)是目前已知生物活性最广泛的生长因子之一,能刺激血管内皮细胞增殖和迁移,且HGF具有减弱炎症细胞浸润,降低炎症因子表达,从而减少 PAH 中肺血管壁损伤的功能[22]。HGF通过降低肺动脉压,减少肺内膜颗粒,继而延缓右心室肥大、促进内皮细胞修复,最终抑制PAH的发生发展[23-24]。Wang等[25]气管内滴注HGF腺病毒(Ad-HGF)转染MCT-PAH大鼠,转染3周后测定血流动力学指标,HGF能显著降低PAH、右心室收缩压、血清血管紧张素Ⅱ和脑钠肽水平,还明显减轻了右心室肥大和胶原沉积。此外,Guo等[26]通过BMSCs移植过表达HGF与粒细胞集落刺激因子(G-CSF)联合治疗MCT-PAH大鼠,给药3周后,联合治疗组的大鼠右心室肥厚和平均肺动脉压明显降低,血管肌化及胶原沉积也明显减少,提示移植HGF-BMSCs联合G-CSF可协同治疗PAH。刘珍君等[24]于MCT诱导的大鼠模型PAH组中气管滴注携带HGF的腺病毒,结果显示模型组肺动脉压较大程度降低,肺内膜颗粒减少继而延缓右心室肥大,促进内皮细胞修复。
1.3 骨形态发生蛋白2型受体基因疗法
BMPR2是受体 TGF-β 超家族 “2 型”成员。其常染色体显性突变存在于大多数可遗传和家族性 PAH 病例中[27]。磷酸化的BMPR2受体促使1型受体磷酸化,后者又通过经典和非经典信号转导通路介导受体蛋白SMAD 1/5/8以及细胞外信号调节激酶 (ERK)等的磷酸化,进而促进转录因子的表达并激活MAPK、Notch等信号通路,从而影响血管内皮细胞的迁移、增殖和凋亡[28-29]。多项研究表明将野生型 BMPR2 递送至 MCT诱导缺氧大鼠模型的肺血管内皮可改善 PAH 相关的肺血流动力学参数并逆转肺血管系统的重塑,如Harper等[30]以腺病毒为载体,将BMPR2递送进入MCT诱导的大鼠肺高压模型中,与对照动物相比,大鼠右心室收缩压和平均肺动脉压力显著降低;Harper等[31]在大鼠MCT模型中静脉注射 BMPR2 表达增强的EPCs,结果显示该细胞主要在肺部积聚,并释放表达 BMPR2 的外泌体,PAH导致的右心室肥大、右心室收缩压以及平均肺动脉压的升高得到了改善。
1.4 其他目的基因转移疗法
除以上所转移的目的基因外,近年来,随着对PAH发病机制及其相关基因通路的不断深入研究,越来越多的目的基因被用于PAH的基因治疗,并在实验动物模型上取得了良好的治疗效果。如Ad5-Kv1.5 经口气管雾化可以恢复大鼠 PASMCs 对 O2敏感的 K+电流并降低肺血管阻力、改善右心室肥大[32];骨膜素可以通过NF-кB诱导iNOS基因的表达,并抑制人肺动脉内皮细胞(HPAECs)、人肺动脉平滑肌细胞(HPASMCs)和PAH实验小鼠模型中生长因子和HIF-1α的释放以及肺动脉内皮细胞(PAECs)中BMPR2的表达[33-34];在缺氧诱导的大鼠PAH模型中,选择性敲低 PAEC-Tph1,抑制了与血管重塑相关的血清素的释放,逆转了PAH的发展[35]。除此之外,心房钠尿肽(ANP)[36]、5-脂氧酶(5-LO)[37]、载脂蛋白A5(ApoA5)[38]、生存素(survivin)[39]、超氧化物歧化酶(SOD)[40]、基质金属蛋白酶1抑制剂(TIMP-1)等[41]的基因转移均可减轻大鼠等啮齿类动物PAH的发生。
1.5 非编码RNA与PAH
1.5.1 MiRNA与PAH miRNA大多数是由真核细胞RNA聚合酶Ⅱ转录形成的内源性非编码RNA,既可以通过直接与靶基因信使RNA(mRNA)结合,也可以与靶基因mRNA的3′端非编码区结合,影响基因的翻译,在生物的蛋白质合成过程中起到重要的调节作用[42]。近年研究表明,在PAH的发生发展过程中,miRNA可以通过靶向TGF-β、HIF-1、c-myc等重要的信号转导蛋白影响肺部平滑肌细胞和成纤维细胞的增殖、迁移和凋亡,以及PAH引起的右心室重构[43-45]。在体外细胞模型中,miR-181a-5p、miR-324-5p在HPAECs中的过表达抑制了细胞的增殖[46];miR-143-5p直接靶向HIF-1α促进缺氧条件下PASMCs的表型转换、增殖和迁移[47]。在PAH动物实验模型中,miR-145敲低的慢性缺氧小鼠模型右心室收缩压和右心室肥厚显著降低[48];慢病毒介导的 miR-150过表达抑制了缺氧诱导的大鼠右心室收缩压增加和心排出量减少[49]。表1是近5年部分miRNA的靶点及其在PAH中的功能。
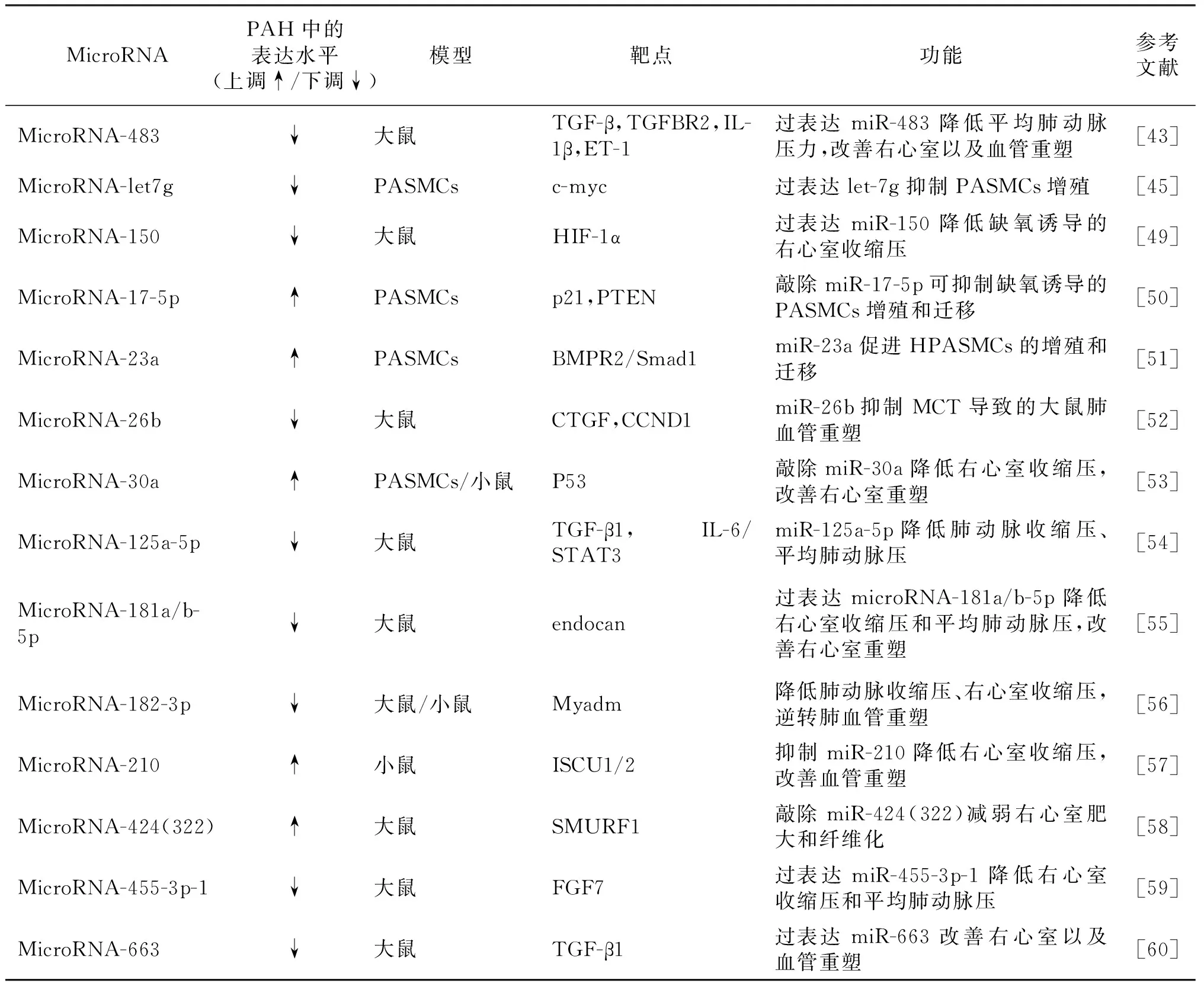
表1 miRNA在PAH模型中的靶点基因以及功能
1.5.2 LncRNA与PAH lncRNA与miRNA同属于非编码RNA家族,由真核细胞RNA聚合酶Ⅱ转录形成,在PAH的发展过程中,其可以与miRNA结合,发挥分子海绵的作用,产生lncRNA-miRNA-mRNA互作网络,调控细胞周期以及蛋白合成,进而调控PASMCs的增殖和凋亡。研究表明,lncRNA-Tug1与 miR-374c 结合上调 Foxc1[61],沉默Tug1可以下调 Foxc1从而抑制PASMCs增殖和迁移,同时促进其凋亡;lncRNA-SMILR可以靶向miR-141[62],敲除SMILR显著抑制MCT诱导的大鼠Rho/ROCK 活化和血管重塑;lncRNA-H19与miRNA let-7b结合[63]上调AT1R,发挥分子海绵作用,敲除H19可抑制小鼠PASMCs增殖,改善MCT诱导的肺血管重塑。除此之外,lncRNA还可以直接调节p53[64]、BRG1[65]、HOXA3[66]等的基因表达,发挥改善PAH的作用。
2 问题和展望
尽管PAH的发病相关基因通路已经得到了广泛研究,基因治疗也在动物实验模型中取得了一定的治疗效果,但在临床应用上,基因治疗仍具有巨大的挑战。
2.1 基因传递系统
将非病毒载体和腺病毒或腺相关病毒载体高效率地通过肺上皮气管或肺内皮血管输送到肺部的准确部位,提高靶向性和安全性,克服可能诱发的炎症和免疫反应,是仍需解决的一大问题。因此,开发高效安全的基因传递系统是非常有必要的。
2.2 基因联合治疗
近年来,疾病的联合用药发展迅速,用于治疗PAH的曲前列环素与ETRA(内皮素受体拮抗剂)、PDE5i(5型磷酸二酯酶抑制剂)或sGC(可溶性鸟苷酸环化酶)刺激剂合用可大大降低心血管意外的发病风险[67];与单药治疗相比,安立生坦和他达拉非的前期联合治疗可将临床失败的相对风险降低 50%[68];波生坦(口服内皮素受体拮抗剂)和依前列醇(前列腺素)的联合治疗,使患者的血流动力学、运动能力和功能等级都有所改善[69]。可将联合用药的思路应用到基因治疗中。通过两种或多种基因的转移,可以充分利用不同基因产物的特性,在减少相关不良反应发生的同时产生协同治疗效果。
总而言之,随着基因治疗技术的不断发展,其在PAH治疗中的价值是不可忽视的,如何进一步解决现有的各种问题并开展后续的临床试验,是研究工作的当务之急。相信在不久的将来,基因技术在PAH治疗中的运用能取得突破性的进展。
