基于羧基化石墨烯-海藻酸钠复合材料的脱落酸电化学免疫传感器的构建及应用
2022-05-30董宏图周思蒙王清涛王成罗斌李爱学
董宏图 周思蒙 王清涛 王成 罗斌 李爱学
摘要:脱落酸(Abscisic Acid ,ABA )是一种重要的植物激素,在种子和芽休眠、器官大小控制、植物衰老和死亡等发育过程中发挥作用,同时调控植物的生物与非生物胁迫。为快速、准确地测定植物体内 ABA 的含量,本研究开发了一种新型的 ABA 免疫传感器。通过在电极表面修饰羧基化石墨烯( GR-COOH )及海藻酸钠(Sodium Alginate , SA )来增加抗体的固定量,从而提高传感器的检测性能。对 GR-COOH 、SA、 ABA 抗体的浓度进行了优化,根据 ABA 抗体和抗原的结合导致电极阻抗发生变化的原理,实现了 ABA 的检测。传感器在10 pmol/L~1μmol/L 范围内与 ABA 浓度呈线性关系,实测的检测下限为10 pmol/L ,具有较好的稳定性和选择性。进一步以感染柑橘黄龙病的脐橙为研究对象,通过制备的基于 GR-COOH-SA 复合材料的 ABA 免疫传感器检测了黄龙病菌侵染下脐橙叶片中 ABA 的含量变化。结果表明,脐橙感染黄龙病后,叶片中 ABA 的含量增加,从而表明 ABA 在植物的抗病反应中发挥重要作用。进一步研究了 ABA 合成途径中关键酶的基因CitZEP表达量的变化,植株感病后基因表达量升高,传感器测得的 ABA 含量升高与传感器的检测结果相符,表明基于 GR-COOH-SA 复合材料的 ABA 免疫传感器具有较好的实用性。
关键词:脱落酸;免疫传感器;电化学;黄龙病;羧基化石墨烯;抗体
中图分类号:TP212;TN702;TP216 文献标志码:A 文章编号:SA202202007
引用格式:董宏图, 周思蒙, 王清涛, 王成, 罗斌, 李爱学.基于羧基化石墨烯-海藻酸钠复合材料的脱落酸电化学免疫传感器的构建及应用[J].智慧农业(中英文), 2022, 4(1):110-120.
DONG Hongtu, ZHOU Simeng, WANG Qingtao, WANG Cheng, LUO Bin, LI Aixue. Construction and application of a novel abscisic acid electrochemical immunosensor based on carboxylated graphene-sodium alginate nanocom‐posite[J]. Smart Agriculture, 2022, 4(1):110-120.(in Chinese with English abstract)
1 引言
脫落酸( Abscisic Acid ,ABA )作为一种重要的植物激素,主要负责调节植物的生长发育[1],调控植物果实发育成熟[2],抑制整株植物或单个器官的生长[3]。在受到不利环境因素影响后,ABA 可对下游基因进行有效地控制,进而对环境产生适应性。ABA 在植物抗病反应过程中也具有重要作用,可作为直接或间接信号参与到植物的抗性反应中[4]。研究表明 ABA 可通过促进植物气孔关闭,阻断许多病原体的侵入[5]。因此,研究植物感病后体内 ABA 的含量变化对于研究植物的抗病反应非常重要。传统植物激素测定方法有生物鉴定法[6] 、免疫法[7]、光谱法[8,9]等。当前常用的检测方法有超高效液相色谱法(Ultra Performance Liquid Chromatography, UPLC )、高效液相色谱(High Performance Liq‐ uid Chromatography , HPLC )和液相色谱-串联质谱法(Liquid Chromatograph Mass Spectrome‐ ter/ Mass Spectrometer ,LC-MS/MS )等,但是这些检测方法操作比较复杂,并且需要大型的仪器,因此需要建立一种简单、灵敏、快速的植物体内 ABA含量的检测方法。
电化学传感器具有灵敏度高、操作方便、检测快速等优点,受到了广泛青睐[10, 11]。Li 等[12]提出了基于纳米金修饰膜构建的 ABA 阻抗型免疫传感器,检测范围1.89~1.89×104 nmol/L ,检测下限达到0.378 nmol/L 。李巍等[13]研制出一种基于纳米金/硫堇修饰金电极的 ABA安培免疫传感器,该传感器基于 H2O2-HRP-硫堇催化波体系构建,检测范围1.89~3.78×103 nmol/L ,检测下限达到0.756 nmol/L 。而植物体内 ABA 含量甚微,一般在10~50 ng/g. FW ,且在逆境下含量会迅速增多[14]。因此,为了能够更准确地检测植物体内 ABA 含量变化,需要进一步研发检测下限更低、检测范围更宽的 ABA传感器。
石墨烯(Graphene , GR )是一种优良的二维纳米材料,具有独特的片层结构,从而具有较大的比表面积,广泛应用于传感器领域。羧基化的石墨烯( GR-COOH )具有较多的羧基,因而更有利于下一步对 ABA 抗体的修饰。海藻酸钠(Sodium Alginate ,SA )是一种天然的线性多糖,具有较好的生物相容性、稳定性及一定的粘附性,并且其上带有大量的羧基可用于交联抗体[15]。为了增加抗体的固定量,本研究通过 GR- COOH 和 SA 的复合材料来修饰电极,并通过碳二亚胺( Carbodiimide ,EDC )/羟基丁二酰亚胺( N-Hydroxy Succinimide ,NHS )交联 ABA 的单克隆抗体,进而制备 ABA 免疫传感器[16-19]。利用电化学阻抗法进行 ABA 的检测。然后利用研制的传感器对感染柑橘黄龙病的脐橙叶片中的 ABA 含量进行了检测,为快速、准确获取植物体内 ABA含量提供了检测方法。
2 材料与方法
2.1化学品和材料
GR-COOH 购自纳米材料科技有限公司(南京); SA 、Nafion (全氟磺酸)、 ABA 、ABA-Antibody (脱落酸抗体)、 EDC 、NHS 、水杨酸、生长素、赤霉素、苹果酸、柠檬酸和琥珀酸购自Sigma-Aldrich 公司( 上海);丝网印刷电极(Screen Printing Electrode , SPE )购自Xenslet生物科技有限公司;琼脂糖、10, 000×GeneGreen核酸染料购自北京天根生化;2×Taq PCR Star‐Mix 、 DNA Marker D2000、StarSpin快速植物DNA 提取试剂盒购自北京康润诚业生物科技有限公司; RNA 提取试剂盒、PrimeScriptm RT re‐agent Kit ( Perfect Real Time )、 TB Green? Pre‐mix Ex Taqm II ( Tli RNaseH Plus )购自 Takara 公司。试验所用水均为超纯水。
2.2电镜表征
采用清华大学高分辨场发射扫描电子显微镜( ZEISS ,SEM 500,德国),加速电压15 kV ,获得扫描电镜 (Scanning Electron Microscope,SEM )图像。
2.3 ABA 免疫传感器制作方法
ABA免疫传感器使用丝网印刷电极( SPE是传统的三电极体系,由碳基工作电极和对电极,以及银/氯化银参比电极组成)制备,将不同浓度的 GR-COOH溶解在1 mL不同浓度 SA水溶液中,超声波处理30 min ,之后添加0.5% Nafion溶液、20 mmol/L EDC 、50 mmol/L NHS 进行超声处理,制得 GR-COOH-SA 复合材料。后将复合材料滴加到电极表面,室温干燥。接着将ABA 抗体滴加到电极表面,自然干燥,然后将牛血清白蛋白( Bovine Albumin ,BSA )滴加在電极表面,封闭非特异性吸附位点。制作过程如图1所示。
2.4电化学测量
试验在 CHI760E 电化学工作站(上海,中国)进行。循环伏安法采用电压为-0.2~0.6 V,扫描速率为0.05 V/s 。将制备好的传感器在一定浓度的 ABA 溶液中孵育1 h ,用超纯水仔细冲洗。然后将其浸入2 mmol/L 铁氰化钾溶液中,使用电化学阻抗方法 (Electrochemical Imped‐ance Spectroscopy , EIS ) 进行检测,并通过Zview软件拟合阻抗数据。
2.5柑橘培养及样品制备
利用研制的传感器对感染柑橘黄龙病的脐橙叶片中的 ABA 含量进行检测。在2020年1月,选取感染柑橘黄龙病脐橙病芽条,利用贴接法对5株健康脐橙进行接菌处理。接菌6个月后进行症状分析。利用传感器检测脐橙叶片 ABA 步骤如下。
(1) DNA提取与检测。选择疑似带菌脐橙,每株取1片中上部叶片,用剪刀取叶中脉,剪成1 mm 左右小段,放入2 mL 离心管中(加5 mm 钢珠),液氮预冷之后,震荡研磨2min ,利用十六烷基三甲基溴化铵法(Cetyltrimethylammoni‐ um Bromide ,CTAB )[20]进行 DNA提取。根据文献报道[21],选取引物 A2/J5对疑似带菌植株 DNA 进行聚合酶链式反应 (Polymerase Chain Reaction ,PCR )检测(表1),通过对退火温度进行55~60℃阶梯式扩增,最终选择条带特异性最好的58.5℃作为退火温度,对 PCR 产物进行琼脂糖凝胶电泳分析。
(2) ABA 萃取。采集经 PCR 鉴定带菌的脐橙叶片和健康脐橙叶片各取6片,其中健康叶片为对照,向研钵中加入液氮进行研磨,待叶片磨碎呈绿色粉末后,称取1 g 粉末放入10 mL 离心管中,加入预冷的80%甲醇2 mL 充分搅拌,在4℃环境下萃取浸提6h ,进行脱落酸提取。完成后,向浸提液中加入1 mL 氯仿,旋涡震荡10 s ,4℃、12,000 r/m离心5 min ,弃上清,温室下氮气吹干,用 5 mL 磷酸缓冲盐溶液( Phos‐phate Buffered Saline ,PBS )(pH7.4)溶解样品。
2.6脐橙总 RNA 提取与cDNA 合成
总 RNA的提取参考柱式法植物 RNA小量提取试剂盒( TaKaRaMiniBEST Plant RNA Extrac‐tion Kit )说明书。
cDNA 合成参考反转录试剂盒PrimeScript?RT Master Mix ( Perfect Real Time )说明书,在RNase-free PCR 管中加入200 ng RNA ,2μL 5×PrimeScript RT Master Mix ,用 RNase-free ddH2O补至10μL 。反应程序为: 37℃延伸15 min,85℃失活5 s 。加入90μL ddH2O 混匀,-20℃保存。
2.7实时荧光定量 PCR
选择 ABA 合成过程关键基因玉米黄质环氧化酶基因( CitZEP )进行荧光定量分析[22],肌动蛋白( Actin )作为内参基因。引物序列见表2(生工生物工程(上海)股份有限公司)。20?L反应体系: cDNA 模板2μ L ,2×Mix 10?L ,10?mol/L 上下游引物各1?L , ddH2O 6?L 。反 60℃退火1 min ,40个循环扩增,得到 Ct值。应程序:95℃预变性15 min;94℃变性15 s;
3 试验结果与讨论
3.1修饰过程的形貌分析
利用 SEM 对 SPE 电极、GR-COOH-SA/SPE 电极、ABA-Ab/GR-COOH-SA/SPE 电极、BSA/ ABA-Ab / GR-COOH-SA /SPE电极形貌进行表征(图1)。裸的 SPE电极(图2(a)) 表面光滑干净,无其它杂质沉积。当电极修饰上 GR-COOH-SA复合材料后(图2(b)),在电极表面形成了一层致密的膜结构。对传感器进行抗体修饰后(图2(c)),电极表面出现了大量均匀分布的颗粒,表明 ABA单克隆抗体已经修饰在电极表面。进一步修饰了 BSA后(图2(d)),电极表面出现一些类似岛状的结构,可能是蛋白分子的增加导致发生了一定的聚集,从而表明 BSA 蛋白分子修饰在了电极表面。
3.2传感器检测ABA 的可行性分析
图3是研究 ABA 免疫传感器检测实际场景,利用 GR-COOH/SPE 及 GR-COOH-SA/SPE 传感器检测 ABA可行性。
将 GR-COOH (1.25 mg/mL)及 GR-COOH-SA ( GR-COOH 1.25 mg/mL , SA 1.25 mg/mL)修饰后的电极分别浸入10 nmol/L ABA 中,孵育1 h 后,检测阻抗值的变化。结果表明,在10 nmol/L ABA孵育后,GR-COOH-SA/SPE电极检测的Rct变化值△Z:
△Z=Z1-Z0 (1)
其中,Z1为电极与一定浓度 ABA 反应后的阻抗值,Ω;Z0为电极修饰 BSA后的阻抗值,Ω。GR-COOH-SA/SPE 的△Z 约为 GR-COOH/SPE 电极的2.5倍,表明 GR-COOH与 SA两种材料的组合使传感器具有更强的检测信号,可以提高传感器的检测性能,因此在后续试验中选择 GR-COOH-SA复合材料修饰电极(图4(a))。
为检测免疫传感器是否制备成功,对传感器制备过程中的每个修饰环节分别用循环伏安(Cyclic Voltammetry , CV )和 EIS 进行了表征。 CV 结果如图4(b)所示,在 [ Fe(CN)6]3?/4?溶液中,与裸 SPE 电极相比(图4(b)曲线 a),当电极表面修饰上 GR-COOH-SA 复合材料后(图4(b)曲线 b),氧化还原峰电流出现了下降,这可能是由于 GR-COOH-SA 复合材料导电性较差,抑制了探针分子的电子转移。在孵育上 ABA 抗体后(图4(b)曲线 c),氧化还原峰电流下降,这主要是由于抗体分子的绝缘性导致的,该结果表明抗体分子成功修饰在了电极表面。当 BSA (图4(b)曲线 d)依次修饰在电极表面后,峰电流继续减小。这主要是由于 BSA 蛋白分子的绝缘性导致的,从而表明了 BSA 分子的成功修饰。修饰过程的阻抗图谱如图4 (c)所示,其结果可以通过拟合电路进行拟合图4(c)。在电极表面修饰 GR-COOH-SA 复合材料后(图4(c)曲线 b),与裸电极相比(图4 (c) 曲线 a , 317.3Ω),阻抗值增加到352.7Ω,这主要是由于 GR-COOH-SA 复合材料导电性较差所致;添加 ABA 单克隆抗体后(图4(c)曲线 c),由于抗体分子不导电,电极的阻抗显著增加,为526Ω;进一步加入 BSA蛋白后 (图4 (c) 曲线 d),阻抗进一步增加到607.1Ω。EIS 的结果与 CV 一致,都证明了传感器的成功构建。
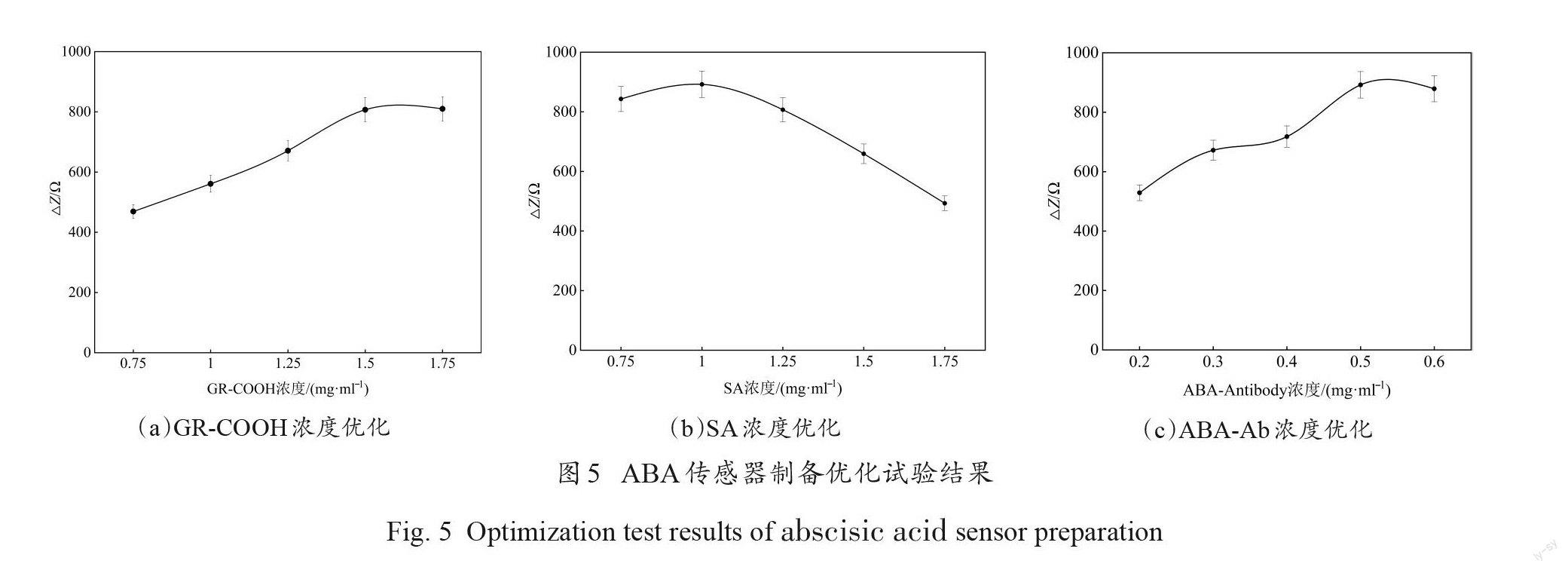
3.3制备优化
为使免疫传感器具有更好的检测性能,对 GR-COOH 浓度、SA 浓度、ABA 抗体浓度等进行了优化。复合材料中选择浓度范围为0.75~1.75 mg/mL 的 GR-COOH 进行了优化,利用10 nmol/L ABA 检测优化的效果。如图5(a)所示, SPE 工作电极在 GR-COOH 浓度范围为0.75~1.5 mg/mL时,△Z持续增加,到1.5 mg/mL 时△Z达到最大。1.5 mg/mL后 GR-COOH浓度进一步增加,△Z 变化趋于稳定。因此1.5 mg/mL为 GR-COOH最佳浓度。
为研究 SA 的最佳浓度,试验中分别测试了免疫传感器在含有不同浓度 SA 的混合物修饰后的阻抗变化。选择 SA 的浓度范围为0.75~1.75 mg/mL 。将5种不同浓度 SA 分别添加在混合修饰物中充分混匀。 SA 浓度范围在0.75~1 mg/mL 时(图5(b)),随着浓度升高△Z呈明显增加趋势,到1 mg/mL时△Z达最大。1 mg/mL后, SA浓度进一步增加,△Z明显下降。因此,选择1 mg/mL为 SA的使用浓度。
ABA 抗体浓度的大小会对响应结果产生影响。试验中对 ABA 抗体浓度进行了优化。选择ABA抗体浓度范围为0.2~0.6 mg/mL ,分别将不同浓度的抗体滴加在工作电极表面。如图5(c)所示,△ Z 随着 ABA 抗体浓度增加而增大。0.5 mg/mL 时△Z 达到最大。进一步增加抗体浓度,△Z减小。可能是电极表面抗体达到了平衡或饱和状态,不能容纳更多的抗体。据此认为0.5 mg/mL 为制备 ABA 免疫傳感器的最佳抗体浓度。
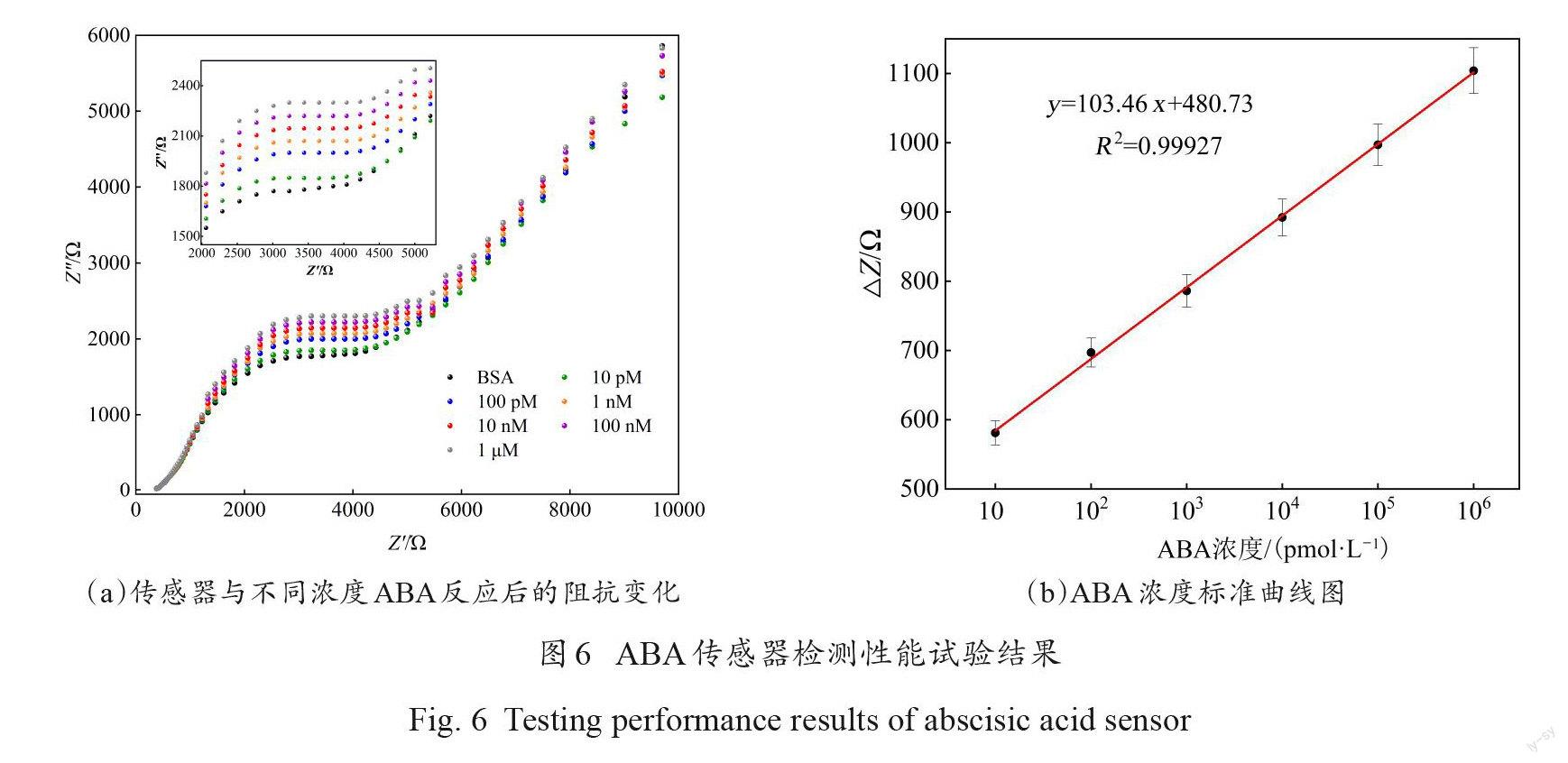
3.4檢测性能测试
依次用不同浓度的 ABA 与修饰后的电极反应,然后进行阻抗测试。图6(a)显示免疫传感器的△Z随着 ABA 孵育浓度的增加而不断升高。图6(a)插图为取其中一段的放大图。当 ABA孵育浓度范围在10 pmol/L~1μmol/L 时,该传感器的阻抗值变化与 ABA 的浓度呈线性相关(图6(b)),线性方程为:
y =103.46x+480.73 (2)
其中,R2=0.99927。检测下限的实测结果为10 pmol/L。
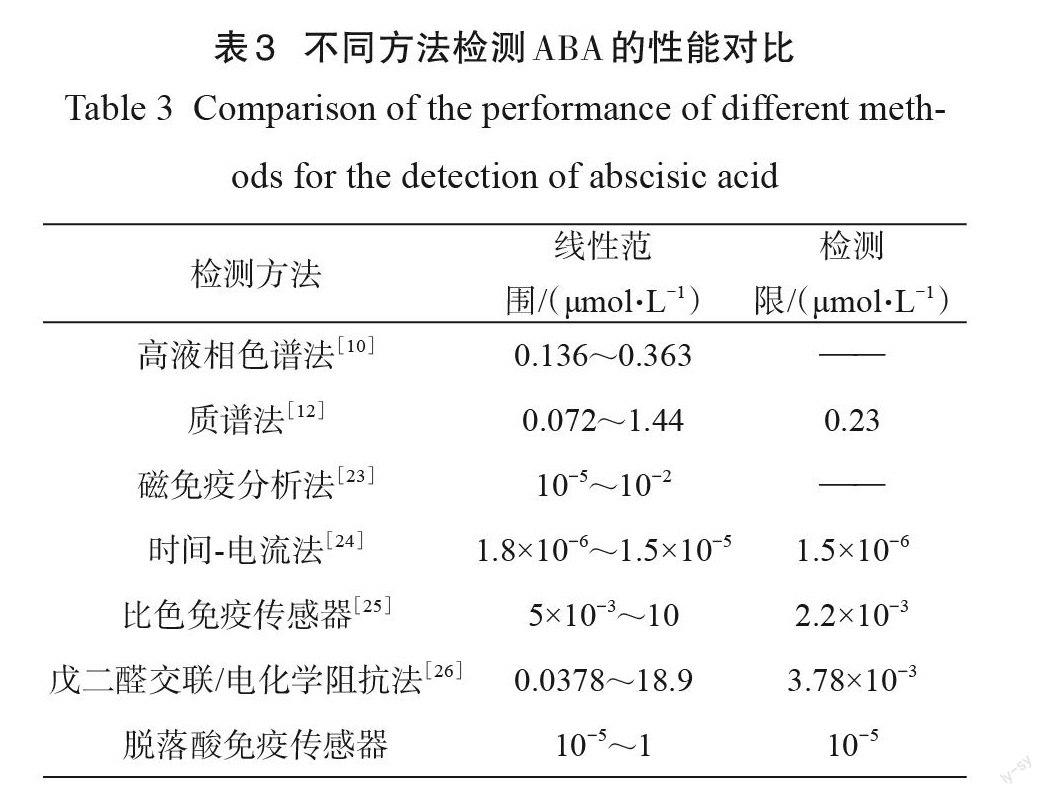
比较文献报道中的多种方法与本研究制备的传感器的结果(表3),发现本研究制备的 ABA免疫传感器检测限较低,线性范围较宽,其检测性能获得了进一步提高。
ABA检测中,可能会存在其它物质的干扰。因此,对该传感器的选择性进行了测试。选择水杨酸、生长素、赤霉素、苹果酸、柠檬酸、琥珀酸和 ABA 分别用于与本研究制备的 ABA免疫传感器反应。如图7所示,相同浓度下(10 nmol/L), ABA 产生的阻抗响应显著高于其他干扰物质。表明该免疫传感器具有较高的选择性。
在同等条件下应用等浓度的 ABA 溶液对该传感器进行多次实验,以检测该传感器的重现性。 5根 ABA 免疫传感器的相对标准偏差( Relative Standard Deviation , RSD ) 为4.87%(图8(a))。在4℃条件下储存两周后,该传感传感器非常稳定。
3.5感染柑橘黄龙病脐橙植株叶片中 ABA 的含量检测
3.5.1 脐橙植株接菌情况检测
进行接菌的5株脐橙中,3 株脐橙叶片具有典型的沿叶脉间隙斑驳黄化,新生叶片较小的感染柑橘黄龙病特征,初步判定为疑似带菌植株(图9)。通过对疑似感病植株 DNA 进行 PCR 扩增、琼脂糖凝胶电泳,在电泳图700bp左右出现条带,即确定该植株接菌成功,如图10所示。植株1、2成功感染黄龙病菌,因此选定植株1、2作为后续试验样本。
用制备的 ABA 传感器对经过预处理的感染柑橘黄龙病的脐橙植株及健康植株叶片的匀浆液进行阻抗试验,每组三个重复,结果如图11所示。健康叶片的△Z 为72 ohm ,染病叶片的△Z为823 ohm 。将两次△Z 值代入标准曲线可得感病叶片中 ABA 的含量为10 nmol/L ,而健康叶片中△Z 太小,超出检测范围,不能计算出其含量。表明脐橙叶片受到病害侵染后,体内脱落酸水平呈上升趋势,此结果与之前的报道一致[27]。
本研究是第一次使用电化学传感器对柑橘黄龙病害中 ABA 的含量水平进行检测,表明 ABA 免疫传感器具有较大实际应用潜力。
3.5.2 可靠性试验
为验证试验结果的可靠性,从分子角度研究植物感病后对体内 ABA 合成的影响,本试验分别对健康及感病脐橙叶片进行取样、RNA提取、 cDNA 合成,通过荧光定量 PCR 检测 ABA 合成途径中重要酶基因CitZEP在正常及感病状态下的表达量,如图12所示。结果表明,健康脐橙基因CitZEP的表达量为1.003,受到柑橘黄龙病的影响,感病脐橙叶片内 ABA 的CitZEP基因在病菌胁迫下表达量提高,基因CitZEP的表达量达到1.332,表明病菌胁迫提高了 ABA合成关键酶基因CitZEP的表达。可能由此引起了 ABA含量的增加。表明 ABA 参与了脐橙感染黄龙病的过程,但具体的作用机制有待进一步研究。
此结果与通过构建测的传感器测得柑橘感染黄龙病后 ABA含量增加的结果一致。
4 结论
本研究研制的 ABA 电化学免疫传感器,利用 GR-COOH-SA 复合材料修饰增强了传感器检测信号强度,通过对 GR-COOH浓度、SA浓度、 ABA 抗体浓度进行了优化,提高了免疫传感器的检测性能。
该传感器的线性范围较宽 (10 pmol/L~1μmol/L),检测限较低(10 pmol/L),具有较高的选择性及稳定性。
利用制备的该传感器对感染柑橘黄龙病脐橙样本叶片 ABA 含量进行了检测,为快速获取病害侵染后植物体内 ABA含量提供了新手段。
参考文献:
[1] LI W, DE OLLAS C, DODD I C. Long-distance ABAtransport can mediate distal tissue responses by affect-ing local ABA concentrations[J]. Journal of IntegrativePlant Biology, 2018, 60(1):16-33.
[2] WENG L, ZHAO F, LI R, et al. The zinc finger tran-scription factor SlZFP2 negatively regulates abscisicacid biosynthesis and fruit ripening in tomato[J]. PlantPhysiology, 2015, 167(3):931-949.
[3] LIANG C, WANG Y, ZHU Y, et al. OsNAP connectsabscisic acid and leaf senescence by fine-tuning abscis-ic acid biosynthesis and directly targeting senescence-associated genes in rice[J]. Proceedings of the NationalAcademy of Sciences of the United States of America,2014, 111:10013-10018.
[4] 王忠.植物生理学[M].北京:中国农业出版社, 2008.
[5] MELOTTO M, UNDERWOOD W, HE S. Role of sto-mata in plant innate immunity and foliar bacterial dis-eases[J]. Annual Review of Phytopathology, 2008, 46:101-122.
[6] 马泳.种子活力与萌发的生理与分子机制研究进展[J].农民致富之友, 2017(10):49.
MA Y. Advances in research of physiological and mo-lecular mechanism in seed vigor and germination[J].China &World Economy, 2017(10):49.
[7] MALDINEY R, LEROUX B, SABBAGH I, et al. A bi‐otin-avidin-based enzyme immunoassay to quantify three phytohormones: Auxin, abscisic acid and zeatin- riboside[J]. Journal of Immunological Methods, 1986, 90(2):151-158.
[8] 印天壽, 陈世勇.赤霉素的快速分光光度测定法的研究[J].分析化学, 1990, 18(10):966-969.
YIN T, CHEN S. Rapid spectrophotometric determina‐tion of gibberellins[J]. Chinese Journal of Analytical Chemistry, 1990, 18(10):966-969.
[9] 吴少伯.赤霉素荧光测定的光谱特征[J].植物生理学报, 1990(4):56-58.
WU S. Characteristics of spectra in fluorimetry for GA3[J]. Plant Physlology Communications, 1990(4):56-58.
[10] LOW S S, LOH H S, BOEY J S, et al. Sensitivity en‐hancement of Graphene/Zinc Oxide nanocomposite- based electrochemical impedance genosensor for sin‐gle stranded RNA detection[J]. Biosensors &Bioelec‐tronics, 2017, 94:365-373.
[11] LI Z, HUANG X, HU J, et al. Synthesis and electro‐chemical performance of three-dimensionally ordered macroporous CoCr2O4 as an anode material for lithium ion batteries[J]. Electrochimica Acta, 2017, 247:1-11.
[12] LI Y, XIA K, WANG R, et al. An impedance immuno‐sensor for the detection of the phytohormone abscisic acid[J]. Analytical & Bioanalytical Chemistry, 2008, 391(8): ID 2869.
[13]李巍 , 黄志刚 , 李合松 , 等.基于纳米金/硫堇修饰金电极的脱落酸安培免疫传感器的研制(英文)[J].传感技术学报, 2008, 21(8):1301-1306.
LI W, HUANG Z, LI H, et al. Research of amperomet‐ric immunosensor based on gold nanoparticle/thionine modified gold electrode for the detection of abscisic ac‐ id[J]. Chinese Journal of Sensors and Actuators, 2008, 21(8):1301-1306.
[14]潘瑞炽.植物生理学(第六版)[M].北京:高等教育出版社, 2008.
[15] DUDOLADOV A O, ALEKHINA M B, TSY ‐GANKOV P Y. Kinetic patterns of the adsorption of air macrocomponents on nanocomposites based on calci‐ um alginate and carbon nanotubes[J].2021, 95(6):1200-1206.
[16] CAO K, JIANG Z, ZHAO J, et al. Enhanced water per‐meation through sodium alginate membranes by incor‐porating graphene oxides[J]. Journal of Membrane Scrence, 2014, 469:272-283.
[17] DE C?SSIA MENDONA J, ROCHA L RDA, CAPE ‐LARI T B, et al. Design and performance of novel mo‐lecularly imprinted biomimetic adsorbent for precon‐centration of prostate cancer biomarker coupled to elec‐trochemical determination by using multi-walled car‐bon nanotubes/Nafion/Ni(OH)2-modified screen-print‐ed electrode[J]. Journal of Electroanalytical Chemistry,2020(878): ID 114582.
[18] KOZLOWSKA J, SIONKOWSKA A, OSYCZKA AM, et al. Stabilizing effect of EDC/NHS and DHTcrosslinking on the properties of collagen/hydroxyapa‐tite scaffolds[J]. Polymer International, 2017, 66(8):1164-1172.
[19] ESLAHI N, SIMCHI A, MEHERJOO M, et al. Hybridcross-linked hydrogels based on fibrous protein/blockcopolymers and layered silicate nanoparticles: Tunablethermosensitivity, biodegradability and mechanical du‐rability[J]. RSC Advances, 2016, 6(67):62944-62957.
[20]董宏圖, 王晓冬, 侯佩臣, 等.柑橘黄龙病早期诊断的PCR 检测技术优化[J].浙江农业科学 , 2021, 62(4):750-754.
DONG H, WANG X, HOU P, et al. Optimization ofPCR system for detection of citrus Huanglongbing[J].Journal of Zhejiang Agricultural Sciences, 2021, 62(4):750-754.
[21] FUJIKAWA T, IWANAMI T. Sensitive and robust de‐tection of citrus greening (Huanglongbing) bacterium'CandidatusLiberibacter asiaticus' by DNA amplifica‐tion with new 16SrDNA specific primers[J]. Molecularand Cellular Probes, 2012, 26:194-197.
[22]吴建宇, 盖钧镒.接种玉米矮花叶病毒对抗性不同的玉米自交系内源激素的影响[J].植物病理学报 ,2001, 31(3):286-287.
WU J, GAI J. Effect of inoculating maize dwarf mosa‐ic virus on the endogenous hormones of inbred lineswith different resistance[J]. Acta Phytopathologica Si‐nica, 2001, 31(3):286-287.
[23]周国华.基于纳米材料的植物激素免疫检测及受体分离分析新方法研究[D].武汉:武汉大学, 2014.
ZHOU G. Nano materials-based new methods for planthormone immunoassays and receptor separations[D].Wuhan: Wuhan University , 2014.
[24]刘俊桃.超微电极电化学实时检测植物信号分子[D].武汉:武汉大学, 2014.
LIU J. Real-time monitroing of plant signaling mole‐cules by microelectrode electrochemistry[D]. Wuhan:Wuhan University , 2014.
[25] ZHOU G, LIU Y, LUO M, et al. Peptide-capped goldnanoparticle for colorimetric immunoassay of conjugat‐ed abscisic acid[J]. ACS Applied Materials &Interfac‐es, 2012, 4(9):5010-5015.
[26] LI Q, WANG R, HUANG Z, et al. A novel impedanceimmunosensor based on O-phenylenediamine modified gold electrode to analyze abscisic acid[J]. Chinese Chemical Letters, 2010(4):473-476.
[27] KUSAJIMA M, YASUDA M, KAWASHIMA A, et al.Suppressive effect of abscisic acid on systemic ac‐quired resistance in tobacco plants[J]. Journal of Gener‐al Plant Pathology, 2010, 76(2):161-167.
Construction and Application of A Novel Abscisic Acid Electrochemical Immunosensor Based on CarboxylatedGraphene-Sodium Alginate Nanocomposite
DONG Hongtu1 , ZHOU Simeng1,2 , WANG Qingtao2 , WANG Cheng1 , LUO Bin1 , LI Aixue1*
(1. Research Center of Information Technology, Beijing Academy of Agriculture and Foreatry Sciences, Beijing100097, China;2. College of Landscape and Ecological Engineering, Hebei University of Engineering, Handan056038, China )
Abstract: Abscisic acid (ABA) is an important plant hormone, which can control seed and bud dormancy, organ size control, se‐nescence and death, and participate in both biological and abiotic stress, inhibit plant growth, and participate in plant disease re‐sistance. In order to determine the content of ABA in plants quickly and accurately, a new type of ABA immunosensor was de‐veloped. To improve the detection performance of the sensor, the detection performance of the sensor was increased by modify‐ing GR-COOH and SA on the electrode surface. The concentration of GR-COOH , SA, and ABA-Antibody were optimized, the optimal conditions for the three materials were 1.5 mg/ml, 1.25 mg/ml and 0.5 mg/ml. The immunosensor was constructed based on the electrode impedance changes (△Z )due to the binding reaction of ABA antibody and antigen . It was found that the sensor showed linear relationship with ABA in the response range of 10 pmol/L~1μmol/L, R2 was 0.99927, and the detec‐tion limit was about 10 pmol/L. The sensor also had good selectivity and stability. Using the electrochemical immunosensor, the content of ABA in navel orange leaf that have been successfully inoculated with citrus Huanglongbing by PCR was determined, and healthy plants were used as control. The test results showed that the impedance changes(△ Z ) of healthy leaves and dis‐ eased leaves were 72 and 823, respectively, which indicated that the level of ABA in the infected plants increased significantly. The sensor provides a tool for the detection of plant hormone levels under disease stress. The results showed that the content of ABA increased in the leaves of navel orange infected by citrus Huanglongbing, which indicated that ABA played an important role in plant disease resistance. Furthermore, the changes of gene expression of key enzymes CitZEP in ABA synthesis pathway were studied, The results showed that the expression of CitZEP increased in plants infected with Huanglongbing disease, and the results were consistent with the detection results of the sensor, which indicated that the sensor had good practicability. Key words: abscisic acid; immunesensor; electrochemical; Huanglongbing; GR-COOH; antibody
