双歧杆菌三联活菌胶囊对非酒精性脂肪性肝病患者肠道菌群及血脂影响的临床研究
2022-05-30亓传旺
亓传旺

【摘要】目的:探討双歧杆菌三联活菌胶囊对非酒精性脂肪性肝病(NAFLD)患者肠道菌群及血脂状况影响。方法:纳入2018年1月至2021年1月在本院收治的患有NAFLD的患者90例,随机分为实验组和空白对照组,每组45例;选择同期医院进行健康检查的45例做为健康对照组。实验组给予口服双歧杆菌三联活菌胶囊(连续8周)而空白对照组患者则不使用实验干预疗法。比较三组患者在治疗前的消肠道菌群水平以及治疗前后实验组和空白对照组肠道菌群、甘油三酯(TG)、总胆固醇(TC)的变化,以及炎性因子和生物化学指标优化程度。结果:治疗前,实验组和空白对照组患者之间的肠道菌群组成和血脂指标情况并没有显著差别(P>0.05);在肠道菌组成方面,实验组、空白对照组G-杆菌、G+球菌、G-球菌在全部肠道菌中的占比均超过标准健康空白组,但G+杆菌的比率却显著小于健康对照组,组间差异具有统计学意义(P<0.05)。治疗后,实验组G-杆菌、G+球菌、G-球菌在所有肠道菌群中占比相较于实验前下降,而G+杆菌在肠道菌群中的占比相较于实验前升高;对照组G-杆菌、G+球菌、G-球菌在所有肠道菌群中占比相较于实验前上升,而G+杆菌在肠道菌群中的占比相较于实验前下降,组间差异具有统计学意义(P<0.05);在血脂对比方面,实验组在给予治疗后,TC、TG的水平均有所下降,而空白对照组无明显差异;.在治疗前,实验组患者与空白对照组患者之间炎性因子和生物化学指标情况无明显差异,实验组在给予治疗后,肿瘤坏死因子-α和白细胞介素-6、胰岛素抵抗指数、内毒素的水平均有所下降,而对照组无明显变化,组间差异具有统计学意义(P<0.05)。结论:对NAFLD患者肠道菌群进行研究是非常有必要的。NAFLD患者肠道菌群与健康人体存在较大的差异,而双歧杆菌三联活菌胶囊能够有效改善患者肠道的菌群比例,进而控制患者的疾病,值得临床推广应用。
【关键词】双歧杆菌三联活菌;非酒精性脂肪性肝病;肠道菌群;血脂
【中图分类号】R540.4+1.【文献标识码】A.【文章编号】2096-5249(2022)21-0042-05
Clinical study on the effect of bifidobacterium triplex viable capsule on intestinal microflora and blood lipid of patients with non-alcoholic fatty liver disease
Qi Chuan-wang
Department of Hepatopathy,Taizhou Peoples hospital,Taizhou 225300,China
【Abstract】Objective:To investigate the effects of bifidobacteria triple viable capsule on intestinal microflora and lipid status in patients with non-alcoholic fatty liver disease (NAFLD). Methods:A total of 90 patients with NAFLD admitted to our hospital from January 2018 to January 2021 were selected as the main subjects,and through the random distribution method,the 90 cases of patients with nonalcoholic fatty liver disease is divided into the experimental group and the control group,each group contained 45 patients,at the same time,choose the same hospital The 45 patients who underwent health examination were the most healthy blank group. The experimental group was given oral bifidobacteria triple viable capsule for 8 weeks and experimental intervention therapy during the treatment period,while 45 patients in the control group were not given experimental intervention therapy. Within 8 weeks,the clinical treatment effect was analyzed. The levels of gastrointestinal microflora,triglyceride(TG)and total cholesterol(TC)of patients in the three groups before treatment were compared,and the changes were analyzed,Also includes inflammatory factors and the optimization degree of biochemical indicators. Results:Before the treatment,the standard of the intestinal bacteria from the patients and the control group patients and high in fat and no significant difference,standard experimental group and control group compared with control group,in terms of intestinal bacteria of G -bacillus,G + cocci,G - bacteria in all the proportion of the intestinal bacteria than standard health blank group,but the G + bacillus Was significantly lower than that of standard healthy blank group(P<0.05). When given after treatment in control group G -bacillus,G + cocci,G - bacteria in all groups of intestinal bacteria proportion compared with the experiment of the former is reduced,and the G + bacillus in proportion in all the intestinal fungus group compared with the experiment before rising,in the control group,G -bacillus,G + cocci,G - bacteria than in all the intestinal bacteria in the group increased compared with before the trial,and G + bacillus in all the intestinal tract Compared with before the experiment,the proportion of bacteria in the group decreased,and the difference between groups was statistically significant (P<0.05). In terms of blood lipid comparison,the levels of TC and TG in the experimental group decreased after treatment,while there was no significant difference in the control group;Before the treatment,there was no significant difference in inflammatory factors and biochemical indicators between the experimental group and the blank control group,while the levels of Tumor necrosis factor-α,interleukin-6 and insulin resistance index and endotoxin decreased,while the experimental group was statistically significant(P<0.05). Conclusion:It is necessary to study the intestinal flora of patients with NAFLD. The intestinal flora of patients with NAFLD is significantly different from that of healthy people,while bifidobacteria triple viable capsule can effectively improve the proportion of intestinal flora in patients,so as to control the disease of patients,which is worthy of clinical promotion and application.
【Key words】Bifidobacterium triplex live bacteria;Non-alcoholic fatty liver disease;Intestinal microflora;Lipid
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性肝脂肪变、非酒精性脂肪性肝炎 、肝硬化和肝细胞癌。近年来随着国人饮食及生活方式的改变,NAFLD已取代病毒性肝炎成为我国最常见的慢性肝病,预计到2030年我国NAFLD病患数将达3.14亿例[1-2]。目前尚缺乏十分有效治疗方法。因此,寻找改善NAFLD的有效治疗方法是当务之急。随着人们对肠道菌群研究的不断深入,发现肠道菌群与宿主代谢及 NAFLD 之间有着非常密切的关系[3-4]。本研究通过选择2018年1月至2021年1月在本院收治的患有NAFLD的90例患者为本次试验的主要研究对象,通过双歧杆菌三联活菌胶囊对NAFLD的疗效进行观察分析,以探讨其在防治NAFLD中的应用。
1 对象与方法
1.1 研究对象
纳入2018年1月至2021年1月本院收治的90例NAFLD患者,随机分为实验组和空白对照组,每组45例;同时选择同期在本院进行健康检查的45例患者做为健康对照组。
纳入标准:以《非酒精性脂肪性肝病诊疗指南》作为确诊诊断的参考标准。调查和研究均获得患者同意。
排除标准:具有其他特殊病因的肝病病史、糖尿病史,排除妊娠及精神病史。
1.2 方法
对实验组的45例患者在治疗期间给予双歧杆菌三联活菌胶囊(上海信宜,规格210 mg /粒,国药准字 S10950032)进行干预治疗,口服2次/d,2粒/次,连续给药8周。
空白对照组45例患者实施复方甘草酸苷片[卫材(中国)药业有限公司,国药准字J20130077]2~3片/次,1日3次,在治疗8周后,统计临床治疗效果。确保研究对象在研究期间没有使用任何含有益生菌成分的食物、抗生素、调节血脂的药物等。
1.3 指标判定
(1)所有NAFLD患者都在治疗前后留取粪便标本,健康对照组患者在进行检查过程中,留取标本,采用对粪便标本进行涂片、分类计数的方式,比较肠道菌群中的有益菌的变化,所检测主要的肠道菌群为G+杆菌、G-杆菌、G+球菌、G-球菌。
(2)血脂评价指标:所有的NAFLD患者在治疗前后,空腹情况下进行静脉血的采取,采用全自动生化分析仪对甘油三酯(TG)、总胆固醇(TC)进行检测,分析TG、TC在患者血清中的变化情况。
(3)炎性因子和生物化学指标,所有的NAFLD患者在治疗前后,应用ELISA法检测血清中的肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平,稳态模型评估的胰岛素抵抗指数(HOMA-IR),鲎试验检测血浆内毒素,TNF-α和IL-6、HOMA-IR、内毒素水平越低药物干预效果越好。
1.4 统计学方法
应用SPSS 26.0统计学软件处理数据。计量资料采用(x—±s) 表示,行t检验;计数资料用[n(%)],行χ2檢验。以P<0.05为差异有统计学意义。
2 结果
2.1 所有研究对象的一般资料对比
三组患者年龄、性别比较,差异不具备统计学意义(P>0.05),见表1。

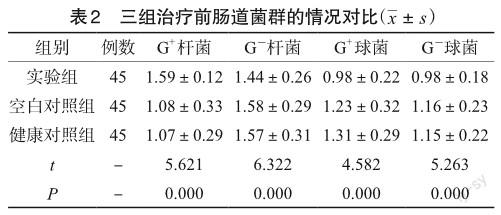
2.2 三组治疗前肠道菌群的情况对比
在治疗前,实验组患者与空白对照组患者之间肠道菌群无明显差异(P>0.05);实验组、空白对照组G-杆菌、G+球菌、G-球菌在所有肠道菌群中占比均高于健康对照组,而G+杆菌的比例明显低于健康对照组,组间差异具有统计学意义(P<0.05),见表2。

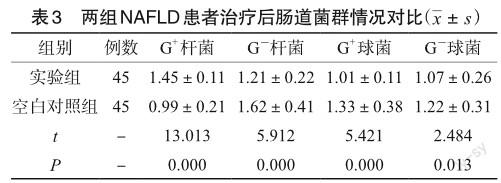
2.3 NAFLD患者治疗后肠道菌群情况对比
治疗后,实验组G-杆菌、G+球菌、G-球菌占比较空白对照组低,而G+杆菌占比相较空白对照组高,差异有统计学意义(P<0.05),见表3。

2.4 NAFLD患者治疗前后血脂情况对比
治疗前,实验组患者与空白对照组患者之间血脂指标情况无明显差异(P>0.05);治疗后,实验组TC、TG较对照组低,差异具有统计学意义(P<0.05),见表4。

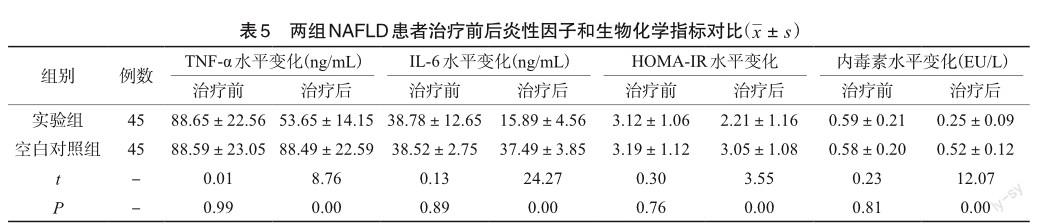
2.5 NAFLD患者治疗前后炎性因子和生物化学指标
治疗前,实验组与空白对照组患者之间炎性因子和生物化学指标情况无明显差异(P>0.05);治疗后,实验组TNF-α和IL-6、HOMA-IR、内毒素的水较对照组低,差异有统计学意义(P<0.05),见表5。
3 讨论
近年来,多项研究证实,胰岛素抵抗、氧化应激、脂质过氧化与NAFLD的发生和进展具有密切关系[5-7]。随着“肠-肝轴”概念的提出,肠道菌群在NAFLD发病中的作用越来越受到国内外学者的关注,其在NAFLD中的作用机制包括:(1)肠道中的特定菌群可以将胆碱转化为三甲胺,降低胆碱的肝脏生物利用度,减轻脂质积聚和肝脏炎症;(2)肠道菌群来源的代谢物脱氧胆酸、石胆酸及短链脂肪酸直接对肝脏造成损伤,引起肝细胞脂肪变性; (3)肠道来源的病原相关分子模式或微生物相关分子模式被肝脏固有免疫细胞识别,炎症的激活和持续会导致NAFLD; (4) 肠道菌群可以产生和代谢乙醇,可以根据乙醇的组成和功能设定增加或减少宿主对乙醇的暴露[8-10]。同时,研究表明肠道细菌产生的内源性乙醇可诱导NAFLD患者的线粒体功能障碍[11],进一步加重肝脂肪变性。目前针对NAFLD的治疗主要为生活方式干预(包括饮食控制、适当运动)和应用保肝类药物,但疗效不显著[12]。
本研究纳入90例NAFLD患者,分组探讨双歧杆菌三联活菌胶囊在NAFLD中的治疗作用。结果表明,在治疗前,实验组、空白对照组相较于健康对照组,G-杆菌、G+球菌、G-球菌在所有肠道菌群中占比均高于健康对照组,而G+杆菌的比例明显低于健康对照组,组间差异具有统计学意义(P<0.05);结论与国内已进行的研究结论[13-14]相符合,表明了肠道菌群失调是NAFLD产生发展的重要因素之一。
本研究结果发现,治疗前,实验组患者与空白对照组患者之间血脂指标情况、炎性因子和生物化学指标情况无明显差异(P>0.05);治疗后,实验组TC、TG、TNF-α和IL-6、HOMA-IR、内毒素水较对照组低,差异有统计学意义(P<0.05)。 治疗前,实验组与空白对照组患者之间炎性因子和生物化学指标情况无明显差异;治疗后,TNF-α和IL-6、HOMA-IR、内毒素的水平均有所下降,而对照组无明显变化,组间差异具有统计学意义(P<0.05)。分析原因可能在于双歧杆菌三联活菌为人体提供双歧杆菌、糞肠球菌、嗜酸乳杆菌,可调节肠道菌群失调,并清除肠道的致病菌,减少其产生肠源性毒素,进而减少白细胞介素-1、IL-6、血栓素、TNF-α等炎性介质产生,抑制肝细胞凋亡和坏死[15-18]。同时其可恢复肠屏障功能,减少炎性因子从门脉血流进入肝脏,进而发生炎性反应损伤肝功能。此外,从血脂水平来看,实验组的TC低于对照组,与国内已进行的研究结论[19]相符合,表明研究组可以更好地改善NAFLD患者的血脂代谢,分析可能的原因在于研究组的治疗可以补充患者肠道正常菌群,抑制肠道中的相应的革兰阴性菌的繁殖,从而调节肠道菌群的平衡,促进机体对营养物质的消化和吸收,促进脂质的营养代谢,对于患者肝功能改善情况也比较显著,双歧杆菌三联活菌胶囊可以改善NAFLD患者疾病治疗中,根据肠道中的不同菌群选择应该不同微生物制剂[20]。
综上所述,双歧杆菌三联活菌胶囊可以改善NAFLD患者的肠道菌群失调状况,调节患者的血脂代谢,有效性和安全性均较好,值得在临床上进一步推广和应用。
参考文献
[1] Nan Y,AN J,Bao J,et al.The Chinese Society of Hepatology position statement on the redefinition of fatty liver disease[J].J Hepatol,2021,75(2):451-461.
[2] 中国研究型医院学会肝病专业委员会,中国医师协会脂肪性肝病专家委员会,中华医学会肝病学会脂肪肝与酒精性肝病学组,等. 中国脂肪性肝病诊疗规范的专家建议(2019年修订版)[J].中华肝脏病杂志,2019(10):748-753.
[3] 何泽慧,温红珠,龚雨萍,等.益生菌/益生元治疗非酒精性脂肪性肝病的研究进展[J].中国中西医结合消化杂志,2020,28(1):76-81.
[4] 王蓉,谢伶俐,宋明宇.肠道微生物对慢性肝病影响的研究进展[J].中国中西医结合消化杂志,2019,27(11):879-882.
[5] 姜煜资,聂红明,汪蓉.非酒精性脂肪性肝病的发病机制[J].临床肝胆病杂志,2019,40(11):2588-2591.
[6] Smirne C,Croce E,Di BD,et al. Oxidative Stress in NonAlcoholic Fatty Liver Disease[J]. Livers,2022,2(1):30-76.
[7] 陈怡文,王磊,唐斯伟,等.益生菌辅助治疗对非酒精性脂肪性肝病患者脂质过氧化损伤的保护作用[J].广东医学,2021,42(11):1360-1363.
[8] Ji Y,Yin Y,Li Z,et al. Gut Microbiota-Derived Components and Metabolites in the Progression of Non-Alcoholic Fatty Liver Disease (NAFLD)[J]. Nutrients,2019,11(8):1712.
[9] Safari Z,Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD)[J]. Cell Mol Life Sci,2019(76):1541-1558.
[10] Hrncir T,Hrncirova L,Kverka M,et al. Gut Microbiota and NAFLD:Pathogenetic Mechanisms,Microbiota Signatures,and Therapeutic Interventions[J]. Microorganisms,2021,9(5):957.
[11] Chen X,Zhang Z,Li H,et al. Endogenous ethanol produced by intestinal bacteria induces mitochondrial dysfunction in non-alcoholic fatty liver disease[J]. J Gastroenterol Hepatol,2020(35):2009-2019.
[12] 卞翠翠,宋春宵,吴明明,等.生活方式干预改善非酒精性脂肪性肝病一例[J].医学食疗与健康,2021,19(1):190-191.
[13] 梁燦灿,庞澜,柯月,等.非酒精性脂肪性肝病病人肠道微生态系统变化及其对机体炎症反应的影响机制[J].肠外与肠内营养,2020,27(6):335-339.
[14] 王婷婷.双歧杆菌四联活菌辅助治疗对高尿酸血症的临床效果分析[J].医学食疗与健康,2021,19(3):95-96,98.
[15] 万晓强,郑紫丹,张霹雲,等 . 双歧杆菌三联活菌胶囊联合多烯磷脂酰胆碱对 NAFLD 患者肝功能、脂糖代谢及炎症因子的影响[J].现代生物医学进展,2020,20(14):2719-2722,2780.
[16] 林海燕,沈林,孔德钱.双歧杆菌四联活菌片联合生活方式干预治疗非酒精性脂肪性肝病的临床研究[J].中国医药科学,2021,11(7):203-206.
[17] 江泳,关玉龙,韩小玲,等.双歧杆菌三联活菌散联合水飞蓟宾胶囊治疗非酒精性脂肪性肝病患者的临床研究[J].中国临床药理学杂志,2020,36(15):2212-2215.
[18] 丁晓亭.双歧杆菌三联活菌散辅助治疗足月新生儿黄疸的临床研究[J].医学食疗与健康,2019,17(11):53-54.
[19] 王少鑫,崔立红,罗哲,等.双歧杆菌三联活菌联合多烯磷脂酰胆碱在非酒精性脂肪性肝病中的疗效观察[J].胃肠病学和肝病学杂志,2019,28(9):990-994.
[20] 赵紫楠,金鹏飞,李可欣,等.双歧杆菌乳杆菌三联活菌临床应用循证评价[J].中国药业,2021,30(17):107-114.
