玉米赤霉烯酮对鸡胚成纤维细胞的毒性作用
2022-05-30张凯照许泽锴王诗倩崔红杰黄小红
张凯照,胡 会,许泽锴,王诗倩,崔红杰,黄小红*
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建农林大学,中西兽医结合与动物保健福建省高校重点实验室,福州 350002;3.福建农林大学,福建省兽医中药与动物保健重点实验室,福州 350002)
霉菌毒素是丝状真菌的有毒次生代谢物,常见于农作物、谷物和食品污染,其中,玉米赤霉烯酮(zearalenone,ZEA)的污染问题尤为严重[1]。Lee等[2]综合2006—2016年霉菌毒素调查报道发现,世界范围内谷物原料中ZEA的污染率及平均污染水平为46%和3 049 μg·kg-1,其中,非洲、亚洲和北美污染最严重。我国学者在2018年检测了从19个省市收集的422份饲料样品,发现饲料中ZEA的检出率高达95%,超标率为7.9%,远高于国家饲料卫生标准(GB13078—2017)的限量要求[3]。ZEA又称F-2毒素,在动物体内可以被转化为还原性代谢产物,如α-玉米赤霉烯醇、β-玉米赤霉烯醇、α-玉米赤霉醇、β-玉米赤霉醇等[4]。ZEA及其代谢物具有类雌激素作用,并能扰乱动物的内分泌功能[5]。摄入霉菌毒素可以引起动物的生产性能下降,引发急性或慢性的中毒反应,进而威胁动物和人类健康,并给畜禽养殖业造成巨大的损失[6]。
ZEA除了具有雌激素活性外,还通过多种损伤机制发挥毒性作用,包括氧化应激、内质网应激、线粒体损伤、细胞周期阻滞、炎症反应、细胞凋亡和坏死等。ZEA能降低草鱼幼鱼的生长性能,损害草鱼肠道结构完整性,使草鱼肠道细胞发生凋亡和坏死,产生肠道毒性[7]。采用腹腔注射的方式给小鼠注射 50 mg·kg-1剂量的 ZEA,可观察到肝坏死、肝细胞变性和肾上皮细胞肿胀变性;组织细胞的氧化损伤是目前普遍接受的ZEA引起肝肾损伤机制之一[8]。体内外研究表明,ZEA对免疫应答也有显著影响,有免疫刺激或免疫抑制作用[9]。李欣虹等[10]研究发现,ZEA能诱导鸡脾淋巴细胞发生细胞凋亡和细胞坏死,抑制细胞增殖。此外,ZEA对多种类型细胞具有时间和剂量依赖性的负效应,如ZEA及其衍生物会对大鼠支持细胞和小鼠卵巢颗粒细胞产生毒性作用[11-12];40 μmol·L-1ZEA能抑制猪小肠上皮细胞增殖,并在24 h内降低所有浓度(ZEA浓度<100 μmol·L-1)的细胞活力[13];Wang等[14]研究发现,不同剂量的ZEA能通过线粒体途径诱导大鼠原代睾丸间质细胞凋亡。
虽然目前ZEA对禽类的毒性作用已有报道,但关于ZEA对禽类的毒性作用机制研究仍不完善。利用内分泌细胞和生殖细胞来评估ZEA的毒理学效应,但成纤维细胞的潜在影响一直被忽视,成纤维细胞在组织发育、维持和修复方面具有重要作用[15]。鸡胚成纤维细胞(DF-1)是一种稳定的、无肿瘤基因、自发无限增殖的细胞系,被广泛用于动物病毒研究、疫苗研制、癌症研究等诸多领域。因此,本试验选用DF-1作为供试细胞,探究ZEA对DF-1细胞的毒性作用,旨在进一步探讨ZEA的毒性作用机制与禽类疾病的确切关系,为正确指导农业生产、畜牧养殖和防控霉菌毒素中毒提供理论基础。
1 材料与方法
1.1 主要试剂
胎牛血清、DMEM细胞培养基、PBS和青霉素-链霉素溶液等均购自美国Hyclone公司;二甲基亚砜(DMSO)和玉米赤霉烯酮(ZEA)均购自美国Sigma公司;甲基噻唑蓝MTT购自北京索莱宝科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;LDH检测试剂盒购自南京建成生物工程研究所;Caspase-3、ROS、线粒体膜电位检测试剂盒均购自上海茁彩生物科技有限公司;TRIzol试剂购自美国Ambion有限公司;反转录试剂盒和荧光定量试剂盒均购自宝生物工程(大连)有限公司。鸡胚成纤维细胞DF-1(ATCC; CRL-12203)购自武汉普诺赛生命科技有限公司。
1.2 ZEA对DF-1细胞活力的影响
DF-1细胞按4.5×103个·孔-1接种至96孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入含不同浓度ZEA(ZEA终浓度分别为12.5、25.0和50.0 μg·mL-1)的培养基。以不加ZEA的细胞作为对照组,继续培养6、12、24、48 h后,采用MTT法检测细胞活力。每个浓度设6个复孔,试验重复3次,试验结果以平均值表示。根据以下公式计算细胞的存活率:细胞存活率=(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100。
1.3 ZEA对DF-1细胞形态的影响
DF-1细胞按7×104个·孔-1接种至6孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入含不同浓度ZEA(ZEA终浓度分别为12.5、25.0和50.0 μg·mL-1)的培养基。以不加ZEA的细胞作为对照组,继续培养24 h后,在倒置显微镜下观察拍照。
1.4 ZEA对DF-1细胞上清液中LDH的影响
DF-1细胞按7×104个·孔-1接种至6孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入ZEA终浓度为25.0 μg·mL-1的培养基。以不加ZEA的细胞作为对照组,各设置6个复孔,继续培养24 h后收集细胞上清液,按照LDH检测试剂盒说明书步骤操作检测上清液中LDH的活性。试验重复3次。
1.5 ZEA对DF-1细胞上清液中Caspase-3含量的影响
细胞接种和药物处理方法同“1.4”,继续培养24 h后收集细胞上清液,按照ELISA试剂盒说明书测定上清液中Caspase-3的含量。
1.6 Annexin V-FITC/PI双染法检测ZEA对DF-1细胞凋亡的影响
细胞接板和药物处理方法同“1.4”,继续培养24 h后,按照细胞凋亡检测试剂盒说明书步骤操作,准备好细胞样品,流式细胞仪检测。
1.7 ZEA对DF-1细胞中活性氧水平的影响
细胞接种和药物处理方法同“1.4”,加入含DCFH-DA荧光染料的培养液,37 ℃避光孵育20 min,PBS洗涤3次后用荧光倒置显微镜观察并拍照。
1.8 ZEA对DF-1细胞线粒体膜电位的影响
细胞接种和药物处理方法同“1.4”,继续培养24 h后,加入含JC-1荧光染料的培养液,37 ℃避光孵育20 min,用JC-1 Buffer(1×)洗涤2次,用荧光倒置显微镜观察并拍照。
1.9 ZEA处理对DF-1细胞凋亡相关基因转录水平的影响
细胞接种和药物处理方法同“1.4”,继续培养24 h后,3 000 r·min-14 ℃离心10 min收集细胞,使用TRIzol法提取总RNA,并反转录获得cDNA。以cDNA为模板,进行RT-qPCR反应。检测细胞凋亡(Bcl-2、Caspase-3、Bax)和内质网应激相关基因(ATF4、ATF6、GRP78、CHOP、IRE1、PERK)的mRNA转录水平。具体引物序列见表1,引物均由生工生物工程(上海)股份有限公司合成。以β-actin为内参基因,采用2-ΔΔCt法计算分析结果。
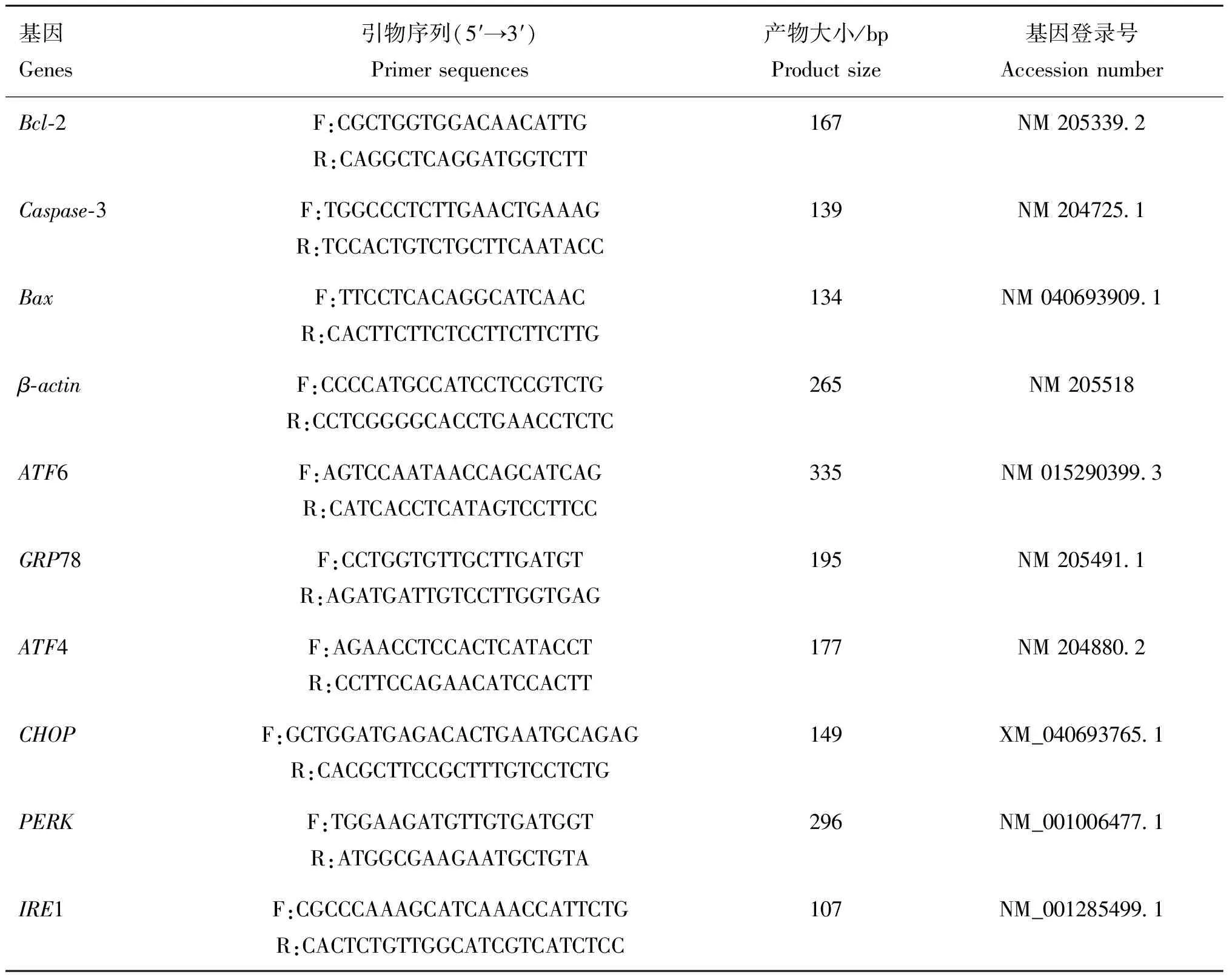
表1 荧光定量 PCR 引物序列信息
1.10 数据分析
2 结 果
2.1 ZEA对DF-1细胞形态和活力的影响
ZEA对DF-1细胞形态的影响结果见图1。与对照组相比,ZEA浓度越高,细胞形态越差、皱缩、欠规则、呈圆形或卵圆形、折光性差、贴壁细胞减少,死亡细胞增多。细胞活力检测结果见图2。与对照组相比,随着ZEA浓度增加、作用时间增长,ZEA对DF-1细胞活力的抑制作用增强,呈时间和剂量依赖性关系,25.0 μg·mL-1ZEA处理DF-1细胞24 h后细胞活力约为50%,因此试验选取25.0 μg·mL-1ZEA处理DF-1细胞24 h进行后续试验。
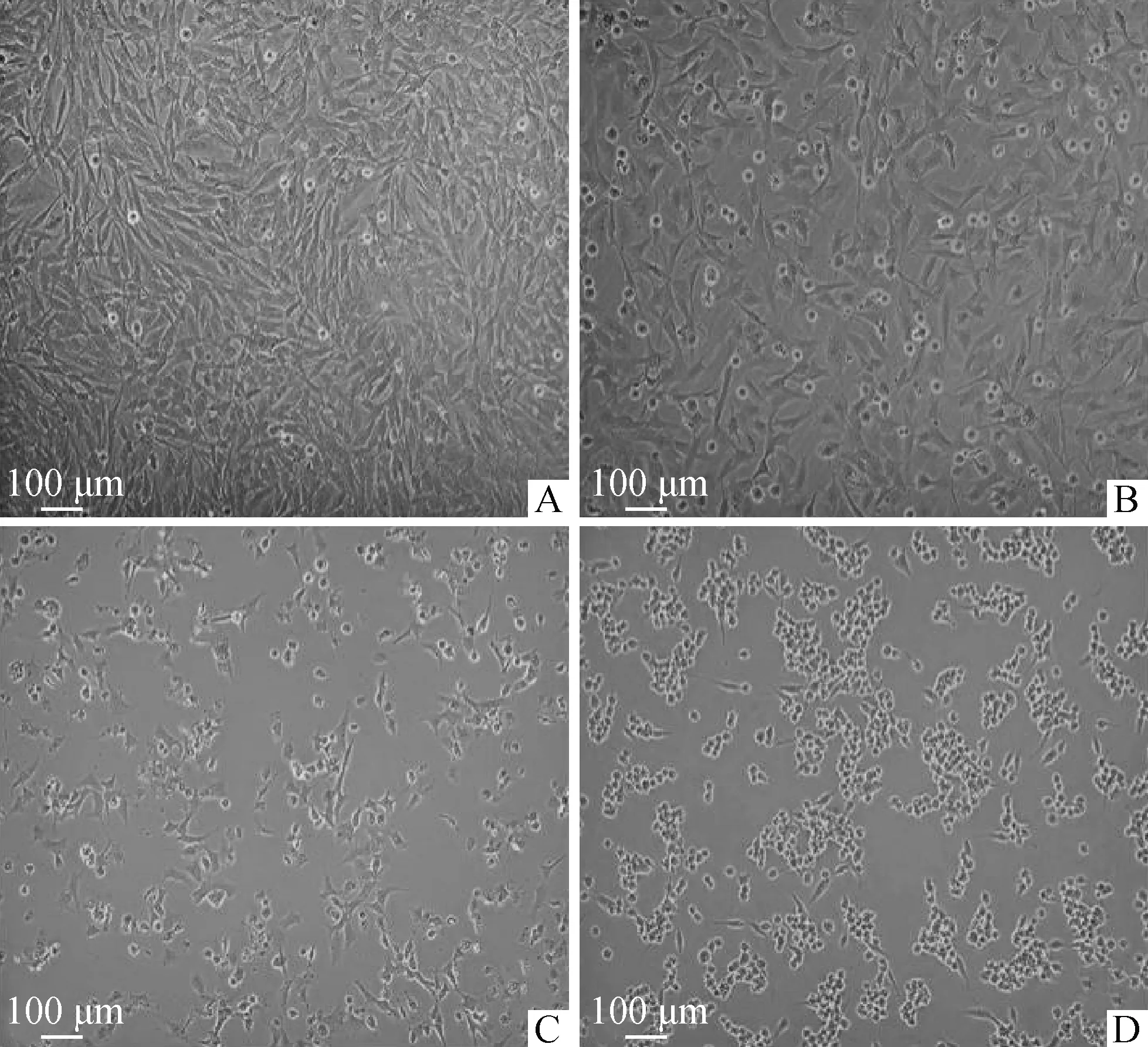
A.对照组;B.12.5 μg·mL-1 ZEA处理组;C.25.0 μg·mL-1 ZEA处理组;D.50.0 μg·mL-1 ZEA处理组。扫描文章首页OSID码可查看彩图
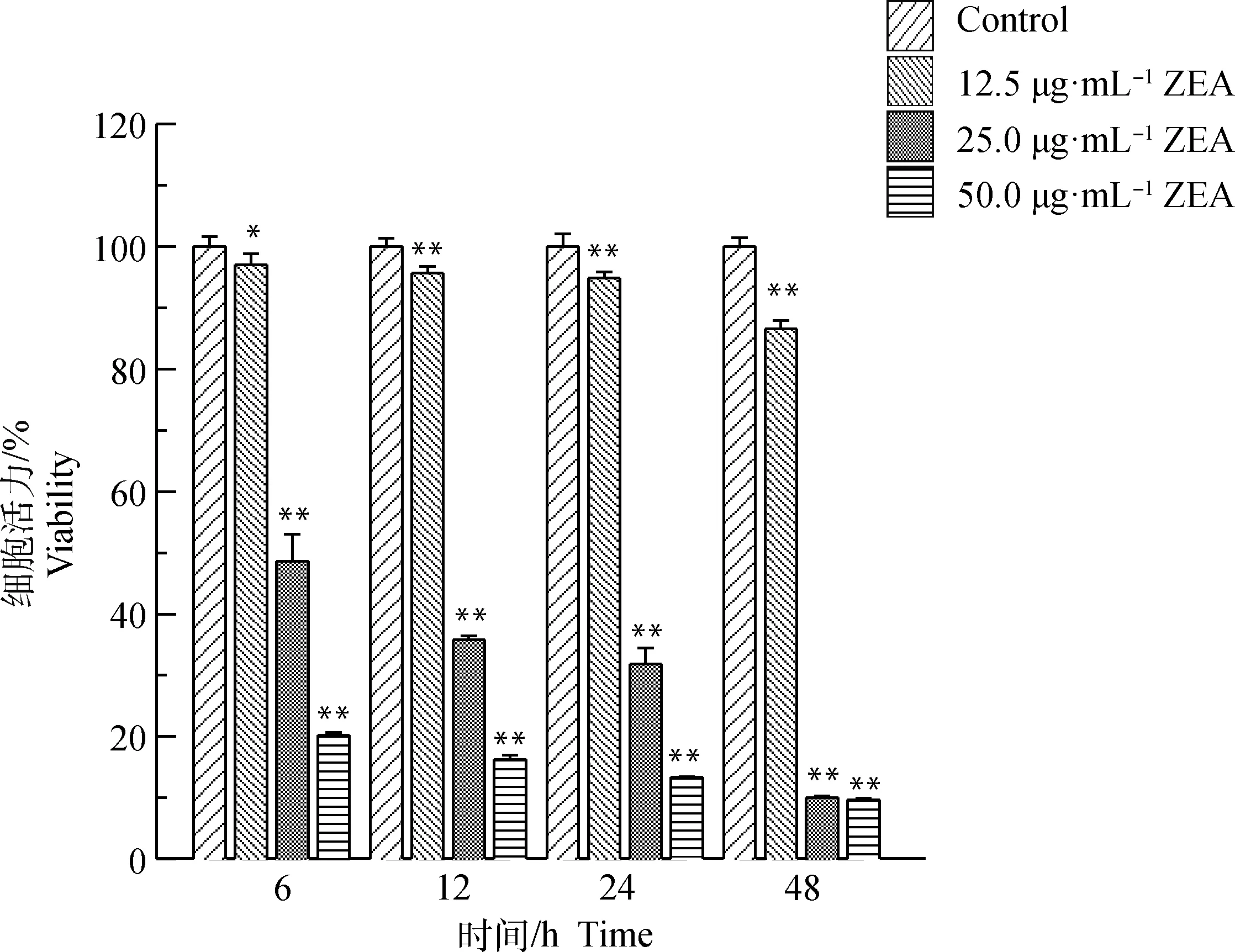
与对照组相比,*.P<0.05;**.P<0.01。下同
2.2 ZEA对DF-1细胞乳酸脱氢酶(LDH)的影响
由图3可知,与对照组相比,25.0 μg·mL-1ZEA处理组LDH活性极显著升高(P<0.01),约为正常细胞的6倍。表明25.0 μg·mL-1ZEA作用于DF-1细胞后会产生细胞毒性,从而导致细胞凋亡。
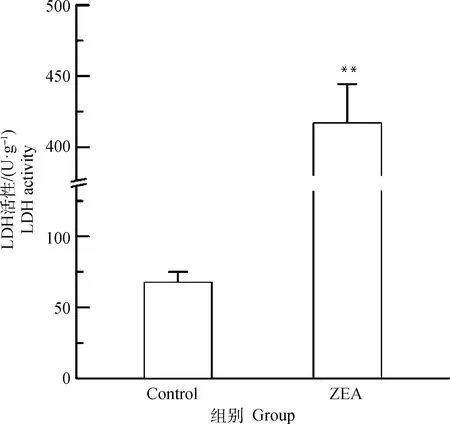
图3 ZEA对DF-1细胞上清液中LDH活性的影响
2.3 ZEA对DF-1细胞上清液中Caspase-3 含量的影响
由图4可知,与对照组相比,25.0 μg·mL-1ZEA处理DF-1细胞24 h后,细胞上清液中Caspase-3含量极显著升高(P<0.01),约为正常细胞的2倍。表明25.0 μg·mL-1ZEA作用于DF-1细胞后会发生细胞凋亡。
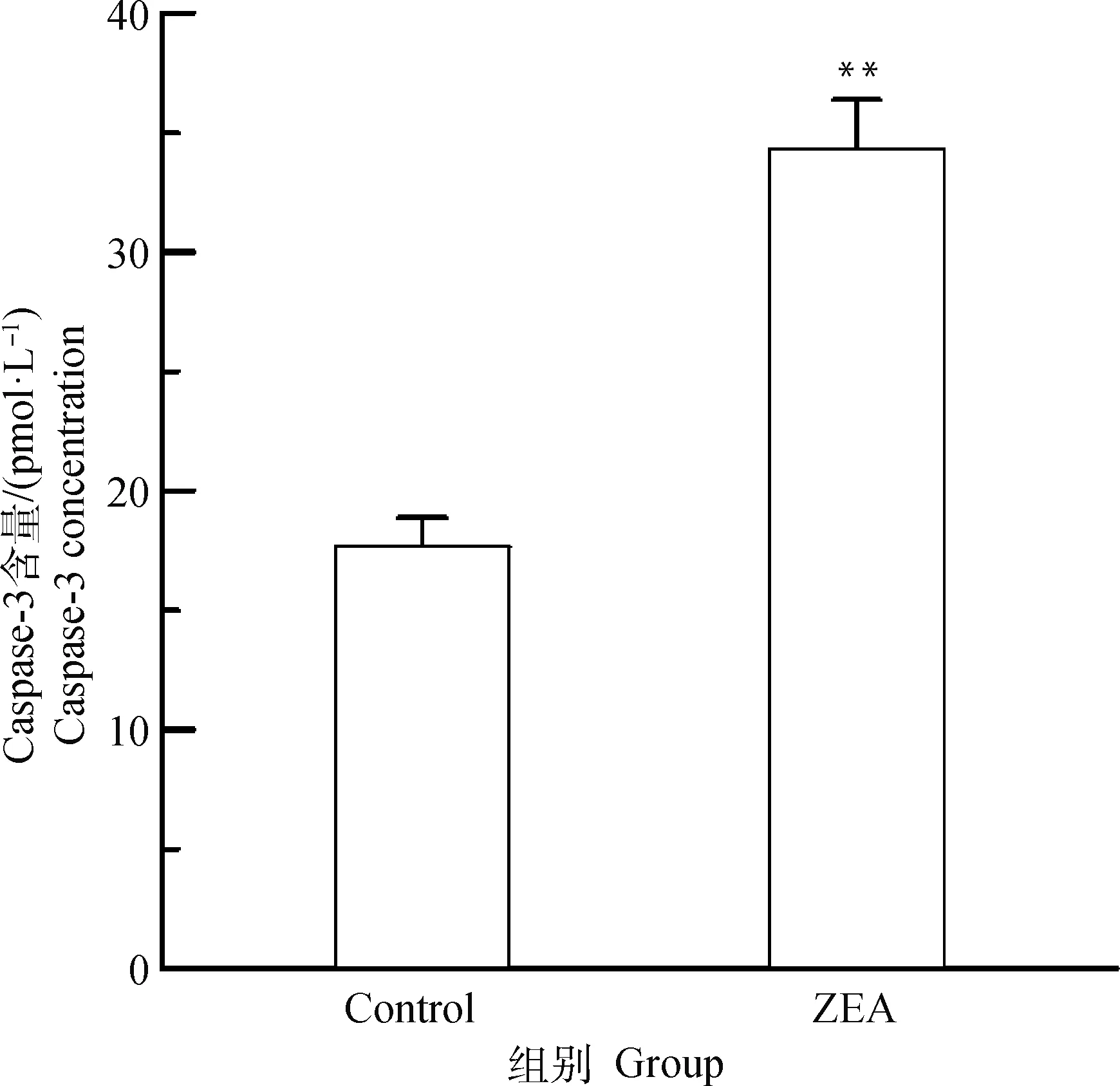
图4 ZEA 对DF-1细胞上清液中Caspase-3含量的影响
2.4 ZEA对DF-1细胞凋亡的影响
由图5可知,Q1表示坏死细胞,Q2表示晚期凋亡细胞,Q3表示早期凋亡细胞、Q4表示活细胞。与对照组相比,25.0 μg·mL-1ZEA处理组的早凋(Q3)和晚凋(Q2)细胞数显著增加,表明25.0 μg·mL-1ZEA作用于DF-1细胞后会发生细胞凋亡。
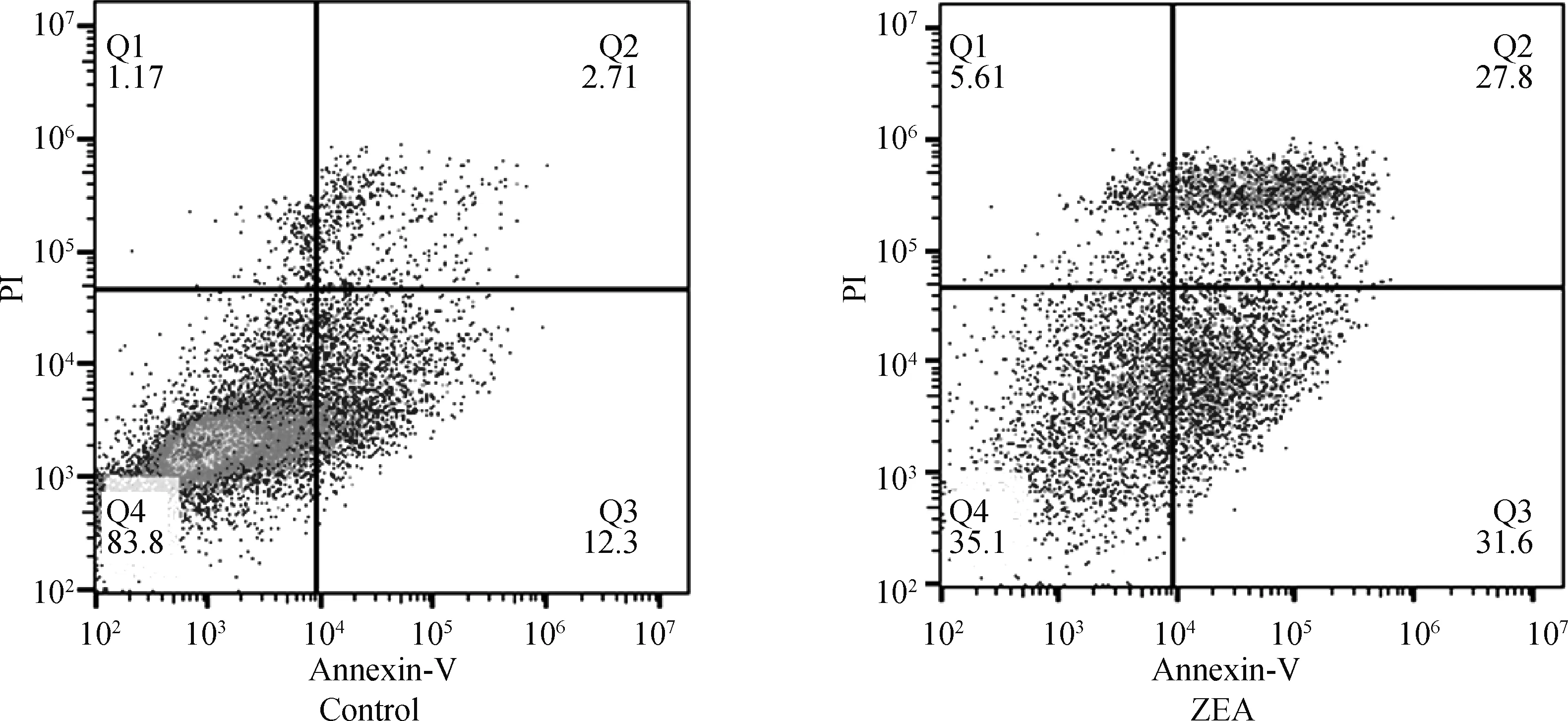
图5 ZEA对DF-1细胞凋亡的影响(扫描文章首页OSID码可查看彩图)
2.5 ZEA对DF-1细胞活性氧水平的影响
由图6A可知,与对照组相比,25.0 μg·mL-1ZEA处理组绿色荧光强度明显增强,细胞核呈浓缩、致密浓染。由图6B可知,与对照组相比较,25.0 μg·mL-1ZEA 处理后的DF-1细胞ROS水平极显著增加(P<0.01),约为正常细胞的20倍,对细胞产生毒害作用。
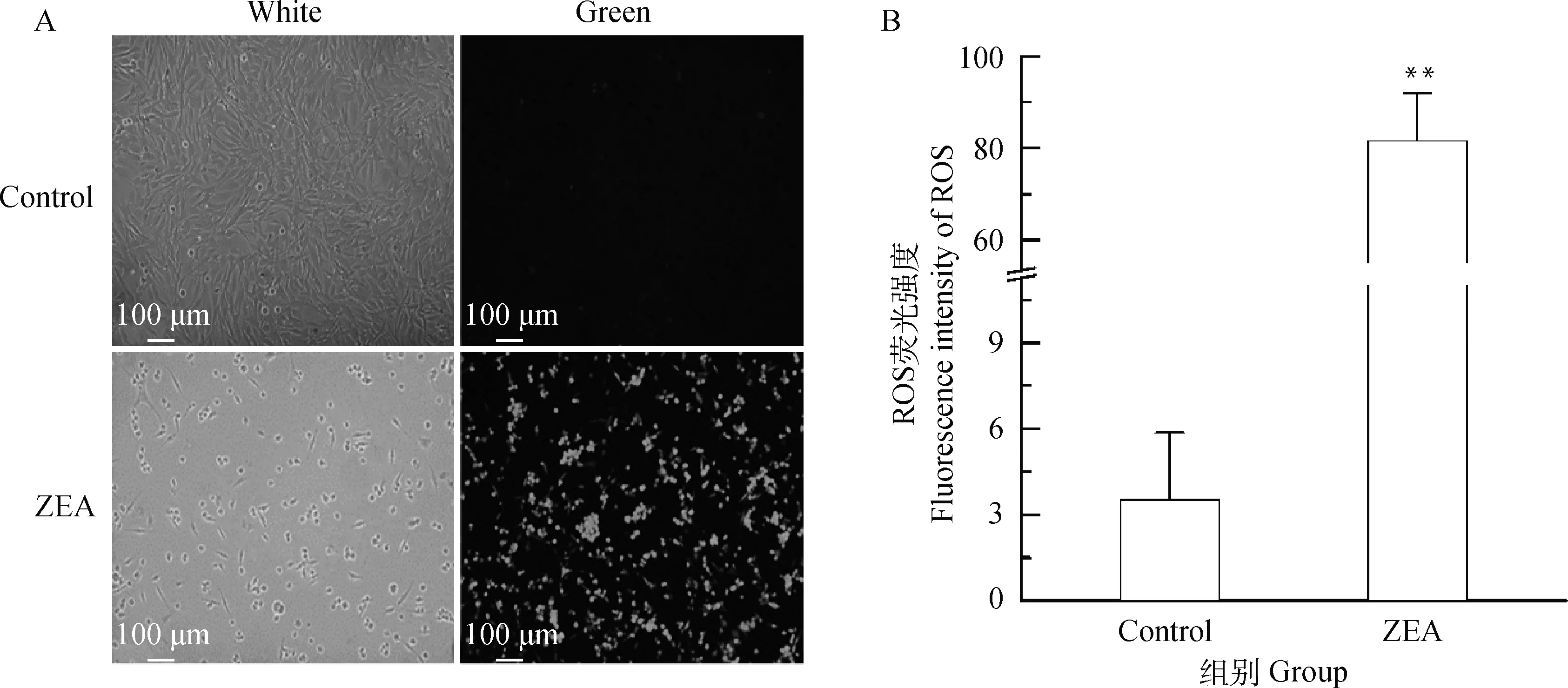
A.细胞内ROS水平变化的荧光染色结果(标尺=100 μm,扫描文章首页OSID码可查看彩图);B.ROS荧光强度分析
2.6 ZEA对DF-1细胞线粒体膜电位的影响
由图7可知,与对照组相比,25.0 μg·mL-1ZEA处理组红色荧光明显减弱,绿色荧光明显增强,由图8可知,与对照组相比较,25.0 μg·mL-1ZEA处理后的DF-1细胞线粒体膜电位极显著降低(P<0.01),约为正常细胞的1/7,说明ZEA能造成DF-1细胞线粒体损伤。

图7 线粒体膜电位荧光染色结果(标尺=100 μm,扫描文章首页OSID码可查看彩图)
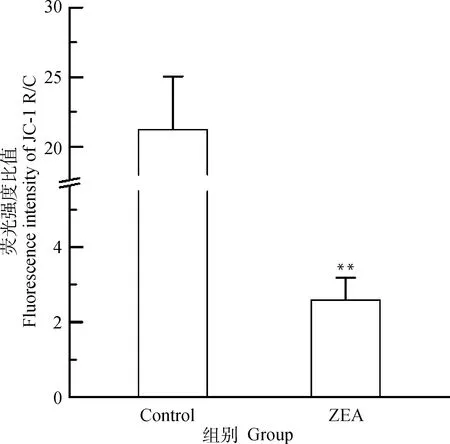
图8 线粒体膜电位红绿荧光强度比值分析
2.7 DF-1细胞凋亡相关基因的mRNA转录水平
通过RT-qPCR检测凋亡相关基因Caspase-3、Bax、Bcl-2的转录水平,由图9可知,与对照组相比,25.0 μg·mL-1ZEA组的促凋亡基因Caspase-3mRNA转录水平极显著上调(P<0.01)、BaxmRNA转录水平极显著上调(P<0.01);抑凋亡基因Bcl-2mRNA转录水平极显著下调(P<0.01)。从mRNA转录水平表明ZEA能诱导细胞凋亡。
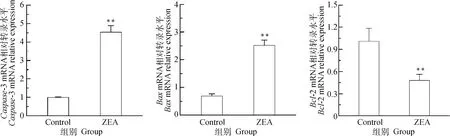
图9 ZEA对DF-1细胞凋亡相关基因mRNA转录水平的影响
2.8 DF-1细胞ERs相关基因的mRNA表达
通过RT-qPCR检测ERs相关基因CHOP、GRP78、PERK、ATF6、ATF4、IRE1的mRNA转录水平,由图10可知,与对照组相比,25.0 μg·mL-1ZEA组CHOP、GRP78、PERK、ATF6、ATF4、IRE1mRNA转录水平极显著上调(P<0.01)。从mRNA转录水平表明ZEA能诱导发生内质网应激。
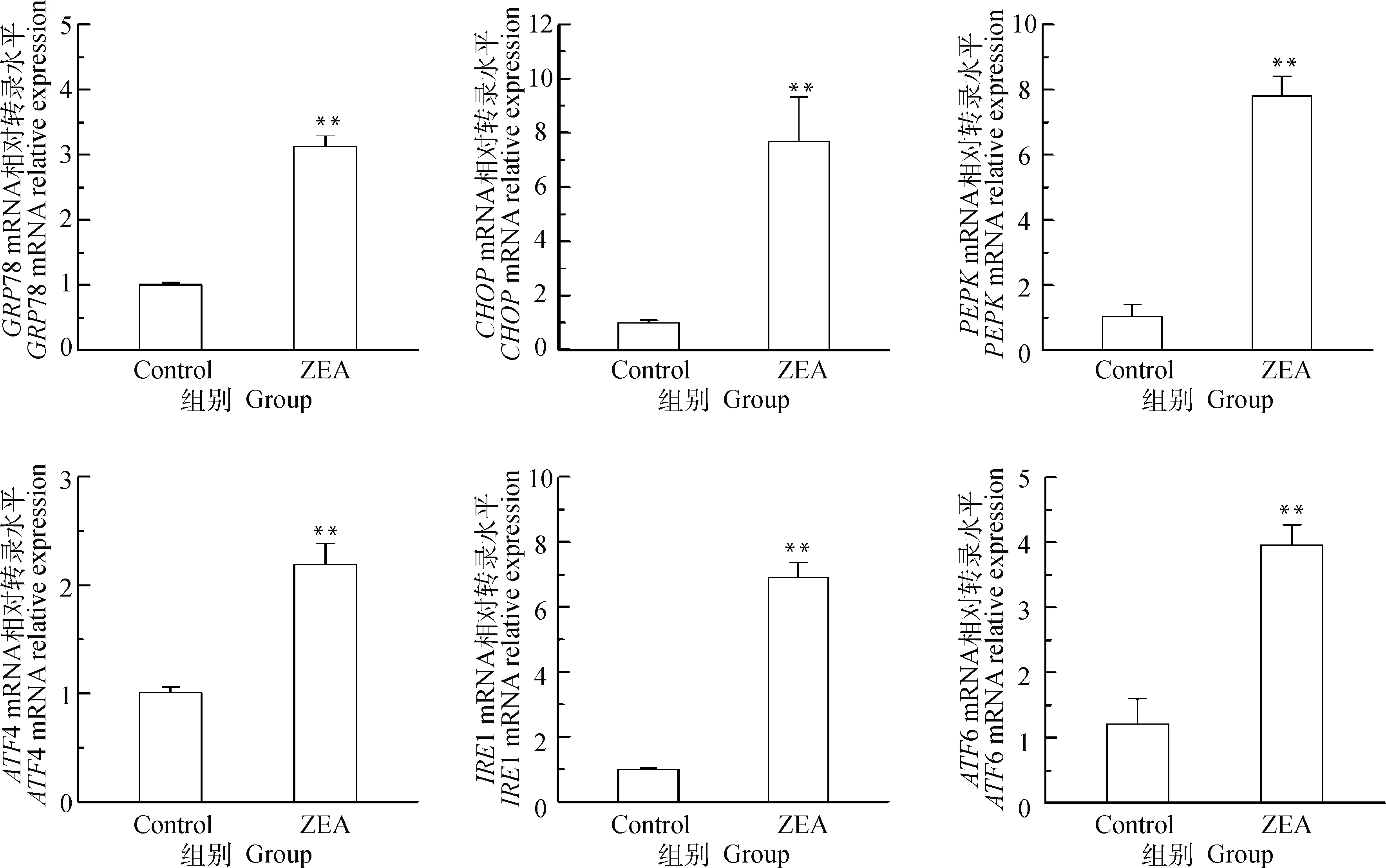
图10 ZEA对DF-1细胞ERs相关基因mRNA转录水平的影响
3 讨 论
人或畜禽通过饮食将ZEA摄入体内,会产生免疫毒性、生殖毒性、肠道毒性、肝肾毒性、细胞毒性、甚至致癌性,严重危害人类和畜禽健康,降低动物生产性能,带来不可估量的经济损失[16]。成纤维细胞代谢旺盛、增殖能力强,具有合成和分泌蛋白质的功能[17]。而DF-1是一种鸡的典型成纤维细胞模型,常用来研究鸡细胞的功能和变化,因此,本试验以DF-1为模型研究ZEA的毒性作用机制。
乳酸脱氢酶(LDH)是细胞内一种稳定的酶,LDH的释放是检测细胞毒性和细胞膜完整性的重要指标,当细胞凋亡时会破坏细胞膜结构从而导致细胞质内的LDH释放到培养液中[18]。本研究通过细胞活力及LDH的检测表明ZEA对 DF-1细胞产生毒性作用,并抑制DF-1细胞的活力。与此一致,陈新亮[19]研究发现,ZEA使MODE-K细胞膜发生脂质氧化,细胞破损,使细胞内的LDH活性显著升高。
活性氧(ROS)是氧化应激反应中的重要信号分子,ROS的过度积累可破坏细胞内稳态,导致线粒体功能障碍,直接或间接(或同时)影响内质网稳态和蛋白质折叠[20]。大量体外研究表明,ZEA通过ROS的产生诱导细胞毒性,导致脂质过氧化、DNA损伤和细胞凋亡[21]。线粒体是细胞的发电站,消耗氧气以产生足够的能量来维持正常的细胞过程,其电位变化可以反映出细胞的状态。此外,线粒体膜电位是检测细胞凋亡早期的重要标志,也是检测细胞凋亡早期阶段的方式之一[22]。张心怡等[23]研究发现,ZEA处理小鼠T淋巴细胞可以提高细胞内活性氧的水平,同时降低T淋巴细胞线粒体膜电位。本研究使用25.0 μg·mL-1ZEA处理 DF-1细胞24 h后,与对照组相比,ZEA组ROS显著升高,线粒体膜电位降低,引起线粒体损伤。与张心怡等[23]研究结果一致,这一结果也表明ZEA对多种类型细胞具有毒性作用。
内质网在蛋白质折叠、蛋白质运输和细胞内Ca2+调控中发挥重要作用,内质网生理功能的损伤,如未折叠蛋白的积累、腔内钙稳态的紊乱和氧化应激会引发内质网应激(ERs),进而触发未折叠蛋白反应(UPR)[24]。UPR是一种适应性反应,通过激活3个近端传感器IRE1、ATF6和PERK来恢复内质网稳态。但是,如果内质网应激严重或延长,UPR通过激活下游效应因子,包括CHOP、JNK、Caspases和Bcl-2家族成员,从而导致细胞凋亡[25]。王宗捷等[26]研究发现,ZEA可以通过ERs通路调控山羊 ESCs细胞的凋亡进程。在DF-1细胞中,作者发现ZEA处理细胞后,ERs相关基因CHOP、GRP78、PERK、ATF6、ATF4、IRE1 mRNA转录水平上调,表明该霉菌毒素诱导的内质网应激足以激活UPR的促凋亡通路。GRP78 是ERs的标志物之一,GRP78上调表明ERs增加[27],而ATF6是GRP78的最佳表达伴侣[28]。有报道称其他霉菌毒素也会引起不同细胞的ERs,比如木霉菌素、HT-2毒素等[29-30]。说明诱导ERs可能是霉菌毒素毒性的一个共同特征。
由于ROS的增加,线粒体膜电位的降低和ERs的发生,试验进一步检测 ZEA 处理后DF-1细胞是否发生细胞凋亡。细胞凋亡是ZEA造成细胞毒性的重要途径,是细胞程序性死亡的过程,主要分为两类转导途径,1)线粒体或内质网参与的内源性途径,2)死亡受体介导的外源性途径[31]。本研究通过流式细胞术分析表明,ZEA处理后DF-1细胞凋亡率显著升高。Bcl-2家族蛋白分为促凋亡和抑凋亡两种,在细胞线粒体凋亡途径中至关重要[32]。接收到凋亡信号后,Bcl-2在线粒体外膜通过抑制细胞色素C的释放来抑制细胞凋亡,而Bax进入线粒体使线粒体膜通透性增加、去极化,释放细胞色素C,激活线粒体通路,导致细胞凋亡[33]。抑凋亡基因Bcl-2和促凋亡基因Bax的比例能决定细胞是否凋亡[34]。Caspase-3蛋白家族在凋亡的启动中十分重要,其中,Caspase-3是主要的启动子,它活化会使DNA断裂、染色质凝聚、最终生成凋亡小体[35]。本研究用ZEA处理DF-1细胞后上清中Caspase-3含量显著增加,抑凋亡基因Bcl-2的mRNA转录水平下调,Bax和Caspase-3 mRNA转录水平上调,这表明ZEA会导致DF-1细胞发生细胞凋亡。
4 结 论
ZEA主要通过内质网应激诱导细胞凋亡和激活细胞凋亡途径对DF-1细胞发挥毒性作用。本研究为深入探讨ZEA的毒性作用机制、与人畜疾病的确切关系及相关疾病治疗奠定基础。
