舒芬太尼对肾缺血再灌注大鼠肾组织细胞自噬的影响*
2022-05-29杨雪梅杨康明
杨雪梅,杨康明,李 娜
(1.甘孜州人民医院麻醉科,甘孜 626000;2.甘孜州人民医院肝胆一科,甘孜 626000;3.海南省人民医院麻醉科,海口 572000)
急性肾损伤(Acute kidney injury,AKI)是一种常见的急性疾病,死亡率很高,并且容易导致慢性肾病的进展[1]。肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)是导致AKI 最重要的原因之一,常见于肾移植、肾部分切除术、休克、急性肾动脉阻塞和其他临床手术过程[2]。自噬在RIRI中发挥着重要的作用。因此,开发一种能够有效调控自噬的药物将有助于RIRI 的治疗。舒芬太尼(sufentanil,Sufen)是临床最常用的麻醉药物,具有镇痛作用强、起效快、苏醒时间短等优点。有研究报道,Sufen通过抑制过度自噬可减轻大鼠RIRI[3],但具体机制尚不清楚。因此,本研究通过构建RIRI 模型,探究Sufen对RIRI大鼠细胞自噬的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 60 只SPF 级雄性SD 大鼠,体质量(200±20)g,购于广州锐格生物科技有限公司,生产许可证号为SCXK(粤)2021-0059。动物实验均遵循3R原则,本研究得到甘孜州人民医院动物伦理委员会的批准(伦理编号:2022-0175)。
1.1.2 主要试剂 枸酸舒芬太尼注射液(宜昌人福药业有限责任公司);PI3K/AKT 通路抑制剂LY294002、肌酐(Cr)、血尿素氮(BUN)检测试剂盒(北京百奥莱博科技有限公司);丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒(北京索莱宝生物科技有限公司);兔源一抗微管相关蛋白1 轻链3(LC3)、p62、磷脂酰肌醇-3-激酶(PI3K)、p-PI3K、蛋白激酶B(AKT)、p-AKT、GAPDH 及辣根过氧化物酶(HRP)标记的羊抗兔二抗(广州复能生物科技有限公司)。
1.2 方法
1.2.1 动物的分组及处理 将60 只SPF 级雄性SD大鼠随机分为对照组、模型组、Sufen 组、LY294002组、Sufen+LY294002 组,每组12 只。除对照组外,其它组均参考文献[3]进行RIRI 模型构建。建模成功后,Sufen 组大鼠在再灌注前5 min尾静脉注射舒芬太尼1 μg/kg、腹腔注射0.3 mg/kg 生理盐水[4];LY294002 组大鼠在再灌注前5 min 尾静脉注射1 μg/kg 生理盐水,腹腔注射LY294002 0.3 mg/kg[5];Sufen+LY294002组大鼠在再灌注前5 min尾静脉注射舒芬太尼1 μg/kg、腹腔注射LY294002 0.3 mg/kg,对照组、模型组大鼠则尾静脉注射1μg/kg 生理盐水、腹腔注射0.3 mg/kg生理盐水,每天1次,连续给药7 d。
1.2.2 大鼠血清中Cr和BUN水平的检测 给药结束后,麻醉大鼠,经腹主动脉取血获得血清,按照说明书步骤检测大鼠血清中肌酐Cr和BUN水平。
1.2.3 苏木精—伊红(HE)染色检测大鼠肾脏组织病理学变化 每组3 只大鼠,处死大鼠取出肾脏固定在多聚甲醛中,切成5 μm厚切片,经乙醇脱水,石蜡包埋,HE 染色后,光学显微镜下观察肾脏组织病理学变化。参考文献[6]进行肾脏组织病理评分,随机选取6个不重叠的视野,根据肾小管坏死、管型形成和小管扩张的分级评分反映肾小管损伤严重程度:0 分(无损伤)、1 分(≤10%的损伤)、2 分(11%~25%的损伤)、3分(26%~45%的损伤)、4分(46%~75%的损伤)和5分(≥76%的损伤)。
1.2.4 大鼠肾脏组织氧化应激水平的检测 每组3只大鼠,严格按照MDA含量、SOD活性检测试剂盒说明书操作步骤检测大鼠肾脏组织中MDA 含量、SOD活性。
1.2.5 透射电子显微镜观察自噬小体的形成 取剩余6只大鼠肾组织,一部分将肾脏组织切成1 mm3的小块,固定过夜后将组织样本在室温下用1%锇酸固定1 h,在一系列乙醇水溶液中脱水,最后在100%乙醇中脱水,然后包埋在环氧树脂中。使用超薄切片机切割的超薄切片用3%柠檬酸铅染色,最后使用电子显微镜观察自噬小体形成情况。
1.2.6 Western blotting检测蛋白表达 取“1.2.5项”中剩余肾组织,通过RIPA 裂解缓冲液提取总蛋白。BCA试剂盒测定蛋白质浓度后,通过10%SDS-PAGE分离等量的蛋白质并转移到聚偏二氟乙烯(PVDF)膜上。用5%脱脂牛奶封闭2 h 后,加入一抗LC3、p62、p-PI3K、PI3K、p-AKT、AKT、GAPDH 在4 ℃下孵育过夜,然后在室温下与HRP偶联的羊抗兔二抗孵育1 h 后,加入ECL 试剂可视化蛋白,利用Image J 软件分析目的蛋白质条带灰度值。
1.3 统计学方法
采用SPSS 22.0 统计软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠血清中Cr和BUN水平的比较
与对照组比较,模型组大鼠血清中Cr、BUN 水平升高;与模型组比较,Sufen 组大鼠血清中Cr、BUN 水平回降,LY294002 组大鼠血清中Cr、BUN水平回升;与Sufen组比较,Sufen+LY294002组大鼠血清中Cr、BUN水平升高,见表1。
表1 各组大鼠血清中Cr和BUN水平比较±s,n=12
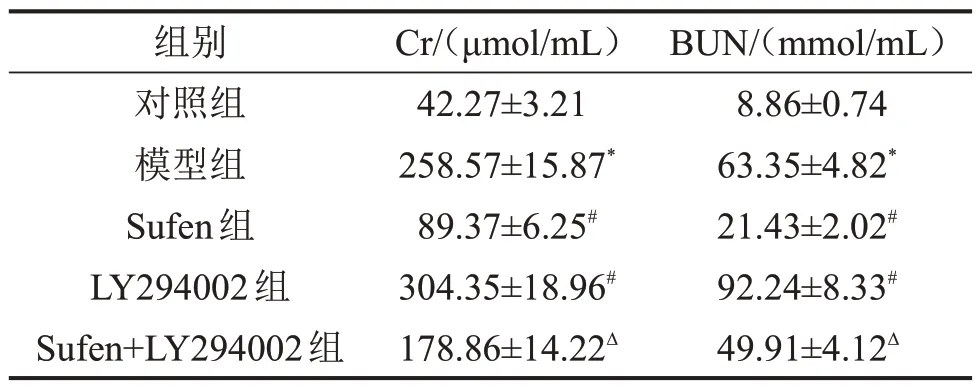
表1 各组大鼠血清中Cr和BUN水平比较±s,n=12
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与Sufen 组比较,ΔP<0.05。
2.2 各组大鼠肾脏组织病理学变化比较
与对照组比较,模型组大鼠肾脏组织中的肾小管损伤严重,如出现白细胞浸润,肾小管扩张,管型形成,病理评分升高;与模型组比较,Sufen 组大鼠肾脏组织中的肾小管损伤减轻、病理评分降低,LY294002组大鼠肾脏组织中的肾小管损伤加剧,病理评分升高;与Sufen组比较,Sufen+LY294002组大鼠肾脏组织中的肾小管损伤严重、病理评分升高,见图1和表2。
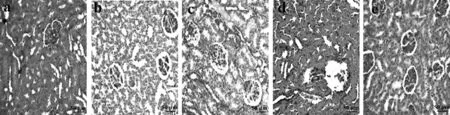
图1 各组大鼠肾脏组织HE染色结果
表2 各组大鼠肾脏组织病理评分比较±s,n=3

表2 各组大鼠肾脏组织病理评分比较±s,n=3
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与Sufen 组比较,ΔP<0.05。
2.3 各组大鼠肾脏组织氧化应激水平比较
与对照组比较,模型组大鼠肾脏组织中MDA含量升高,SOD 活性降低;与模型组比较,Sufen 组MDA 含量降低,SOD 活性升高,而LY294002 组MDA 含量升高,SOD 活性降低;与Sufen 组比较,Sufen+LY294002组MDA含量升高,SOD活性降低,见表3。
表3 各组大鼠肾脏组织中MDA含量、SOD活性的比较±s,n=3
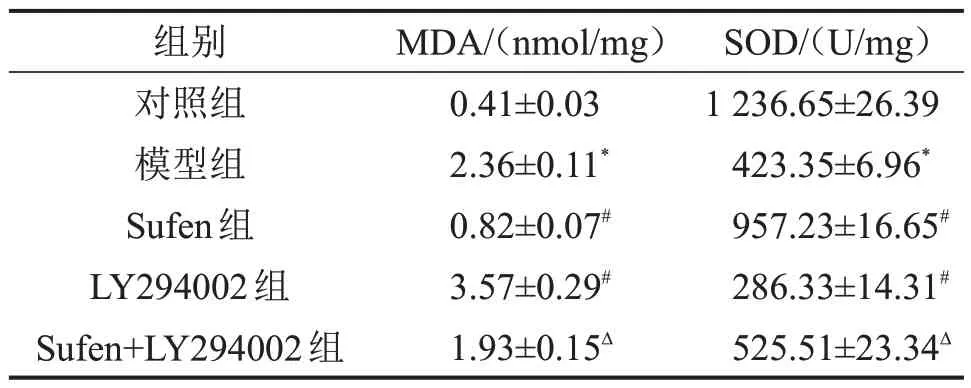
表3 各组大鼠肾脏组织中MDA含量、SOD活性的比较±s,n=3
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与Sufen 组比较,ΔP<0.05。
2.4 各组大鼠肾脏组织中自噬小体形成比较
与对照组比较,模型组大鼠肾脏组织中自噬小体的数量增加;与模型组比较,Sufen组大鼠肾脏组织中自噬小体的数量减少,LY294002组大鼠肾脏组织中自噬小体的数量增加;与Sufen 组比较,Sufen+LY294002组大鼠肾脏组织中自噬小体的数量增加,见图2。

图2 透射电子显微镜观察自噬小体的形成(×50 000)
2.5 各组大鼠肾脏组织中自噬相关蛋白表达比较
与对照组比较,模型组大鼠肾脏组织中LC3-Ⅱ/LC3-Ⅰ升高,p62蛋白表达降低;与模型组比较,Sufen 组大鼠肾脏组织中LC3-Ⅱ/LC3-Ⅰ降低,p62蛋白表达升高,而LY294002 组大鼠肾脏组织中LC3-Ⅱ/LC3-Ⅰ升高,p62蛋白表达降低;与Sufen组比较,Sufen+LY294002 组大鼠肾脏组织中LC3-Ⅱ/LC3-Ⅰ升高,p62蛋白表达降低,见图3和表4。
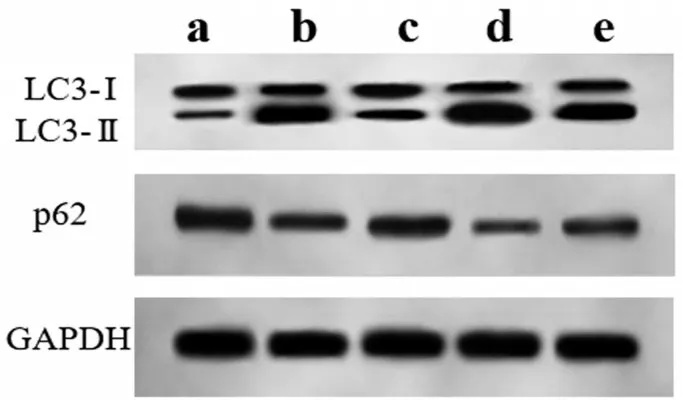
图3 Western blotting检测LC3、p62蛋白表达
表4 各组大鼠肾脏组织中自噬相关蛋白表达比较±s,n=6
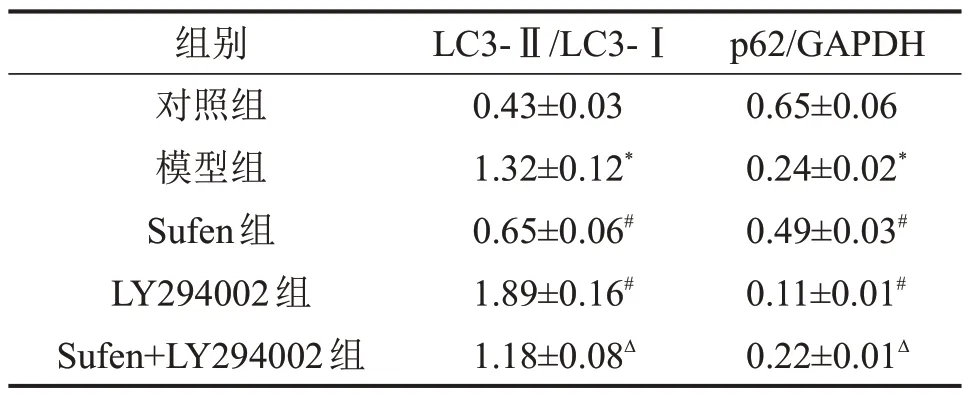
表4 各组大鼠肾脏组织中自噬相关蛋白表达比较±s,n=6
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与Sufen 组比较,ΔP<0.05。
2.6 各组大鼠肾脏组织中PI3K/AKT 信号通路相关蛋白表达比较
与对照组比较,模型组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT 水平降低;与模型组比较,Sufen组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT 水平升高,而LY294002 组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT 水平降低;与Sufen 组比较,Sufen+LY294002 组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT水平降低,见图4和表5。
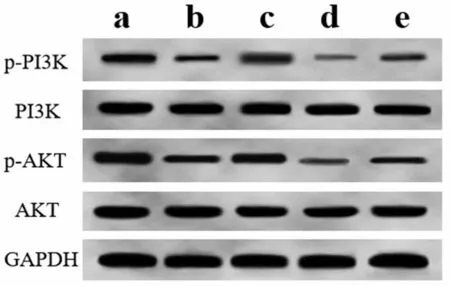
图4 Western blotting检测PI3K/AKT信号通路相关蛋白表达
表5 各组大鼠肾脏组织中PI3K/AKT信号通路相关蛋白表达比较±s,n=6
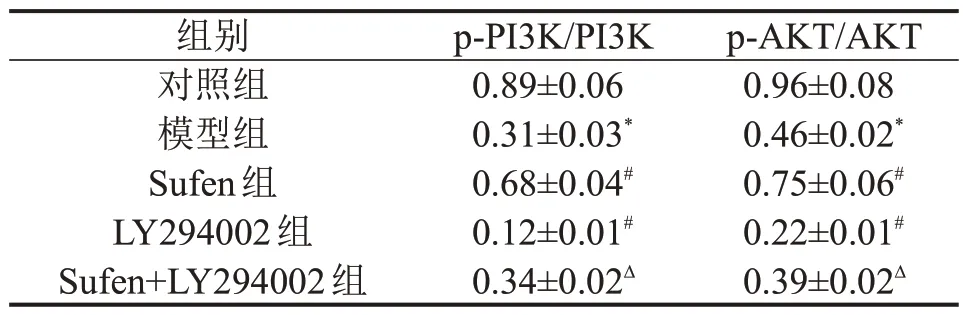
表5 各组大鼠肾脏组织中PI3K/AKT信号通路相关蛋白表达比较±s,n=6
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与Sufen 组比较,ΔP<0.05。
3 讨论
据报道,RIRI 患者血液中Cr 和BUN 水平反映了肾功能损伤的程度,其水平越高,损伤越严重[7]。氧化应激指标MDA可衡量氧自由基及脂质过氧化水平对肾组织的损伤能力,而SOD的活性则反映了机体清除活性氧的能力。本研究结果表明,RIRI模型大鼠肾脏损伤严重,氧化应激增强。肾细胞主要依靠自噬来促进细胞存活和恢复细胞稳态,自噬可有效改善炎症反应,减少氧化应激,而过度的自噬则可导致氧化应激增强,细胞死亡增加。有研究报道,大鼠RIRI后肾组织的自噬活性升高[8];LC3、p62蛋白是自噬过程中的关键蛋白,LC3蛋白存在LC3-Ⅰ、LC3-Ⅱ两种形式,可参与自噬小体的形成,而p62蛋白则参与自噬的降解。本研究结果提示RIRI 模型大鼠中存在过度自噬。
Sufen 是一种合成的阿片类镇痛剂,在缺血再灌注损伤中发挥着重要的调节作用;其通过抑制自噬水平在心肌缺血再灌注损伤中发挥对心脏的保护作用;Sufen 预处理通过抑制氧化应激和线粒体自噬来抑制大鼠心肌缺血再灌注引起的心肌损伤[9]。本研究结果提示,Sufen可能通过抑制氧化应激及过度自噬来发挥对RIRI大鼠肾脏的保护作用。
研究表明,磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kenase B,PI3K/AKT)通路可以改善肾脏、肺、脑等的缺血再灌注损伤。右美托咪定通过激活PI3K/AKT通路减轻大鼠肺缺血再灌注损伤[10];丹红注射液可激活PI3K/AKT 通路发挥对脑缺血再灌注损伤大鼠的神经保护作用[11]。本研究结果证明,在RIRI 模型大鼠中PI3K/AKT 通路被抑制,提示Sufen 可能通过激活PI3K/AKT通路来抑制过度自噬,进而发挥对RIRI大鼠肾脏的保护作用。本研究利用PI3K/AKT通路抑制剂LY294002进行干预,发现与模型组比较,LY294002组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT 水平降低,氧化应激及自噬活性增强,肾脏损伤加剧;与Sufen 组比较,Sufen+LY294002 组大鼠肾脏组织中p-PI3K/PI3K、p-AKT/AKT水平降低,氧化应激及自噬活性增强,肾脏损伤严重,证明了Sufen可能通过激活PI3K/AKT 通路来抑制过度自噬,进而发挥对RIRI大鼠肾脏的保护作用。
综上所述,Sufen可能通过激活PI3K/AKT通路来抑制过度自噬,进而发挥对RIRI大鼠肾脏的保护作用。
