IAV绝对定量PCR构建及其在体外感染巨噬细胞中的实验研究*
2022-05-29张潇剑袁江浪孔星星樊晓晖张增峰罗小玲
阙 婷,蓝 利,2,张潇剑,袁江浪,孔星星,樊晓晖,张增峰,唐 深,2△,罗小玲△
(广西医科大学 1.基础医学院;2.广西高校基础医学研究重点实验室,南宁 530021)
甲型流感病毒(IAV)属正黏病毒科,是一种能在呼吸道黏膜上皮细胞中增殖,并引起呼吸道感染的单股负链RNA病毒[1]。由于病毒基因组具有较高的变异率,导致遗传抗原漂移和基因重组,使病毒复制能力和宿主致病性及范围均发生改变,从而实现跨种属感染和传播[2-3]。有报道称,在人类和动物模型中,流感病毒感染宿主导致不良临床结局通常与促炎细胞因子和趋化因子升高有关,轻者仅表现亚临床的上呼吸道感染,重者可为致命的下呼吸道感染,并进展为呼吸道窘迫综合征(ARDS)等多器官衰竭,甚至死亡[4]。
巨噬细胞是感染免疫机制研究中重要的细胞类型[5]。体外人源诱导的巨噬细胞主要包括2 个来源,即外周血单个核细胞(PBMC)和人髓系急性白血病单核细胞(THP-1)。选用人PBMC原代巨噬细胞作为体外模型构建,更能接近人生理状态,但是其数量难以满足实验需求。目前,病原学检测是IAV 的筛查、确认的重要检测手段。由于病原分离培养的条件和技术水平高、周期长,病毒量的收获易受环境和样本质量的影响,不利于在常规实验室开展[6]。因此,本研究拟建立实时荧光PCR(RT-qPCR)绝对定量法准确、快速检测IAV 拷贝数,以THP-1 体外诱导分化为巨噬细胞(Mφ),初步研究IAV 感染Mφ 后的细胞活性和病毒复制水平,为后续研究IAV与宿主固有免疫的相互作用机制奠定基础。
1 材料与方法
1.1 细胞和病毒株
急性单核细胞白血病细胞系THP-1(中国科学院典型培养物保藏委员会细胞库)。禽源H9N2 流感病毒Qa/GX/3139/2012(H9N2)(简称GX3139)为低致病禽流感病毒株,由广西医科大学基础医学院微生物学教研室张增峰教授课题组馈赠。本研究的病毒感染细胞实验均在广西医科大学微生物二级生物安全实验室内完成。
1.2 主要试剂
病毒基因组RNA 提取试剂盒、RNA 逆转录试剂(日本TaKaRa)、TRIzol(北京天根);PUC57 质粒(武汉金开瑞);SYBR®Green Master(美国Roche 公司);引物由Invitrogen 公司合成;佛波酯(PMA,美国Sigma);RPMI1640 培养液、胎牛血清(美国Gibco);青霉素、链霉素(索莱宝生物技术公司)。
1.3 方法
1.3.1 细胞处理与分组 将对数生长期的THP-1细胞经100 nmol/L PMA 刺激48 h 活化为Mφ,设Mφ组和加入不同感染复数(MOI)病毒液的Mφ 感染组。IAV的MOI分别为0.1、0.5、1、1.5、2、5、10、15和20,共9个感染剂量组。
1.3.2 引物的设计与合成 以IAV-M基因序列(GenBank No:MW103403.1)为模板,选取26~1 007 bp 保守区作为扩增目标,根据定量PCR(SYBR Green 法)引物设计原则,采用Primer 5.0 软件设计引物,并在NCBI作BLAST序列比对验证引物特异性,引物序列:IAV-M基因上游:5’-CTTCTAACCGAGGTCGAAACGTA-3’,下游:5’-GGTGACAGGATTGGTCTTGTCTTTA-3’,扩增产物为155 bp。
1.3.3 标准品质粒构建和稀释 参考MW103403.1序列由武汉金开瑞生物技术服务有限公司完成基因合成和标准品质粒构建,并在本实验室完成质粒的转化、扩增和抽提等。将标准品质粒菌液送深圳华大基因公司做序列鉴定,鉴定结果完全符合设计的重组质粒序列。抽提质粒经ND-2000 核酸检测仪测定DNA的浓度,以拷贝数(拷贝数/μL)=阿氏常数×质粒浓度(ng/μL)×10-9/片段大小(bp)×660 公式计算DNA拷贝数。确定DNA的拷贝数作为标准品母液。将标准品母液按10倍倍比连续稀释梯度,依次稀释成108~102copies/μL 范围,以此配制绝对定量PCR标准曲线的扩增标准品。
1.3.4 实时荧光定量PCR(RT-qPCR) 分别使用北京天根Trizol 法提取细胞内病毒RNA 和离心柱方法抽提病毒上清液,分别以500 ng/反应和200 ng/反应模板量,逆转录为cDNA,用Step One 荧光定量PCR(美国Thermo Fisher Scientific公司)进行qPCR扩增检测流感病毒基因拷贝数。qPCR 反应体系:SYBR Green PCR Master Mix(2×)10 μL、上游引物和下游引物各1 μL(10 nmol/L)、标准品质粒1 μL(1 ng),ROX 0.4 μL,加双蒸水至20 μL。PCR 反应条件:95 ℃1 min;95 ℃20 s,56 ℃1 min,共40 个循环。
1.3.5 CCK-8 法检测巨噬细胞活性 将对数生长期的THP-1细胞以2×104个/孔密度接种于96孔板,经100 nmol/L PMA刺激48h活化为Mφ,加入100 μL不同MOI的IAV病毒液,置于37 ℃、5%CO2细胞培养箱中培养24 h 后,每孔加入10 μL CCK-8溶液,避光孵育3.5 h。用全自动酶标仪在450 nm波长检测各孔吸光度(OD)值,计算细胞存活率,即[(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%,并确定以105~106TCID50 的病毒浓度作为MOI 感染剂量感染Mφ模型。
1.3.6 建立IAV感染巨噬细胞模型 THP-1细胞以1×106个/孔接种于6 孔板,PMA 诱导分化为Mφ,根据CCK-8 活性结果,选取105~106TCID50 范围的5个MOI的病毒剂量,作为IAV感染Mφ的体外研究模型,倒置显微镜(莱卡公司)观察细胞形态并拍照,感染24 h后收集培养上清和细胞裂解液。
1.3.7 病毒血凝效价检测 THP-1细胞以1×106个/孔接种6孔板,PMA诱导分化为Mφ,参考上述MOI的病毒感染量,感染细胞24 h后收集培养上清和细胞裂解液。在96孔U型板内做病毒血凝效价检测,每孔加50 μL 上清或50 μL 细胞裂解液,各孔加入50 μL 0.6%鸡红细胞悬液,室温孵育30 min后,观察红细胞凝集现象,以+~++++判断25~100%血凝强度,并读取结果。结果判定:以出现完全凝集的最高稀释度为终点,其稀释度的倒数即为病毒的红细胞凝集滴度。
1.4 统计学方法
采用SPSS 20.0 统计软件分析实验数据,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,相关性分析采用双变量Pearson 检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 qPCR方法的建立及验证
2.1.1 标准曲线的建立 以8 个10 倍稀释度的标准品质粒:1.33×108copies/μL、1.33×107copies/μL、1.33×106copies/μL、1.33×105copies/μL、1.33×104copies/μL、1.33×103copies/μL、1.33×102copies/μL、1.33×10 copies/μL(扩增曲线1~8)作为模板进行荧光定量PCR 反应:质粒标准品的稀释度为1.33×10 copies/μL,其CT 值与模板质粒DNA 拷贝数的线性关系不明显,而检测下限定义为超过95%概率能够扩增PCR产物的最低拷贝数。因此,该方法的灵敏度可达到1.33×102copies/μL。
荧光定量PCR 方法的标准曲线,以1.33×108copies/μL、1.33×107copies/μL、1.33×106copies/μL、1.33×105copies/μL、1.33×104copies/μL、1.33×103copies/μL 6 个不同稀释度的标准品质粒作为模板进行扩增,结果显示,扩增曲线各稀释度线性关系R2=0.999,斜率为-3.345(-3~-3.5),扩增效率(Eff)为99%(90%~110%),说明扩增曲线各个稀释度相关性好,扩增效率达到要求,该方法能够准确反映病毒载量。该引物溶解曲线的Tm值集中形成一个单尖峰,未发现杂峰或双峰,说明无引物二聚体和非特异扩增,设计引物符合qPCR要求,见图1。
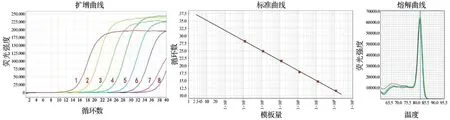
图1 荧光定量PCR标准曲线
2.1.2 重复性 将6个10 倍稀释度的标准品质粒,分别用上述研究建立的荧光定量PCR 方法重复检测3 次。结果显示,标准差(SD)在0.06%~0.16%,变异系数(CV)在0.20%~0.82%,均小于1%,表明该质粒标准品具有较好的重复性和稳定性,见表1。

表1 荧光定量PCR重复性评价n=3
2.2 IAV感染巨噬细胞体外模型构建
2.2.1 CCK-8法检测24 h IAV感染对巨噬细胞细胞活性的影响 与Mφ 组比较,不同MOI 的IAV 病毒液感染Mφ后,细胞活性下降,且与MOI呈负相关关系(r=-0.992,P<0.05),见图2。据此,以MOI=2 和MOI=5组为节点,细胞活性在50%~60%,后续实验选用5个MOI(0.5、1、2、5、10)感染Mφ模型。
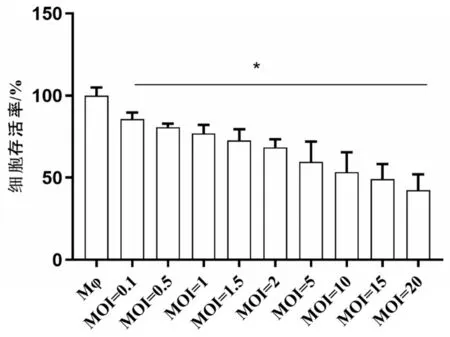
图2 IAV感染巨噬细胞24 h后的细胞活性
2.2.2 倒置显微镜观察IAV感染巨噬细胞后细胞形态学变化 THP-1 经PMA 刺激活化为Mφ,细胞由漂浮透亮的圆形逐渐贴壁,变为灰色不透亮类圆形细胞,形态不规则呈煎蛋样。当加入不同MOI(0.5、1、2、5、10)的IAV 病毒液感染Mφ 24 h 后,Mφ 出现轮廓不清晰,边缘逐渐模糊,胞质内出现大量颗粒,并且随MOI 增大,折光性强的悬浮细胞增多,细胞病变(CPE)逐渐加重,见图3。
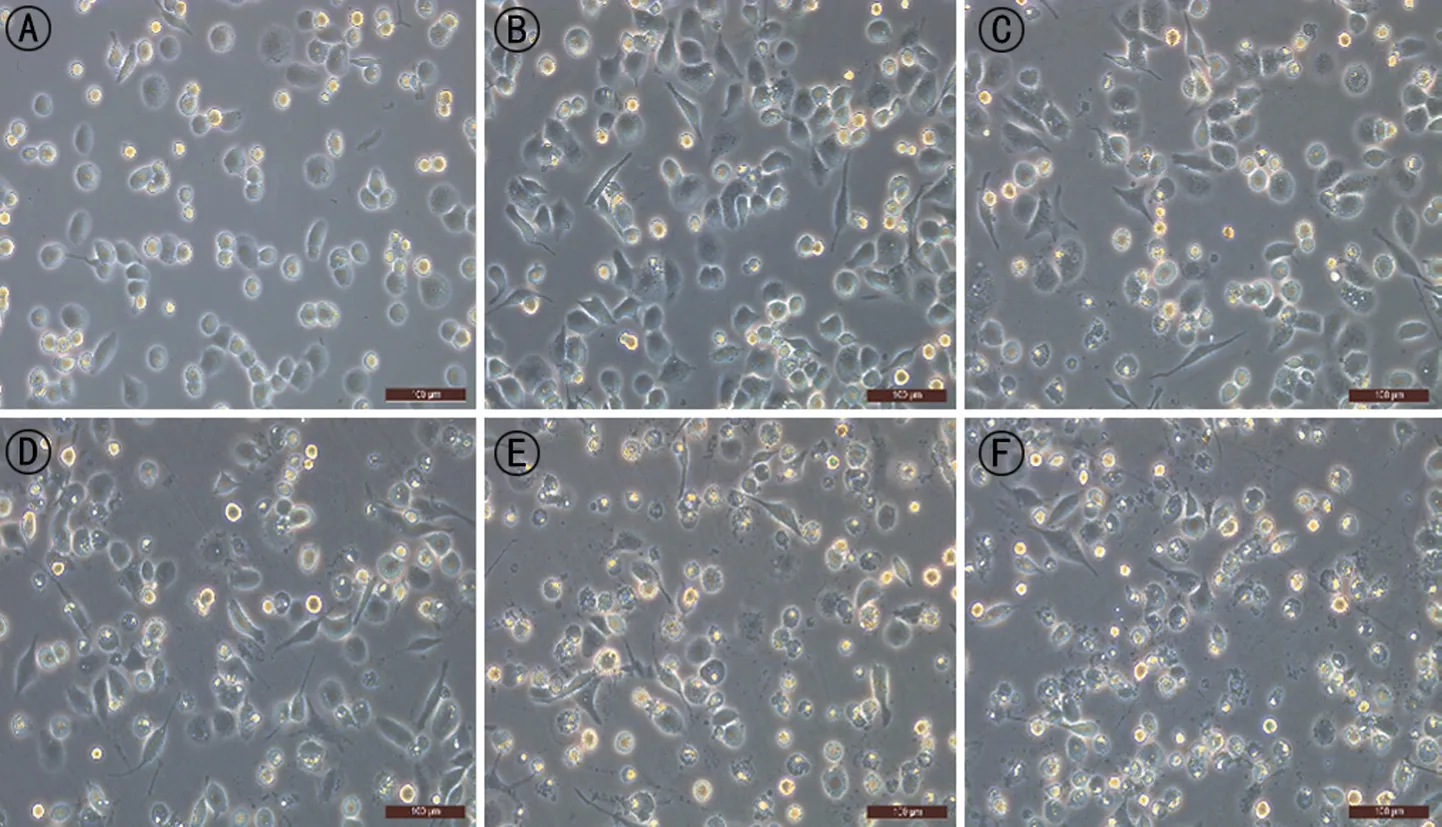
图3 IAV感染后巨噬细胞形态学变化(×200)
2.2.3 IAV感染巨噬细胞后病毒复制情况
RT-qPCR 检测细胞RNA 抽提样本,结果显示:与Mφ 组比较,随着MOI 增大,细胞内病毒M 基因拷贝数增加,核酸拷贝数在1.7×105~4.2×106copies/μL范围,与Mφ感染组呈正相关关系(r=0.869,P<0.05),Mφ感染组间进行比较,差异具有统计学意义(P<0.05),见图4。
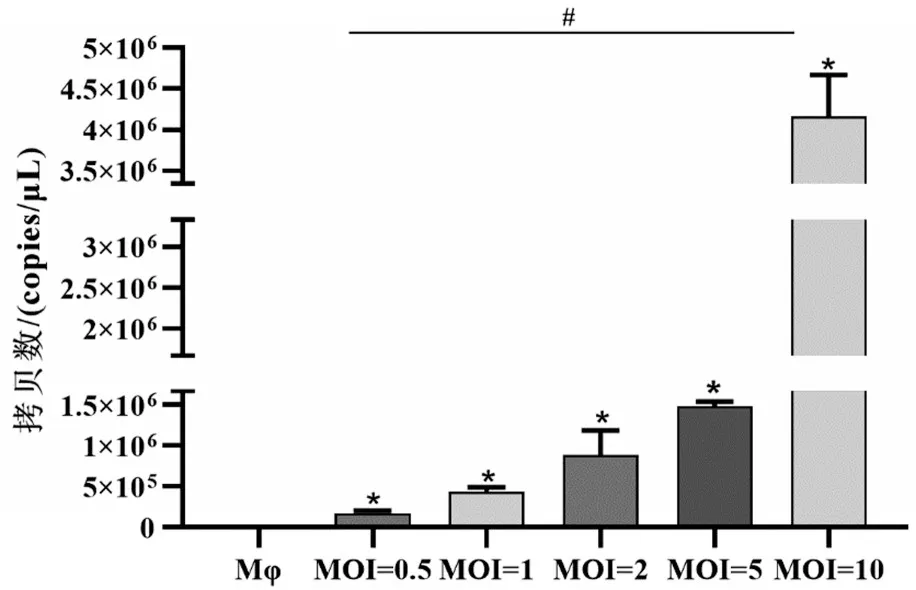
图4 IAV感染巨噬细胞24 h后胞内M基因拷贝数
RT-qPCR检测培养上清液RNA抽提样本,结果显示:与Mφ组比较,随着MOI增大,培养上清M基因拷贝数增加,核酸拷贝数在7×102~5.5×103copies/μL范围,与Mφ感染组呈正相关关系(r=0.990,P<0.05),见图5。提示在Mφ内复制的IAV释放到细胞外,且随感染病毒量增加,释放量也增加。

图5 IAV感染巨噬细胞24 h后上清M基因拷贝数
2.3 血凝实验检测IAV 感染巨噬细胞后细胞内和培养上清液的HA效价
IAV 表面的HA 可以凝集鸡红细胞,通常可用病毒血凝实验检测鸡胚或病毒浓度较高标本的HA效价,以评估病毒的生物复制水平。IAV 感染Mφ 24 h 后,检测细胞裂解液和上清液的病毒HA 效价。随着MOI升高,上清液HA效价呈上升趋势,效价在1∶32~1∶64 范围,而细胞裂解液的HA 效价在1∶64,并未随MOI增加而增加。HA效价结果提示,病毒血凝实验虽然是检测病毒生物复制水平的金标准,但该方法检测敏感度较低,无法区分0.5~10 MOI 范围的IAV 感染Mφ 后病毒复制的变化趋势,见表2。

表2 不同MOI 感染巨噬细胞24 h 后细胞内和培养上清的HA效价
3 讨论
近年来,RT-qPCR 技术应用于传染病的疾病监测中发挥重要作用[7]。但目前,商品化试剂盒检测结果只有定性参考,未进行定量检测[8]。本课题组实验室自建的荧光定量PCR 反应方法是以绝对定量的病毒拷贝数为判定标准,使用流感病毒M基因的保守序列设计特异性引物,构建含M基因重组质粒的标准品绘制标准曲线。结果显示RT-qPCR 的标准曲线为Y=-3.345X+38.454,具有良好的线性关系,检测下限为102copies/μL,10 倍稀释梯度在103~108区分度良好,CV 低于1%,重复性好,同时检测结果为定量结果,提示该方法敏感性高、重复性好,可作为一种快速敏感的定量检测方法。Ni等[9]研究报道,利用绝对定量PCR方法检测IAV,标准曲线的相关系数达到r2=0.991,CT 值与病毒浓度具有良好的相关性,并且检测下限102copies/μL,这与本研究结果相似。
巨噬细胞是机体天然免疫细胞,在启动和控制抗病毒免疫防御中起到核心作用。特别是在流感病毒入侵攻击宿主细胞后,宿主细胞的模式识别受体(PRRs)识别病原相关分子模式(PAMP),激活NF-қB 信号通路和干扰素系统信号,诱导Ⅰ型干扰素、促炎细胞因子(IL-6、MCP-1)产生,从而发挥抗病毒作用[10-11]。另外,有研究报道巨噬细胞不仅作为流感病毒靶标和储库[12],而且在炎症微环境条件下具有高可塑性,并极化为不同表型M1/M2[5,13]。为此,本研究通过CCK-8法和RT-qPCR法来初步构建流感病毒感染巨噬细胞体外感染模型。以THP-1细胞为体外研究模型,通过PMA 刺激活化为Mφ,并加入不同MOI的IAV,结果发现与Mφ组相比,随着MOI 升高,Mφ 活性下降;细胞形态边缘逐渐模糊,细胞质内出现大量颗粒,导致CPE的改变,并且病变程度与MOI 呈正相关关系;以不同MOI 作为Mφ 体外感染模型的剂量,发现感染细胞内和培养上清液中病毒核酸浓度随MOI 增大而升高,提示IAV 感染Mφ 后可复制并释放出子代病毒,并产生细胞病变;IAV 感染Mφ 的复制能力与MOI 呈正相关关系,并与细胞病变程度一致,说明IAV对宿主巨噬细胞具有易感性,能够入侵巨噬细胞内进行复制增殖并释放病毒颗粒对细胞造成损伤,并与感染MOI 剂量呈相关性增长。有研究报道,高致病H5N1 和低致病H7N9 在人类单核细胞来源巨噬细胞中比较,发现高致病H5N1 具有极强复制和传播能力,表明高致病H5N1 病毒具有高毒力的病毒载量,表现多循环感染,能够在宿主细胞内进行有效复制[14]。此外,Li 等[15]从数学模型评估流感病毒在巨噬细胞的病毒复制的动力学和宿主反应的致病性。这与本研究体外感染模型相似。本研究进一步采用病毒血凝实验测定HA 效价,评估IAV 感染Mφ 后细胞内和培养上清的病毒生物合成水平,结果显示,随着MOI 升高,上清液HA 效价呈上升趋势,效价在1∶32~1∶64,而细胞裂解液的HA效价在1∶64。HA 效价的结果不能区分病毒复制趋势,可能是该方法检测敏感度偏低所致,无法显示IAV 在Mφ内复制增殖和感染能力。本研究构建的IAV 实时荧光绝对定量PCR 检测法的特异性和灵敏度较好,并和国外研究者报道一致,结合CPE观察,能有效检测和反映IAV在体外感染Mφ后病毒复制和释放的动态变化。
综上所述,本研究构建的IAV 实时荧光绝对定量PCR 法特异性高,灵敏度较好,能有效检测和评估IAV体外感染巨噬细胞后病毒复制的动态变化情况,为后续深入研究流感病毒感染巨噬细胞的分子机制奠定基础。
