转录因子EB在病毒性心肌炎B细胞中的表达及机制研究*
2022-05-29卢飞玉伍伟锋
卢飞玉,韦 斌,孔 清,黄 凯,伍伟锋
(广西医科大学第一附属医院心内科,南宁 530021)
病毒性心肌炎(viral myocarditis,VMC)是由嗜心肌病毒感染引起的心肌炎症性疾病,其中以柯萨奇病毒B3(coxsackie virus B3,CVB3)感染最为常见,可导致扩张型心肌病和充血性心力衰竭[1]。本课题组前期研究表明,B细胞在VMC的发生发展中发挥了重要的作用[2-4]。B细胞的生长发育成熟以及稳态维持中均存在自噬依赖性[5]。近期文献报道转录因子EB(TFEB)是一个自噬相关的因子[6],在多种心血管疾病中均有表达,参与了自噬相关的信号通路传导[7-8]。但TFEB 在VMC 的B 细胞中表达和其作用机制如何,目前较少见相关报道。因此,本研究通过建立VMC 小鼠模型,检测VMC 小鼠B 细胞中TFEB的表达和自噬标志蛋白LC3Ⅱ/LC3Ⅰ相对表达量;并观察脾脏B细胞(VMC-B细胞)在自噬诱导剂的作用下TFEB 的表达变化及其与自噬的关系,以探讨TFEB 在VMC-B 细胞中的表达及其机制。
1 材料与方法
1.1 材料
SPF 级4 周龄雄性BALB/c 小鼠购自北京维通利华实验动物技术有限公司。本实验所涉及的实验动物均通过广西医科大学实验动物伦理学会审批。CVB3 Nancy株由广西医科大学附属微生物学教学研究室提供。小鼠CD19 MicroBeads购自德国Miltenyi Biotec公司,胎牛血清和RPMI 1640培养基购自美国Gibco 公司,海藻糖购自美国Sigma-Aldrich公司,所有一抗均购自英国Abcam公司。
1.2 方法
1.2.1 VMC 小鼠模型建立与分组 将BALB/c 小鼠随机分为VMC 组和对照组,每组8 只。VMC 组按既往文献[3]方法扩增病毒,8 只BALB/c 小鼠腹腔注射含102TCID50 CVB3病毒液的0.1 mL磷酸盐缓冲盐水(PBS),其中含有大约105个空斑形成单位(PFU)。对照组同一天接受相同剂量的PBS。注射病毒的当天被认为是第0 天。存活小鼠于第14 天颈椎脱臼法处死,无菌条件下采集组织。
1.2.2 B 细胞分离与培养 将VMC 小鼠的脾脏切成小块状,研磨棒轻轻研磨得到单细胞悬液,并对红细胞进行裂解。随后用70 μm 细胞过滤器过滤。使用小鼠CD19 MicroBeads按照制造商的使用说明书(#130-121-301)分离B 细胞,流式细胞仪检测B细胞纯度>90%。对分离的B 细胞进行培养:B 细胞在含有10%胎牛血清的RPMI 1640 培养基中培养,2×106细胞/mL,用白介素(IL-12)(10 ng/mL),anti-IGM(10 μg/mL)和anti-CD40 antibody(5 μg/mL)活化B细胞,随后分为VMC+Tre组和VMC组,VMC+Tre组培养基中加入自噬诱导剂海藻糖(Trehalose,Tre)(100 μmol/L),VMC 组加入等量PBS。两组B细胞均在37 ℃、5%CO2条件下培养48 h。
1.2.3 心肌组织病理学检查 在第14 天取对照组和VMC组小鼠的心肌组织,10%多聚甲醛固定后进行石蜡包埋,切5 μm 厚片行苏木精—伊红(HE)染色,高倍显微镜(×400)下观察心肌炎症程度,并进行病理积分的计算。镜下观察并计算每一个视野中炎性细胞浸润和心肌组织坏死区的面积总和与整个视野面积的比值,其中无心肌损害为0分,病变<25%为1 分,病变≥25%~<50%为2 分,病变≥50%~<75%为3分,病变≥75%为4分。
1.2.4 免疫印迹分析方法(Western blotting)测定各蛋白含量 将小鼠脾脏B细胞置于含有蛋白酶抑制剂和磷酸酶抑制剂的裂解缓冲液(RIPA)中裂解30 min,并进行超声破碎。4 ℃,12 000 r/min 离心15 min,取上清液。用BCA蛋白定量检测试剂盒检测提取蛋白的含量。SDS 聚丙烯酰胺凝胶分离等量蛋白质并转移到PVDF膜上,室温下用5%脱脂牛奶封闭1 h。膜与对应一抗在4 ℃下摇床孵育过夜,其中包括:LC3一抗(1∶1 000);TFEB一抗(1∶1 000);GAPDH 一抗(1∶8 000)。随后用辣根过氧化物酶(HRP)标记的相应的二抗(1∶8 000)室温孵育1 h,用化学发光溶液显影膜并成像。使用Image J 软件进行密度测量。以GAPDH 为内参,使蛋白质条带密度归一化。
1.3 统计学方法
采用SPSS 25.0 软件进行统计分析,计量资料采用均数±标准差(±s)表示。组间比较采用独立样本t检验。采用Spearman 相关进行相关分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组HE染色及心肌病理积分结果
VMC组小鼠表现为毛发紊乱并局部脱落,体重减轻,活动减少,对应激反应不明显或易激惹。对照组小鼠无异常表现。HE 染色结果显示:对照组中未见有炎性细胞浸润或损伤;VMC组小鼠心肌中可见广泛的炎性细胞浸润及坏死(图1A)。与对照组相比,VMC 组心肌病理积分升高(P<0.05)(图1B)。
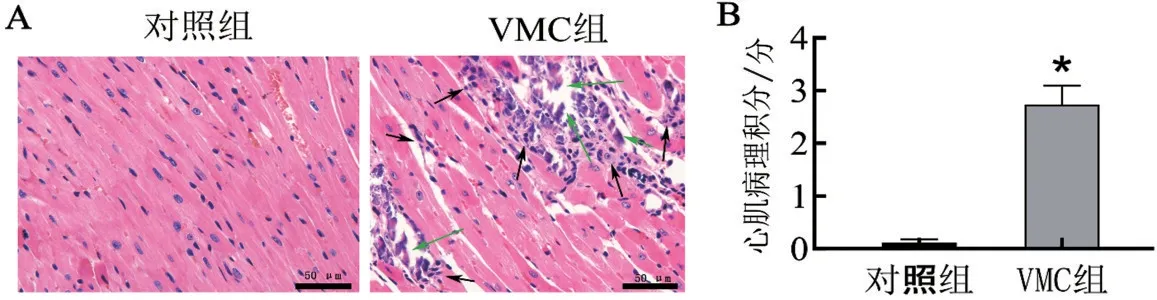
图1 两组心肌组织HE染色及心肌病理积分结果
2.2 VMC小鼠脾脏B细胞中TFEB、LC3Ⅱ、LC3Ⅰ的表达情况
与对照组比较,VMC 组B 细胞中TFEB 蛋白相对表达量、LC3Ⅱ/LC3Ⅰ相对表达量均增高,两组比较差异均有统计学意义(均P<0.05),见图2。
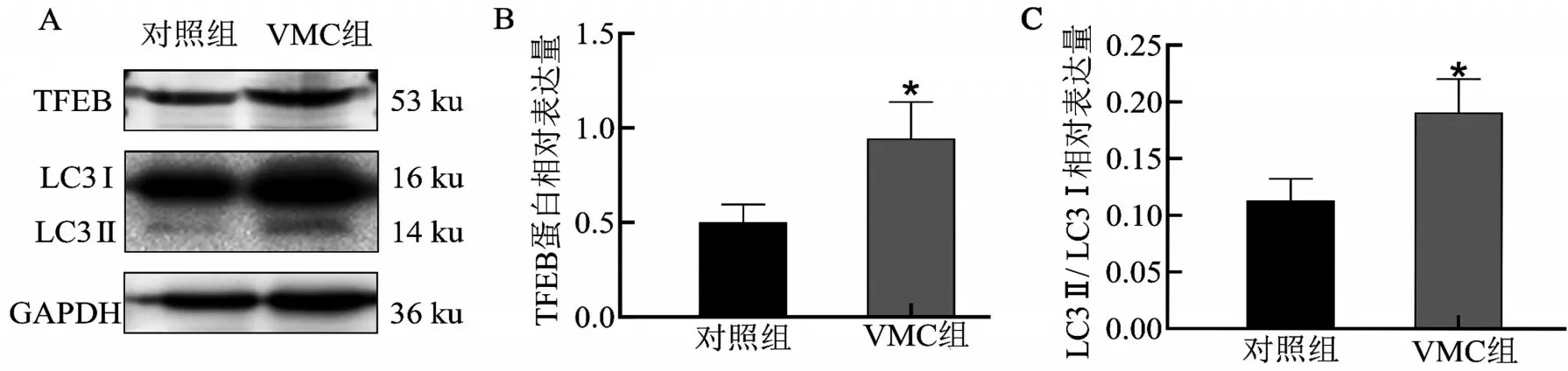
图2 两组B细胞中TFEB、LC3Ⅰ、LC3Ⅱ蛋白的表达水平
2.3 VMC-B 细胞在自噬诱导剂作用下的LC3Ⅱ、LC3Ⅰ和TFEB蛋白的表达情况
与VMC组比较,VMC+Tre组VMC-B细胞中自噬标记物LC3Ⅱ/LC3Ⅰ相对表达量、TFEB 的表达均增高(均P<0.05)(图3A~3C)。相关性分析结果显示,VMC+Tre 组LC3Ⅱ/LC3Ⅰ相对表达量与TFEB 蛋白相对表达量呈正相关关系(r=0.855,P<0.05)(图3D)。
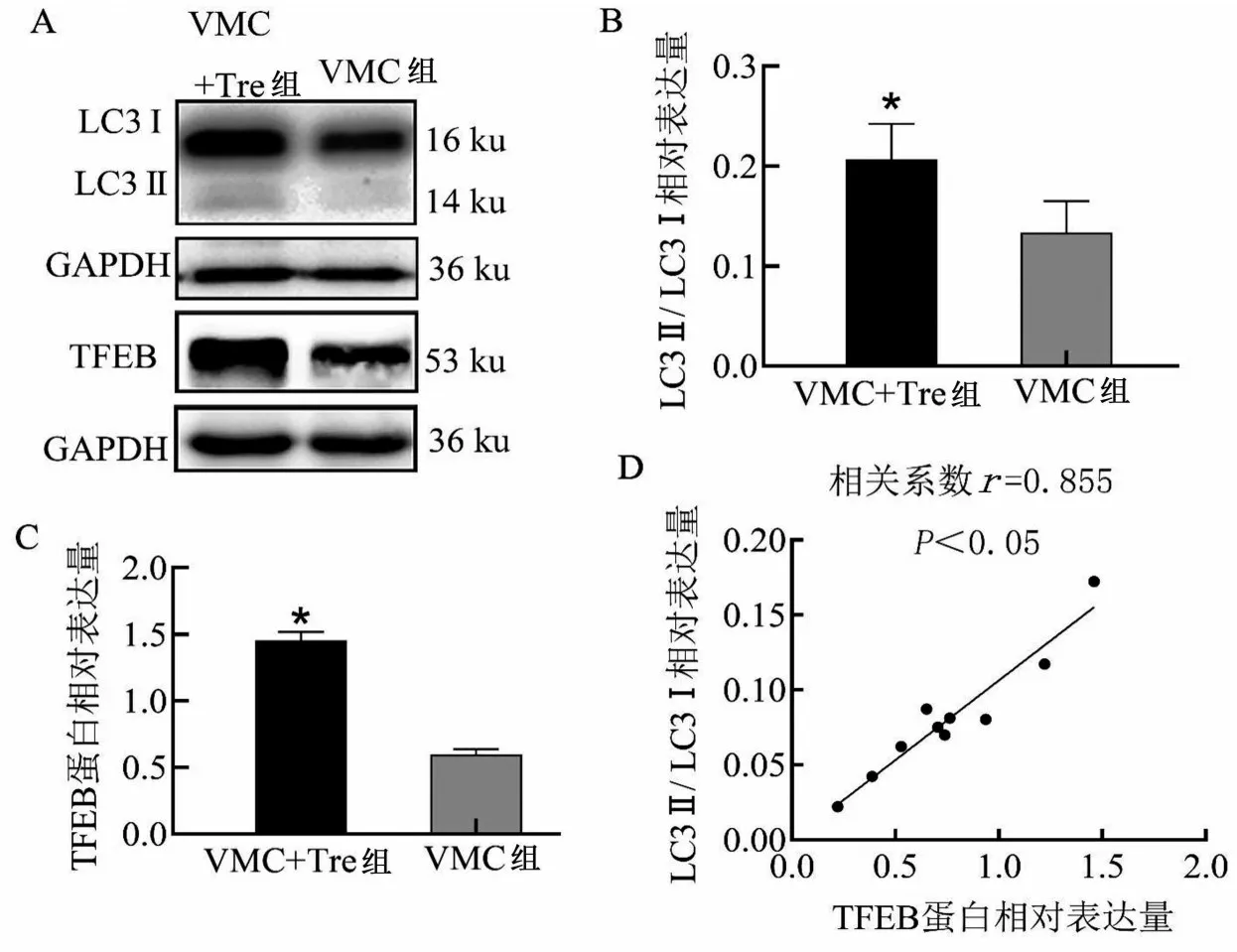
图3 两组VMC-B细胞中LC3Ⅱ、LC3Ⅰ、TFEB蛋白的表达水平及LC3Ⅱ/LC3Ⅰ相对表达量与TFEB蛋白相对表达量的相关性
3 讨论
VMC 是一种由病毒感染引起的心肌炎症性疾病,常见的病原体是CVB3。本研究通过对BALB/c小鼠腹腔注射CVB3 建立VMC 模型[9]。观察发现,VMC 小鼠出现毛发紊乱甚至脱落,活动减少,体重减轻等表现,对照组无异常表现;心肌HE 染色可见,VMC 组小鼠心肌中可见大量炎症细胞浸润甚至局部坏死,与之前报道一致[10],提示VMC 小鼠模型建立成功。
我们的前期研究表明,B 细胞可通过分泌IL-10、TNF-α、IFN-γ 等细胞因子、提呈抗原、促进T 淋巴细胞分化等作用,在VMC 中发挥着重要作用[2-3,11]。文献报道,B细胞的生长发育过程中均存在自噬现象[12]。自噬是一种高度保守的自我降解以对抗不良环境的细胞内过程[13],在去除错误折叠或聚集的蛋白质、清除受损的细胞器以及清除细胞内病原体方面发挥着关键作用[14]。本研究通过Western blotting 检测发现,VMC 小鼠脾脏B 细胞中自噬标志物 LC3Ⅱ/LC3Ⅰ相对表达量增高,表明VMC小鼠B细胞中存在自噬增强现象。
TFEB 是MiT/TFE 转录因子家族中的一员,通过促进溶酶体和溶酶体相关细胞器基因的表达,在溶酶体生物发生和自噬等基本细胞过程的调控中起着关键作用[15-17]。TFEB 可通过调节自噬在心血管疾病中发挥保护作用:在动脉粥样硬化中,TFEB调节巨噬细胞中自噬溶酶体的生物发生,抑制巨噬细胞凋亡和促炎性IL-1β 水平,从而减轻动脉粥样硬化[18];此外,巨噬细胞特异性TFEB 过表达,可通过增强自噬减轻心肌梗死后的心肌重构[19]。心肌TFEB信号在心肌蛋白病中受损,而TFEB过表达可通过提高自噬溶酶体活性来保护心肌细胞免受蛋白毒性[8]。本研究结果显示,与对照组相比,VMC组B细胞中TFEB表达水平增高。为了进一步证明TFEB与自噬的关系,本研究在体外实验中应用Tre。结果显示,与VMC 组相比较,VMC+Tre 组VMC-B细胞中的TFEB 表达水平、LC3Ⅱ/LC3Ⅰ相对表达量均增高,说明VMC-B 细胞在自噬诱导剂的作用下自噬增强的同时,TFEB表达量增高。此外,本课题组通过相关性分析发现,加入自噬诱导剂后的VMC-B 细胞中TFEB 蛋白相对表达量与自噬标志蛋白LC3Ⅱ/LC3Ⅰ相对表达量呈现正相关关系。表明TFEB在VMC-B细胞中的表达与自噬相关,提示TFEB参与了VMC-B细胞自噬的过程。
综上,VMC 小鼠B 细胞中TFEB 表达水平增强,并与自噬增强相关,提示TFEB 可能参与了VMC小鼠B细胞的自噬过程。
