锰中毒小鼠黑质中m6A甲基化及其相关因子的表达研究*
2022-05-29廖嘉家黄夏杰李滋虎覃海兰甘玉清肖友生
廖嘉家,罗 曼,黄夏杰,黄 婉,李滋虎,覃海兰,甘玉清,肖友生,王 进
(广西医科大学第一附属医院神经内科,南宁 530021)
锰是人体必需的微量金属元素,在各种生理过程的正常运作中发挥重要作用,但过量接触锰可导致锰中毒。锰中毒的患者可产生类似帕金森病的症状,如精神障碍、认知功能障碍及运动障碍等[1],这些典型症状的出现主要与神经元损伤有关。目前锰对神经细胞的详细毒性机制尚不清楚。N6-甲基腺苷(N6-methyladenosine,m6A)是存在于mRNA上的甲基化修饰,是目前最常见和最丰富的真核mRNA甲基化修饰类型之一[2]。目前m6A酶系统中有3 种酶蛋白:催化m6A 甲基化的“书写器”(writers)、催化去甲基化的“擦除器”(erasers)和识别甲基化的“阅读器”(readers)[3]。Writers是指m6A甲基转移酶,主要作用是催化m6A 对mRNA 的修饰,包括甲基转移酶3(methyltransferase-like 3,METTL3)、甲基转移酶14(methyltransferase-like 14,METTL14)、Wilms肿瘤1合蛋白(Wilms′tumor1-associating protein,WTAP)等。而erasers 是将m6A 转化为腺苷的去甲基化酶,在真核生物中包括脂肪与肥胖相关基因蛋白(fat mass and obesity-associated,FTO)和AlkB 同源蛋白5(Alk B homologue 5,ALKBH5)等[4]。近年来,m6A 甲基化在神经系统疾病中的作用受到越来越多的关注,但m6A甲基化是否在锰中毒中发挥作用尚未见相关报道。本研究拟建立慢性锰中毒小鼠模型,检测m6A甲基化及其相关因子在锰中毒小鼠黑质中的表达变化,为m6A甲基化在锰中毒中的研究提供依据。
1 材料与方法
1.1 实验动物及处理 实验动物选用成年清洁级雄性昆明小鼠28只,体重(30~35)g,由广西医科大学实验动物中心提供。实验动物生产许可证号:SCXK 桂2020-0003,实验动物使用许可证号:SYXK 桂2020-0004。本动物实验已获得广西医科大学实验动物伦理委员会批准,审批号:202011011,严格遵循“3R 原则”进行。实验前饲养小鼠1 周以适应环境。昼夜交替环境下单笼饲养,自由摄取食物和水。将28只小鼠按照随机数字表法分为4组:对照组和MnCl2低、中、高剂量组,每组7 只。根据课题组前期研究及相关文献报道[5-6],MnCl2低、中、高剂量组染毒剂量分别为10 mg/kg、20 mg/kg、30 mg/kg,对照组给予等量无菌生理盐水。各组每天称量体重并记录;经腹腔注射染毒,1 次/d,共4 周,末次注射观察3 d后颈椎脱臼法处死,取材。
1.2 主要试剂 二氯化锰分析纯购自广东省汕头化学制品厂;反转录试剂盒、荧光定量试剂盒、Trizol试剂均购自南宁科迪生物科技有限公司;m6A RNA甲基化定量检测试剂盒(比色法)购自武汉艾美捷科技有限公司;RNase-free ddH2O、DEPC水、无水乙醇、异丙醇等均购自天根生化科技(北京)有限公司。
1.3 黑质总RNA 提取及cDNA 合成 使用Trizol法提取处理后的小鼠黑质总RNA。NanoDrop1000微量分光光度计检测总RNA的纯度和浓度,-20 ℃冰箱保存备用。按照反转录试剂盒说明书进行操作,反应体系为20 μL(冰上操作),反转录合成好的cDNA于-20 ℃冰箱保存备用。
1.4 实时荧光定量聚合酶链式反应(RT-qPCR)实验检测m6A 甲基化相关基因METTL3、METTL14、WTAP、ALKBH5、FTO的表达 使用RT-qPCR试剂盒检测m6A 甲基化相关基因METTL3、METTL14、WTAP、ALKBH5、FTO的表达。以β-actin为内参,2-△△CT法计算mRNA 相对表达量。RT-qPCR 扩增程序设定为95 ℃30 s,然后95 ℃5s和60 ℃30 s进行40个循环,最后根据仪器默认溶解曲线采集程序保存。引物信息为:β-actin,正向引物5’-TTGCTGACAGGATGCAGAAG-3’,反向引物5’-ACTCCTGCTTGCTGATCCACAT-3’;METTL3,正向引物5’-ATCCAGGCCCATAAGAAACAG-3’,反向引物5’-CTATCACTACGGAAGGTTGGG-3’;METTL14,正向引物5’-CAGGCAGAGCATGGGATATT-3’,反向引物5’-TCCGACCTGGAGACATACAT-3’;ALKBH5,正向引物5’-AGTTCCAGTTCAAGCCCATC-3’,反向引物5’-CTGGCAGAGGAGGTAGTAGTTA-3’;WTAP,正向引物5’-CTGGCAGAGGAGGTAGTAGTTA-3’,反向引物5’-ACTGGAGTCTGTGTCATTTGAG-3’;FTO,正向引物5’-TCAGCAGTGGCAGCTGAAAT-3’,反向引物5’-CTTGGATCCTCACCACGTCC-3’。
1.5 各组小鼠黑质m6A 甲基化水平检测 提取染毒后的小鼠黑质组织总RNA,采用EpiQuik m6A RNA Methylation Quantification Kit(Colorimetric)检测各组小鼠黑质m6A 甲基化水平,步骤如下:取检测板,每孔加80 μL 结合液,然后将2 μL 阴性对照、2 μL阳性对照和200 ng待测样品RNA分别加入指定孔中,封口膜封口,37 ℃孵育90 min;移除结合液,每孔加入150 μL洗涤缓冲液,洗涤后移除,重复3 次;加入50 μL抗体捕获液,室温下孵育60 min;移除抗体捕获液,加150 μL 洗涤缓冲液洗涤3 次;加入50 μL抗体检测液,室温下孵育30 min;移除抗体检测液,加150 μL洗涤缓冲液洗涤4 次;加入50 μL增强液,室温下孵育30 min;移除增强液,加150 μL洗涤缓冲液洗涤5 次;每孔加入100 μL developer溶液,室温避光孵育1~10 min,当颜色变成中度蓝色时,每孔加100 μL终止液,多功能酶标仪测量450 nm处吸光值,绘制标准曲线,根据标准曲线计算各样品总RNA m6A相对含量。
1.6 统计学方法 采用SPSS 20.0统计软件分析数据,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况及体重变化 从第2 周开始,与对照组相比,MnCl2高剂量组体重降低(P<0.05)。从第3 周开始,MnCl2低、中、高剂量组小鼠体重均低于对照组(均P<0.05),见表1。染毒第2 周后,MnCl2高剂量组小鼠出现毛发失去光泽、活动减少、反应下降等现象,染毒第4 周可观察到小鼠肢体震颤;染毒第3 周后,MnCl2低、中、高剂量组小鼠均出现活动减少、反应下降。
表1 各组小鼠不同时间体重变化情况g,n=7,±s
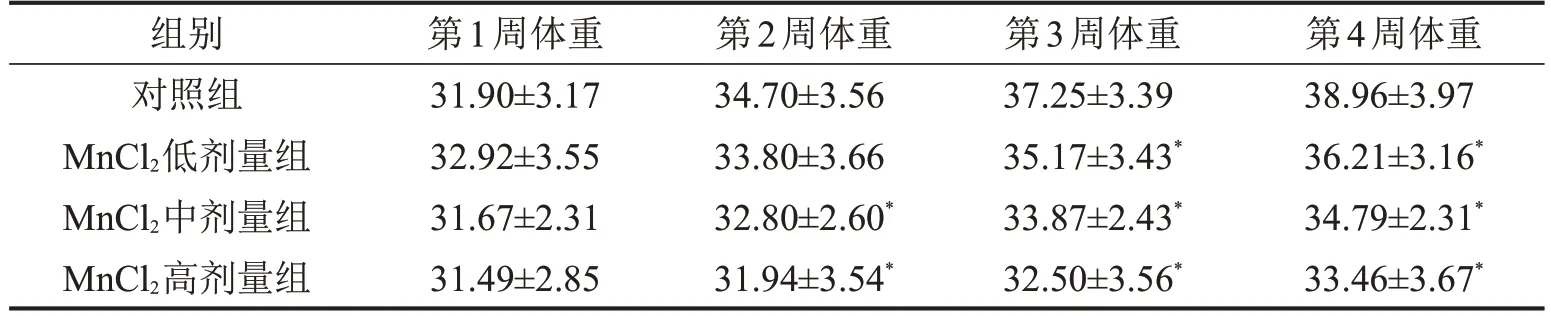
表1 各组小鼠不同时间体重变化情况g,n=7,±s
与对照组比较,*P<0.05。
2.2 对照组与MnCl2高剂量组黑质TH免疫荧光染色结果比较 TH免疫荧光染色结果显示,与对照组相比,MnCl2高剂量组小鼠TH 细胞数减少,说明高剂量MnCl2对小鼠黑质造成了损伤,也进一步支持锰中毒模型的成功建立,见图1。
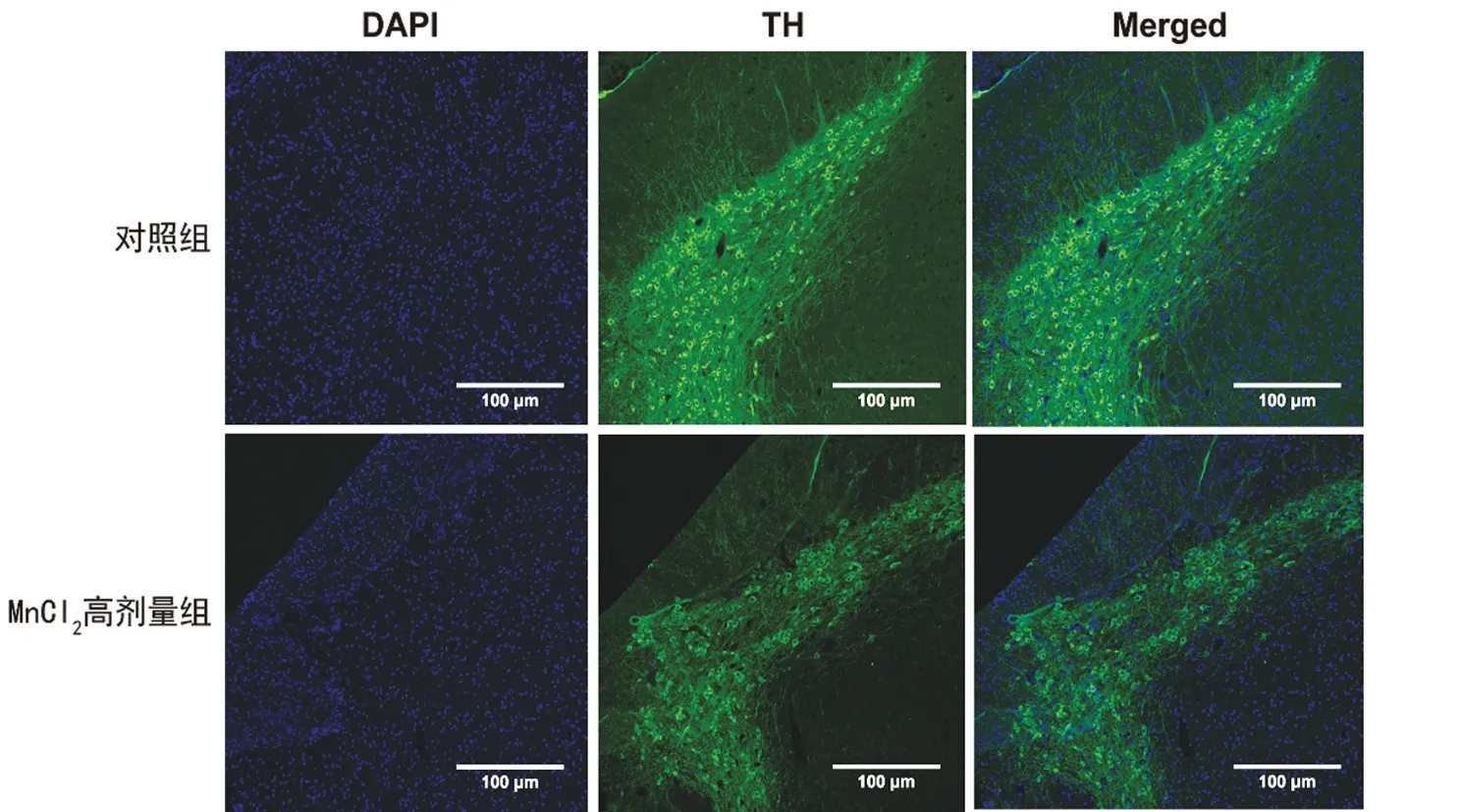
图1 对照组与MnCl2高剂量组黑质TH免疫荧光染色情况(×100)
2.3 各组小鼠黑质m6A 甲基化水平分析 MnCl2各剂量组随着染毒剂量的增加,黑质组织m6A甲基化水平呈现上升的趋势,且MnCl2高剂量组m6A甲基化水平与对照组比较,差异有统计学意义(P<0.05),见图2。
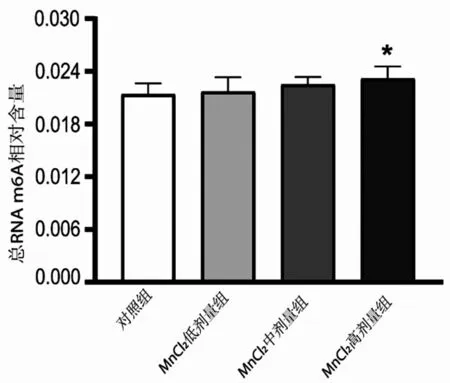
图2 各组小鼠黑质m6A甲基化水平
2.4 m6A 甲基化相关基因在MnCl2高剂量组与对照组小鼠黑质中的表达分析 与对照组比较,MnCl2高剂量组促m6A甲基化基因WTAP及METTL14表达水平比较差异无统计学意义(均P>0.05);MnCl2高剂量组促m6A 甲基化基因METTL3及去甲基化基因ALKBH5、FTO在MnCl2高剂量组的表达高于对照组(均P<0.05),见图3。
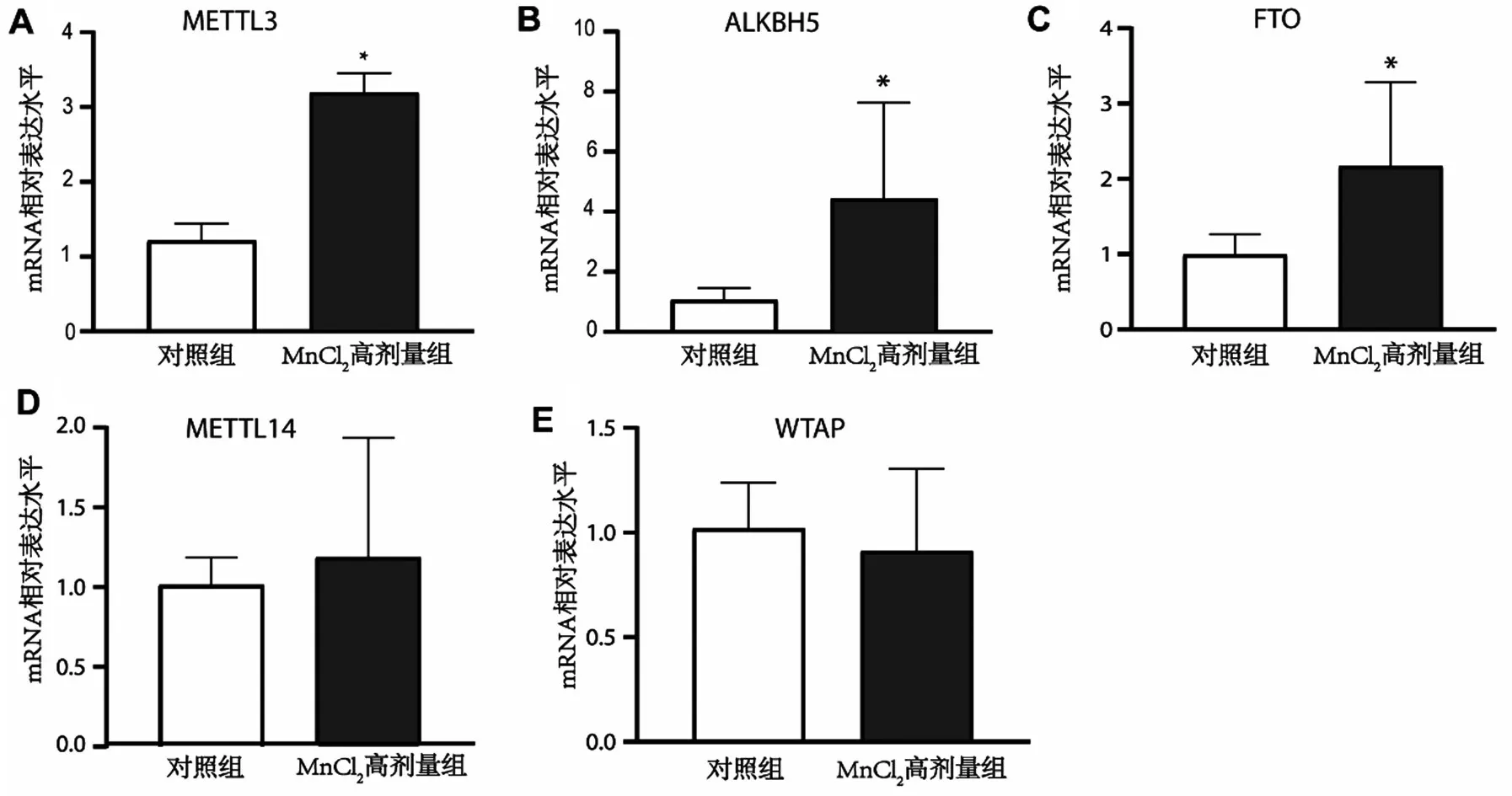
图3 m6A甲基化相关基因在MnCl2高剂量组及对照组小鼠黑质中的表达情况
3 讨论
RNA甲基化被认为是继DNA和组蛋白甲基化之后的又一重大发现,现已发现m6A甲基化修饰与多种神经系统疾病相关,例如,帕金森病(Parkinson’s disease,PD)细胞模型中m6A 甲基化含量降低[8],并且METTL14还可通过损害纹状体功能而导致类PD症状的发生[9]。此外,mRNA m6A甲基化修饰还与阿尔茨海默病(AD)[10-11]、胶质母细胞瘤[12-13]、学习记忆[14-16]等相关。
锰过度暴露除可引起神经功能障碍为主的帕金森综合征,也可促进PD的进展,研究发现,在PD患者的脑脊液中锰含量升高[17],且暴露于锰的非人灵长类动物也可表现出类似PD 和AD 的特征[18-19]。近年来,m6A 甲基化在神经系统疾病中的作用受到极大关注,但其在锰中毒中的相关作用尚未见报道。本研究拟通过腹腔注射染毒的方式构建锰中毒小鼠模型,研究m6A甲基化及其相关因子在锰中毒小鼠黑质中的表达变化,以期为锰致神经毒性的研究提供新的角度。在模型制备过程中观察到染毒小鼠出现体重下降、活动减少、肢体震颤等现象,并黑质TH 阳性细胞数明显减少,可判定成功制备锰中毒小鼠模型。随着染毒剂量的增加,小鼠黑质m6A 甲基化水平呈现上升的趋势,且MnCl2高剂量组小鼠黑质m6A 甲基化水平与对照组比较上调。研究发现,m6A去甲基化基因ALKBH5缺失可能影响神经祖细胞增殖和分化[19],敲低另一个m6A去甲基化基因FTO后不仅提高AD小鼠Tau蛋白的磷酸化水平,并可通过激活mTOR 信号通路调控Tau 蛋白磷酸化[10]。锰积聚可导致线粒体功能障碍、细胞内氧化应激、多巴胺能神经元死亡等过程,已有研究表明,敲除FTO可减少PD 大鼠模型的细胞凋亡[8]。在本研究中,ALKBH5和FTO在MnCl2高剂量组小鼠黑质中的表达高于对照组,根据以上文献报道,我们推测在锰中毒中ALKBH5和FTO可能通过影响神经细胞发育和参与细胞凋亡通路从而导致多巴胺能神经元细胞的死亡,进而产生神经毒素效应。本次研究还发现m6A 甲基化酶METTL3在MnCl2高剂量组小鼠黑质中的表达显著高于对照组,目前关于METTL3在神经退行性疾病中的研究尚少,有研究发现其在AD 小鼠皮质和海马区的表达升高[11]。
本研究存在一定局限性,虽然发现了m6A甲基化修饰与锰神经毒性相关,但具体的机制尚不明确;此外,已有研究证实m6A甲基化相关基因METTL3、ALKBH5、FTO可在细胞炎症反应、神经细胞发育和细胞凋亡中发挥作用,但METTL3、ALKBH5、FTO是否通过上述途径或其他途径在锰神经毒性中发挥作用还有待进一步深入研究。
综上,本研究在锰中毒小鼠模型的基础上,进一步阐述了m6A 甲基化及其相关基因METTL3、ALKBH5、FTO在锰致多巴胺能神经元功能失调中可能发挥的作用,为锰中毒发病机制的深入研究提供了新的方向和治疗靶点。
