绿原酸干预HepG2肝癌细胞诱导肿瘤相关巨噬细胞极化的体外研究*
2022-05-29张潇剑唐立博杨子叶罗小玲
张潇剑,蓝 利,2,阙 婷,唐立博,杨子叶,唐 深,2△,罗小玲△
(1.广西医科大学基础医学院,南宁 530021;2.广西高校基础医学研究重点实验室,南宁 530021)
绿原酸(chlorogenic acid,CGA)是一种含有奎宁酸和咖啡酸的缩酚酸,在咖啡、金银花、绿茶中的含量极为丰富[1],具有抗炎、抑菌、抗氧化、抗肿瘤等作用[2-3]。近年来有关天然化合物对肿瘤的治疗作用研究越来越多。有研究表明,CGA可通过上调人肺腺癌A549 细胞抗氧化酶表达,降低活性氧(reactive oxygen species,ROS)介导的c-Jun NH2 末端激酶、p38激酶和MAPK激酶4的磷酸化,抑制癌细胞增殖[4]。此外,CGA 可增加小鼠脾脏中CD4+T细胞和CD8+T 细胞的比例,减缓乳腺癌生长,提高存活率,并能抑制癌细胞的肺转移[5]。
原发性肝癌是全球第七大常见的癌症,是仅次于肺癌的全球第二大致死率的恶性肿瘤,在病因学和生物学上具有异质性,其中肝细胞癌(HCC)是最常见的组织学亚型[6]。肿瘤微环境(tumor microenvironment,TME)由肿瘤细胞、多种免疫细胞和基质细胞组成,是实体肿瘤发生和发展依赖的特殊组织结构[7-8]。肿瘤相关巨噬细胞(tumor associated macrophages,TAM)在TME的组成中占有重要地位,可占某些TME细胞数量的50%以上。TAM按照功能通常分为两类,即经典激活途径的M1 与交替激活途径的M2,M1 和M2 通过相互转化产生抗肿瘤或促进肿瘤发展两种相反的作用[9-11]。有文献报道,M2样TAM与肝癌的不良预后密切相关[12]。近年来TME中M1与M2型巨噬细胞的极化稳态平衡规律是肿瘤研究的热点,对肿瘤预后有重要的意义。本研究通过诱导人急性单核白血病细胞THP-1 分化为M0型巨噬细胞,利用Transwell细胞共培养技术,构建HCC 细胞HepG2 与M0 共培养体系诱导TAM的生成,初步研究CGA 对肝癌相关TAM 极化的干预作用。
1 材料与方法
1.1 材料
THP-1细胞、HepG2细胞(中国科学院典型培养物保藏委员会细胞库)。CGA(美国Sigma公司),佛波酯(PMA,美国Sigma 公司),青霉素、链霉素(索莱宝生物技术公司),RPMI 1640培养液、MEM培养液、胎牛血清(美国Gibco公司),Transwell细胞培养板(美国Corning 公司),RNA 逆转录相关试剂、TRIzol(日本TaKaRa公司),SYBR Green Master(美国Roche 公司),引物由Invitrogen 公司合成。StepOne 荧光定量PCR 仪、CO2细胞培养箱均为美国Thermo Fisher Scientific产品。
1.2 实验方法
1.2.1 细胞培养 THP-1 细胞和HepG2 细胞分别培养于含10%的胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素的RPMI 1640 培养液和MEM 培养液中,37 ℃、5%CO2培养箱中静置培养。
1.2.2 HepG2与M0共培养 THP-1细胞以3.5×105个/孔接种于12 孔板Transwell 下室,经100 mmol/L PMA 刺激48 h 后,细胞贴壁展开活化为M0 型巨噬细胞[13]。HepG2细胞以1.8×105个/孔接种于12孔板Transwell 上室,与M0 共培养诱导TAM,分为4 组:M0组、TAM组、TAM+50 μg/mL CGA组、TAM+100 μg/mL CGA组。
1.2.3 细胞形态观察 倒置显微镜下观察各组细胞形态学变化、拍照。Image J 软件分析各组圆形/类圆形细胞、长梭形细胞的数量,并计算圆形/类圆形细胞数和长梭形细胞数占总细胞数的百分比。
1.2.4 CCK-8 法检测TAM 样巨噬细胞活性 用PBS 清洗细胞,加入40 μL CCK-8(20 μg/mL)和400 μL RPMI 1640细胞培养液,置于37 ℃细胞培养箱中培养2 h,采用全波长分光光度计检测450 nm波长处的吸光度(A)值。细胞存活率=[(As-Ab)/(Ac-Ab)]×100%。As:实验孔(含有CGA和细胞的培养基);Ac:对照组(含有细胞的培养基);Ab:空白孔(仅有培养基)。
1.2.5 实时荧光定量PCR(RT-qPCR)法检测巨噬细胞极化相关标志物mRNA 表达 用TRIzol 提取细胞总mRNA,逆转录为cDNA,行PCR 扩增,PCR 反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火、延伸10 s,共40个循环。以β-actin为内参,采用2-ΔΔCT法计算目的基因相对表达量。β-actin上游引物序列:5’-TCCTCTCCCAAGTC-CACACAGG-3’,下游:5’-GGGCACGAAGGCTCATCATTC-3’;白介素(IL)-6上游:5’-ACTCACCT-CTTCAGAACGAATTG-3’,下游:5’-CCATCTTTG-GAAGGTTCAGGTTG-3’;IL-10上游:5’-TCAAGGCGCATGTGAACTCC-3’,下游:5’-GATGTCAAACTCACTCATGGCT-3’;CD163上游:CAGCGGCTTGCAGTTTCCTC-3’,下游:5’-TGGCCTCCTTTTCCATTCCAGA-3’;环氧化酶2(COX-2)上游:5’-GCCATGGGGTGGACTTAAATCATA;下游:CAGGGACTTGAGGAGGGTAGATCA-3’。
1.3 统计学方法
采用SPSS 20.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HepG2与M0巨噬细胞共培养后的形态学改变
THP-1 细胞经PMA 刺激活化为M0 巨噬细胞,细胞由悬浮的球形逐渐贴壁,并转变为圆形或类圆形贴壁细胞,并由透亮变为暗灰;与HepG2 共培养后M0极化为TAM样巨噬细胞,呈圆形/类圆形或梭形,随着共培养时间的延长,不规则细胞(b、c)数量增加;共培养72 h后TAM细胞内出现空泡,部分细胞死亡,见图1。
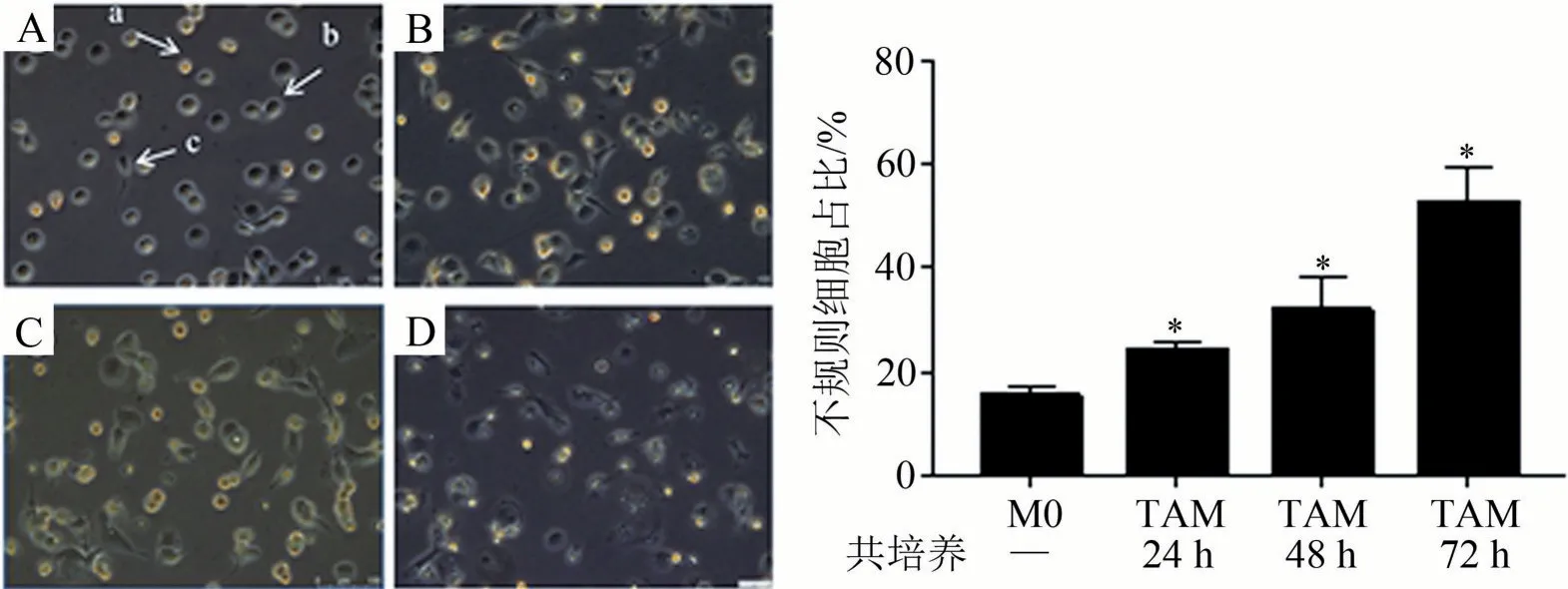
图1 HepG2诱导TAM样巨噬细胞形态学观察(×20)
2.2 共培养时间对TAM样巨噬细胞细胞活性的影响
M0 巨噬细胞与HepG2 细胞共培养24 h、48 h,随着共培养时间延长,细胞存活率升高,共培养72 h后细胞存活率降低,见图2。因此,选择48 h作为后续实验的共培养时间。
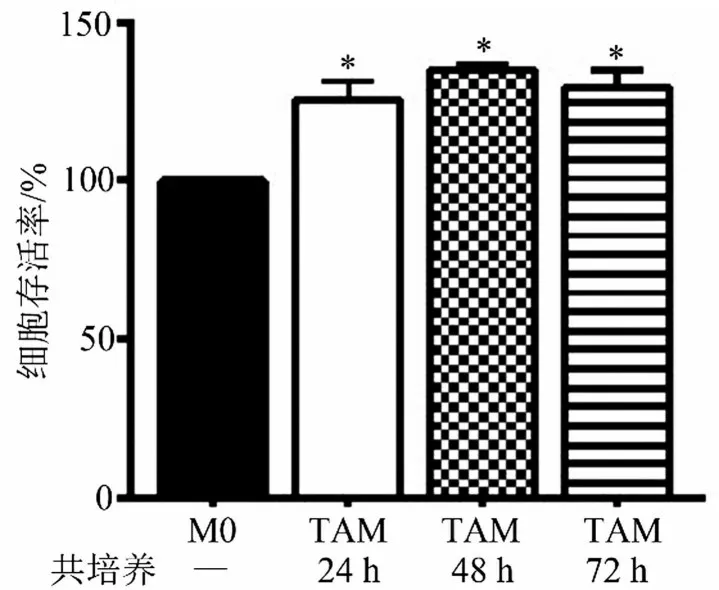
图2 共培养时间对TAM样巨噬细胞存活率的影响
2.3 不同浓度CGA 对TAM 样巨噬细胞活性的影响
分别用25 μg/mL、50 μg/mL、100 μg/mL 和200 μg/mL CGA 干预HepG2 诱导的TAM,共培养48 h,在25~100 μg/mL随着CGA浓度增加,TAM细胞存活率升高,见图3。据此,选择50 μg/mL、100 μg/mL作为后续实验的CGA干预浓度。
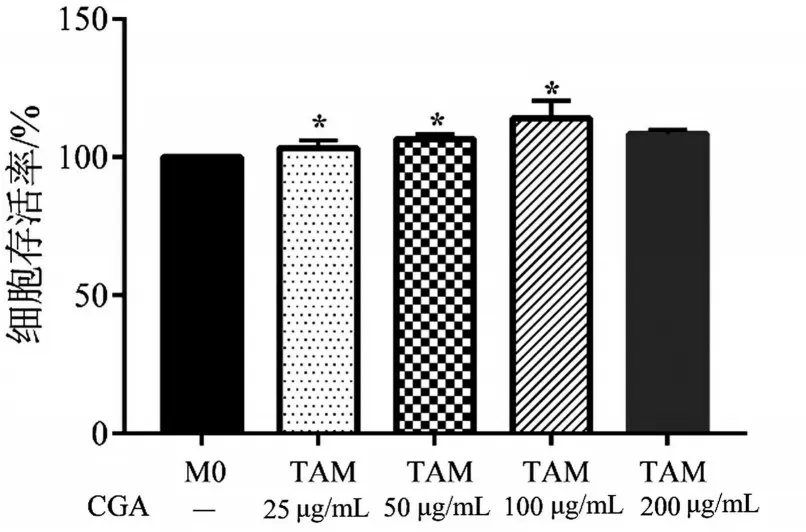
图3 CGA对TAM样巨噬细胞存活率的影响
2.4 CGA对TAM样巨噬细胞形态的影响
50 μg/mL、100 μg/mL CGA 干预HepG2 诱导TAM,共培养48 h,随着CGA浓度增加,不规则圆形带伪足细胞和梭形细胞数量增多,见图4。
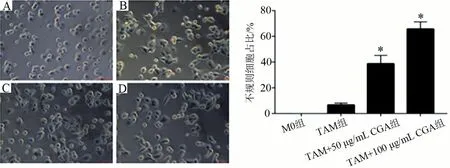
图4 CGA对TAM样巨噬细胞形态的影响(×20)
2.5 各组TAM样巨噬细胞极化相关基因表达水平比较
与M0 组比较,TAM 组IL-10、CD163、COX-2基因表达水平升高;与TAM 组比较,CGA 处理后M2型巨噬细胞标志物IL-10、CD163基因表达水平下降,M1 型巨噬细胞标志物IL-6、COX-2基因表达水平上升,且TAM+100 μg/mL CGA 组CD163基因表达水平高于TAM+50 μg/mL CGA组,见表1。
表1 各组TAM样巨噬细胞极化相关基因表达水平比较±s,n=3
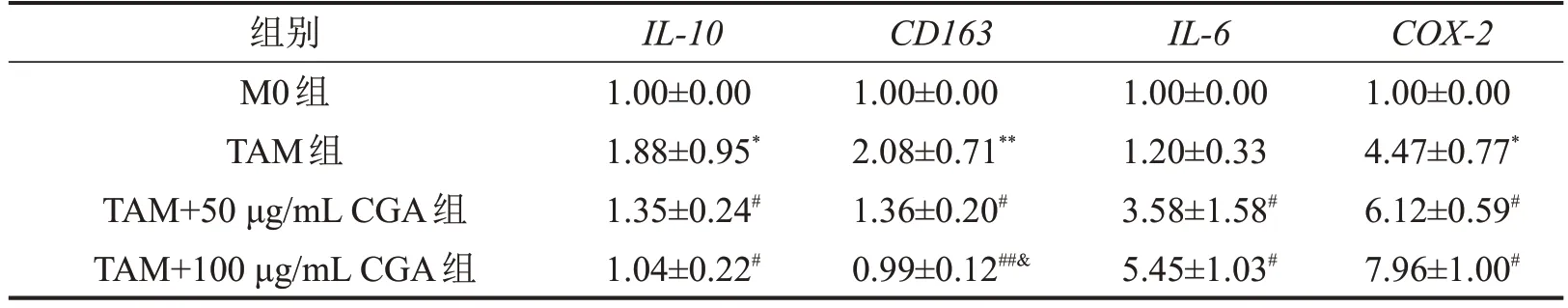
表1 各组TAM样巨噬细胞极化相关基因表达水平比较±s,n=3
与M0组比较,*P<0.05,**P<0.01;与TAM组比较,#P<0.05,##P<0.01;与TAM+50 μg/mL CGA组比较,&P<0.05。
3 讨论
巨噬细胞在先天免疫和适应性免疫中均发挥着关键作用,具有显著的表型异质性和功能多样性。在TME 中,TAM 根据表型和功能的不同被区分为M1样TAM和M2样TAM两种特殊类型[10]。研究发现,逆转M1样TAM向M2样TAM极化有助于机体对抗肿瘤的发展和转移[14]。有学者将THP-1加药极化为M1或M2后与肿瘤细胞共培养,探究不同类型的TAM对使用化疗药物的肿瘤细胞的影响,结果发现,M2 巨噬细胞对依托泊苷诱导的HepG2 和A549 癌细胞凋亡具有明显的保护作用,而M1 巨噬细胞则相反[15]。本研究将THP-1 细胞活化为M0 巨噬细胞后与HepG2 细胞共培养构建体外TAM 模型,结果显示,M0型巨噬细胞极化为TAM后变为不规则类圆形,不规则细胞数占细胞总数比例增加,该形态学变化与结直肠肝转移瘤病理切片研究中TAM的形态学结果相似[16];且M2型TAM样巨噬细胞标志物IL-10、CD163mRNA表达上调,同时TAM中抑制肿瘤进展的M1 型巨噬细胞标志物COX-2mRNA 表达亦明显上调,而IL-6表达无统计学差异。以上结果提示,M0 巨噬细胞与HepG2 共培养48 h后可极化为M2样TAM。
有研究报道,CGA 可抑制人结肠癌HCT116 细胞和HT29 细胞的增殖;CGA 诱导活性氧的生成并使得细胞周期阻滞在S 期,抑制这两种细胞中ERK的激活从产生抗癌作用[17]。Xue 等[18]研究发现,在体内、外恶性神经胶质瘤模型中,CGA 通过促进STAT1 的激活或抑制STAT6 的激活来调节RAW264.7 巨噬细胞M2 到M1 的极化,从而抑制胶质瘤的发展。本研究结果显示,50 μg/mL、100 μg/mL CGA 处理TAM 48 h 后,随着浓度增加TAM 样巨噬细胞由不规则的圆形生出伪足,变成狭长的梭形,梭形细胞数量增多;M1型巨噬细胞相关标志物IL-6、COX-2表达水平上升,M2 型巨噬细胞相关标志物IL-10、CD163表达水平下降,且100 μg/mL 较50 μg/mL干预作用更强。以上结果表明,CGA能抑制M2 型TAM 样巨噬细胞标志物的表达,增强M1型巨噬细胞标志物的表达,提示CGA 可促进体外HepG2细胞诱导的M2样TAM向M1样巨噬细胞极化。
综上所述,本研究通过构建体外HepG2诱导的M2 样TAM,并用不同浓度CGA 干预,结果显示CGA 可以促进肝癌相关TAM 由M2 样向M1 样TAM 极化,提示这可能是CGA 抗肝癌作用机制之一,为进一步研究CGA抗肿瘤机制提供新的思路。
